一種基于CdSe/ZnS量子點納米簇的電化學發光生物傳感器及其制法和應用的制作方法
本發明涉及一種新型的基于CdSe/ZnS量子點納米簇的電化學發光生物傳感器的研制新方法,以及利用該電化學發光生物傳感器檢測癌細胞的分析方法。
背景技術:
:
電致化學發光(ECL)具有操作簡單,快速,靈敏度高,可控性好等諸多優良的性能特點,ECL生物傳感器作為一種新型的分析檢測裝置正逐漸應用于各種生物分析檢測。[Piper,D.J.E.;Barbante,G.J.;Brack,N.;Pigram,P.J.;Hogan,C.F.Langmuir 2011,27,474–480.]。最近,以量子點為發光材料的ECL生物傳感器和生物分析技術由于其顯著的ECL發光性能、良好的生物相容性以及本身的納米放大效應等諸優點而廣泛應用于分析科學領域。[Lei,J.;Ju,H.TrendsAnal.Chem.2011,30,1351–1359.]。基于量子點ECL的免疫分析測定[Lin,D.;Wu,J.;Yan,F.;Deng,S.;Ju,H.Anal.Chem.2011,83,5214–5221.],適配體技術[Jie,G.F.;Yuan,J.X.;Zhang,J.Biosens.Bioelectron.2012,31,69–76.],DNA檢測[Divsar,F.;Ju,H.Chem.Commun.2011,47,9879–9881.]以及細胞傳感技術等許多方法[Jie,G.F.;Wang,L.;Yuan,J.X.;Zhang,S.S.Anal.Chem.2011,83,3873–3880.]越來越多地應用于生物分子的高靈敏檢測。
癌癥是目前最難治療的疾病之一,嚴重威脅著人們的身心健康。因此對癌細胞靈敏準確的識別和檢測對于癌癥的診斷和治療相當重要。目前,檢測腫瘤細胞的方法有很多,比如流式細胞術[Raddatz,M.-S.L.;Dolf,A.;Endl,E.;Knolle,P.;Famulok,M.;Mayer,G.Angew.Chem.Int.Ed.2008,47,5190–5193.],聚合酶鏈式反應[Zhang,X.;Yu,R.M.K.;Jones,P.D.;Lam,G.K.W.;Newsted,J.L.;Gracia,T.;Hecker,M.;Hilscherova,K.;Sanderson,J.T.;Wu,R.S.S.;Giesy,J.P.Environ.Sci.Technol.2005,392777–2785.],微量測定技術[Xu,Y.;Phillips,J.A.;Yan,J.;Li,Q.;Fan,Z.H.;Tan,W.Anal.Chem.2009,81,7436–7442.]以及細胞濃縮技術[Phillips,J.A.;Xu,Y.;Xia,Z.;Fan,Z.H.;Tan,W.Anal.Chem.2009,81,1033–1039.]等。到目前為止,許多DNA信號放大的技術已經應用于生物分析,比如聚合酶鏈式反應[Wan,G.;EnLim,Q.;Too,H.P.RNA2010,16,1436–1445.],滾環復制放大[Zhou,Y.;Huang,Q.;Gao,J.;Lu,J.;Shen,X.;Fan,C.Nucleic Acids Res.2010,38,e156.],鏈置換放大[Qiu,L.P.;Wu,Z.S.;Shen,G.L.;Yu,R.Q.Anal.Chem.2011,83,3050–3057.]以及基于核酸外切酶和內切酶的放大技術[Zhang,H.;Li,F.;Dever,B.;Li,X.F.;Le,X.C.Chem.Rev.2013,113,2812–2841.],然而這些方法均需要穩定的熱環境或者生物酶的參與。最近報道的雜交鏈式反應作為一種DNA自聚合的過程[Choi,H.M.T.;Chang,J.Y.;Trinh,L.A.;Padilla,J.E.;Fraser,S.E.;Pierce,N.A.Nat.Biotechnol.2010,28,1208–1212.],在沒有生物酶參與的情況下實現了對生物分子的高選擇性和特異性檢測。所有無酶放大技術中,雜交鏈式反應受到研究者的廣泛青睞[Peng,Y.;Choi,H.M.T.;Calvert,C.R.;Pierce,N.A.Nature 2008,451,318-322.],已經應用于核酸和蛋白質的分析檢測[Zhu,G.,Zheng,J.,Song,E.,Donovan,M.,Zhang,K.,Liu,C.,Tan,W.,Proc.Natl.Acad.Sci.U.S.A.2013,1107998–8003.]。然而,還鮮有報道將雜交鏈式反應放大技術與ECL結合,并應用于癌細胞的高靈敏檢測。
以CdSe/ZnS量子點為發光材料,以納米金表面DNA雜交鏈式反應為放大手段,研制一種新型的CdSe/ZnS量子點納米簇ECL生物信號探針。合成一種新型的具有良好導電性和磁性的納米金棒,構建具有納米放大效應的磁性修飾電極,用以負載大量的捕捉DNA分子。納米金表面引發雜交鏈式反應,大量量子點通過發卡DNA修飾到電極上,產生放大的ECL信號。基于目標細胞對適體(c-DNA1)的特異性識別,將CdSe/ZnS量子點納米簇ECL生物探針與DNA雜交鏈式反應放大技術相結合,實現對癌細胞高靈敏、高選擇性的檢測,該項研究對癌細胞的早期臨床檢測具有很好的應用前景。
技術實現要素:
:
本發明的目的之一是提供一種具有良好導電性和磁性的Au-Fe2O3磁性納米金棒,構建具有納米放大效應的磁性修飾電極,用以負載大量的捕捉DNA(c-DNA1)分子。具體包括以下步驟:
步驟1.納米金種子生成:
0.25mL 0.01M的HAuCl4和9.75mL 0.1M的CTAB(十六烷基三甲基溴化銨)加入到15mL的塑料管中混合均勻,再將0.6mL 0.01M的NaBH4溶液迅速倒入到上混合液中,然后快速的反復倒置搖晃塑料管2min,室溫下將混合物放置2h后備用。
步驟2.納米金棒的生成:
2.0mL0.01M的HAuCl4和0.4mL 0.01M的AgNO3與40.0mL0.1M的CTAB加入到50.0mL的三口燒瓶中,混合均勻后用1.0M的HCl溶液調節pH大約在1-2,再加入0.32mL的抗壞血酸(維生素C),然后取0.02mL上述合成的CTAB穩定的納米金種子溶液加入到增長液中,將溶液搖勻后靜置16h。
步驟3.Au-Fe2O3磁性金棒的合成:
首先將10.0mL納米金溶液加到0.12mL0.05M的乙酰丙酮鐵(以乙腈為溶液)中,然后用1.0M的NaOH調節溶液的pH至9左右(大約用0.3mL),攪拌混勻,將溶液轉入25.0mL的聚四氟乙烯反應釜中,在190℃的恒溫烤箱中加熱3h后拿出,自然冷卻至室溫,將獲得的產物離心清洗兩次后重新分散到去離子水中。
步驟4.磁性修飾電極的形成
磁性金電極依次使用1.0μm、0.3μm和0.05μm的α-Al2O3拋光粉拋光,用二次蒸餾水超聲洗滌后自然晾干,將8μL的磁性納米金棒溶液滴到磁性金電極的表面并自然晾干。然后將10μL的適體DNA(C1)滴加到電極的表面,溫浴反應10~16h。
本發明的目的之二是提供一種新型的CdSe/ZnS量子點納米簇ECL信號探針。具體包括以下步驟:
步驟1.NaHSe的制備:0.0950g的NaBH4加入10mL的離心管中,在離心管中加入6mL的去離子水,加入磁子攪拌溶解,通氮氣排出多余的氧氣,稱取0.0947g的Se粉快速加入體系中,在常溫下攪拌至無色透明(即Se粉完全溶解)
步驟2.CdSe量子點的制備:將0.5709g的CdCl2·2.5H2O加入100mL的三口燒瓶中,50.0mL的去離子水溶解,通氮氣排出多余的氧氣,移取400μL的巰基乙酸加到三口燒瓶中,用1M的NaOH調pH至10-11,溶液變得澄清透明,然后把制得的NaHSe溶液迅速加入到三口燒瓶中,加熱沸騰30-40min得淡黃色澄清溶液。
步驟3.CdSe@ZnS量子點的制備:將制得的CdSe量子點溶液在水浴中保持45℃,分別在5mL的去離子水中溶解0.21gNaS·9H2O和0.25gZnSO4,然后將兩溶液交替加入到CdSe量子點中,反應30min,冷卻至室溫,即得到CdSe@ZnS量子點。所得量子點于棕色瓶中避光保存備用。
步驟4.CdSe/ZnS量子點-發夾DNA信號探針的組裝(溶液b):按照使用說明,將帶有氨基的發夾DNAH1和H2溶解,再稀釋至濃度為1.0×10-5M,以備實驗使用。取100μL的CdSe@ZnS-COOH的量子點加入到1.5mL的離心管中,加入10μL的0.1mol/L的EDC和10μL的0.025mol/L的NHS溶液,室溫下活化反應30min。活化后離心管中加入100μL的H1和H2,室溫下反應16h后10000rpm下離心重新分散至100μL溶液,記為溶液b,保存備用。
本發明的目的之三是提供一種基于CdSe/ZnS量子點納米簇信號探針的電化學發光生物傳感器,以及采用該生物傳感器檢測癌細胞的分析方法。它由下列步驟組成:
步驟1.納米金-DNA引發鏈的組裝(溶液a):取1mL的金膠溶液,按一定的比例加入P1和S1,在37℃下震蕩溫育16h,反應完全后在10000rpm下離心30min后重新分散至100μL,記為溶液a,4℃下保存備用。
步驟2.將帶有適體DNA的電極浸入到溶液a中,用鋁箔紙封好后,在37℃的條件下震蕩溫育1~2h后用pH=7.4的PBS緩沖溶液沖洗未反應的溶液,然后將此標記的電極浸入到溶液b中,同樣用鋁箔紙封好,在37℃的條件下震蕩溫育1~2h,取回電極用pH=7.4的PBS緩沖溶液沖洗未反應的溶液,制成檢測細胞的ECL的生物傳感器。
步驟3.癌細胞的電化學發光(ECL)檢測。將ECL傳感器分別與100μL含有不同濃度(例如1000個細胞每毫升)細胞的PBS溶液震蕩溫浴45~60分鐘。
將步驟3處理后的基于CdSe/ZnS量子點納米簇的電化學發光傳感器清洗,在含有0.05M K2S2O8和0.1M KCl的0.1M PBS(pH 7.4)緩沖液中,進行電化學發光的測試,發光強度與待測樣品(癌細胞)的濃度成線性關系。
所述的電化學發光測試是以修飾好的金電極(基于CdSe/ZnS量子點納米簇的電化學發光傳感器)為工作電極、Pt電極為對電極、甘汞電極為參比電極的三電極體系,用MPI-A型電致化學發光儀,在0到-1.5V進行循環伏安掃描,光電倍增管高壓設為500~700V。
本發明利用了磁性納米金棒良好的磁性、導電性以及CdSe/ZnS量子點具有極強的發光強度等特點,制備了基于CdSe/ZnS量子點納米簇ECL探針及雜交鏈式反應放大技術相結合的電致化學發光生物傳感器,成功實現了對癌細胞的高靈敏、高選擇性檢測。該項研究對癌細胞的早期臨床檢測具有很好的應用前景。
本發明與現有技術相比,主要優點在于:本發明制備的磁性納米金棒作為修飾電極具有很好的性能,增加了適體DNA在電極上的附著量以及附著的穩定性,提高了檢測的靈敏度;本發明制備的新型的CdSe/ZnS量子點納米簇ECL探針具有極強的電化學發光信號,研制了一種高靈敏的電化學發光生物傳感器,實現了對癌細胞高選擇性的ECL檢測。本發明將納米金放大效應與雜交鏈式反應放大技術相結合,大量的CdSe/ZnS量子點組裝到納米簇上,作為ECL探針,極大地放大了ECL信號,成功對癌細胞進行了高靈敏、高選擇性的檢測,檢測限為23個細胞/100μL。
本發明的電化學發光傳感器表現出了優良的準確性、高靈敏性,穩定性與重現性,分析檢測迅速、方便,該方法在癌細胞的早期臨床分析中具有巨大的應用潛力,可用于實際樣品的檢測。
附圖說明:
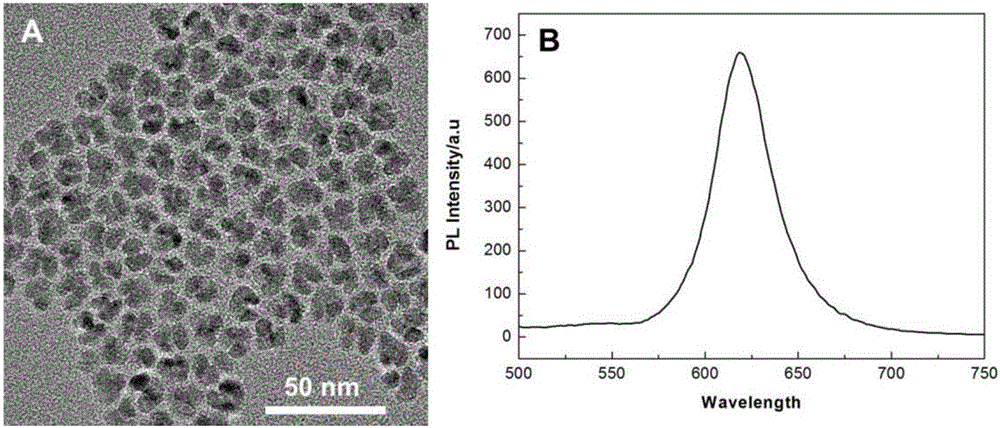
圖1(A)CdSe-ZnS量子點的透射電鏡圖,(B)CdSe-ZnS量子點的熒光光譜圖。
圖2基于CdSe/ZnS量子點納米簇信號探針電化學發光檢測癌細胞的原理圖。
圖3(A)純納米金,(B)基于納米金表面雜交鏈式反應形成的量子點納米簇的原子力顯微鏡圖。
圖4(A)磁性納米金棒修飾到電極上,(B)納米金探針組裝到電極上的掃描電鏡圖。
圖5該傳感器對應不同濃度目標細胞的ECL響應信號,細胞濃度為:個/毫升:(a)0;(b)500;(c)1000;(d)2000;(e)4000;(f)6000;(g)8000;(h)15000。插圖A為ECL的信號變化ΔI與細胞濃度的關系,細胞的濃度為500~20000個/毫升。
圖6(A)該傳感器檢測細胞的標準校正曲線(500~10000個mL-1);(B)該傳感器檢測細胞的選擇性:a)為細胞媒介中純的靶細胞b)靶細胞和干擾細胞加入到細胞媒介中的ECL選擇性柱形圖。
具體實施方式
實施例1.電化學發光生物傳感器的制備及其對癌細胞的檢測
首先將磁性金電極依次使用1.0μm、0.3μm和0.05μm的α-Al2O3拋光粉拋光,用二次蒸餾水超聲洗滌后自然晾干,將8μL的磁性納米金棒溶液滴到電極的表面并自然晾干。然后將10μL的適體DNA(C1)滴到電極表面,溫浴反應10h。
將上述帶有適體的電極洗凈后浸入到納米金-DNA引發鏈(溶液a)中,在37℃的條件下震蕩溫育2h,清洗后再將電極浸入到CdSe/ZnS量子點-發夾DNA信號探針(溶液b)中,在37℃的條件下震蕩溫育2h,制成檢測細胞的ECL的生物傳感器。
將ECL傳感器分別與100μL含有不同濃度(例如:1000個細胞/毫升)細胞的PBS溶液在37℃下震蕩溫浴60分鐘,適體與細胞反應,清洗后的電極可用于電化學發光檢測
實施例2.電化學發光生物傳感器的制備及其對癌細胞的檢測
“將10μL的適體DNA(C1)滴到電極表面,溫浴反應10h”改為”將10μL的適體DNA(C1)滴到電極表面,溫浴反應12h”。制備的其他條件同實施例1,得到形貌與性質類似于實施例1的生物傳感器。對癌細胞檢測的結果同實施例1。
實施例3.電化學發光生物傳感器的制備及其對癌細胞的檢測
“將ECL傳感器分別與100μL含有不同濃度細胞的PBS溶液在37℃下震蕩溫浴60分鐘”改為“將ECL傳感器分別與100μL含有不同濃度細胞的PBS溶液在37℃下震蕩溫浴50分鐘”。制備的其他條件同實施例1,得到形貌與性質類似于實施例1的生物傳感器。對癌細胞檢測的結果同實施例1。
實施例4.電化學發光生物傳感器的制備及其對癌細胞的檢測
“將電極浸入到CdSe/ZnS量子點-發夾DNA信號探針(溶液b)中,在37℃的條件下震蕩溫育2h”改為“將電極浸入到CdSe/ZnS量子點-發夾DNA信號探針(溶液b)中,在37℃的條件下震蕩溫育1h”,制備的其他條件同實施例1,得到形貌與性質類似于實施例1的生物傳感器。對癌細胞檢測的結果同實施例1。
實施例5.電化學發光生物傳感器的制備及其對癌細胞的檢測
“將上述帶有適體的電極洗凈后浸入到納米金-DNA引發鏈(溶液a)中,在37℃的條件下震蕩溫育2h”改為“將上述帶有適體的電極洗凈后浸入到納米金-DNA引發鏈(溶液a)中,在37℃的條件下震蕩溫育1h”,制備的其他條件同實施例1,得到形貌與性質類似于實施例1的生物傳感器。對癌細胞檢測的結果同實施例1。
- 還沒有人留言評論。精彩留言會獲得點贊!