靶向腫瘤的近紅外介孔二氧化硅納米探針及其制備方法與流程
本發明屬于納米材料加工應用技術領域,更具體地涉及一種靶向腫瘤的近紅外介孔二氧化硅納米探針及其制備方法。
背景技術:
介孔二氧化硅通過3-氨丙基-三乙氧基硅烷(3-Aminopropyltriethoxysilane,APTES)修飾后,表面存在大量的不飽和殘鍵和不同狀態的NH2,具有很高的化學活性。納米SiO2是一種正在規模化生產的納米材料,無定型納米SiO2因其吸入和口服對生命體不會造成直接的危害而被認為是生物安全的納米材料,已被廣泛用于生物分析和成像、藥物載體等的研究中。特別是介孔二氧化硅因具有有序介孔結構、比表面積大、毒副作用小、生物相容性好及表面易于修飾等特點,單分散的介孔二氧化硅納米粒子還可以作為其他納米材料的硬模版等特性。介孔孔徑在2-50nm之間通過表面活性劑的性能、用量進行調節,從而賦予其許多獨特的性能,在生物醫藥等領域顯示出了極大的應用前景。目前,介孔二氧化硅在藥物遞送領域廣泛應用。與傳統給藥模式相比,介孔二氧化硅的藥物遞送使得靶向性、生物利用度等都有很大提高,同時此類新型體系可以改善藥物穩定性及藥物釋放動力學行為,從而更大程度地提高治療效果并減小副作用。藥物載體的功能化修飾也趨多樣化,并已成功實現了靶向、成像等多種功能。因此,多功能化的介孔納米二氧化硅藥物、熒光劑等輸送體系是一類具有極大應用價值的新型納米輸送體系。
吲哚菁綠(Indocyanine Green,ICG)是一種水溶性分子,當其經靜脈注入以后,98%--99%的分子會與血漿大分子蛋白緊密結合(主要是白蛋白),只有少量處于游離狀態。其在體內的消除完全經由肝膽系統,由肝細胞主動攝取,再經肝細胞膜上的通道排入膽道,最后進入腸道,并以原型排出體外,其間沒有代謝改變,也不經歷腸肝循環。因而ICG從血液到膽道的消除速率體現了肝臟的排泄分泌功能。ICG在血液15分鐘滯留率是臨床評價肝臟儲備功能的重要指標之一,并常規應用于肝臟手術的術前肝臟儲備功能評估。當ICG受到波長為750—810nm的光波激發以后,會釋放出波長大約為830nm的紅外光。在生物體內,光束會因為血紅蛋白以及水的散射和吸收而迅速衰減。血紅蛋白會強烈地衰減700nm以下的光束(包括除了深紅色以外的全部可見光);而水對于可見光和紅外光而言是“透明”的,但它會強烈地濾除900nm以上的光束。因而,波長處于700—900nm之間的深紅和近紅外光具有最大的組織穿透能力。這也就是為什么從距離表層深達10mm處的ICG所釋放的近紅外光能被偵測到的原因。由于ICG具有上述特點,所以其已經在臨床使用了40余年。長期以來的不良反應報道,只有少數個體會因為使用了含碘劑型的ICG出現過敏反應。所以臨床使用含碘劑型ICG前應當皮試。ICG熒光在肝癌及癌旁組織聚集的現象是2007年Ishizawa T研究小組在肝癌手術中發現的。Yokoyama等又報道了用ICG熒光導航技術能夠偵測胰腺癌在肝臟的微小轉移灶的初期臨床結果,證實該技術在偵測肝臟內表淺微小轉移灶方面是可行的,可發現小至1.5mm直徑的轉移灶。Harad N 2010年報道,ICG肝癌手術導航,術者在術中觀察到癌組織侵犯膽管后所導致的區域膽管梗阻。肝癌手術中一些經過改進的偵測設備,可以實現同時偵測手術視野的可見光和熒光圖像,甚至實現兩類圖像的融合。肝癌開腹或腹腔鏡切除手術中用ICG經門靜脈插管,區域灌注,可以實時熒光顯示肝臟分段情況,以及各肝葉、肝段在肝臟表面的界限,進而協助術者判斷,實現精確的規則性肝葉切除。2013年的一項臨床研究報道:肝癌的肝外轉移灶也能攝取并延遲排泌ICG,使其在手術中能實時顯示熒光,并能被術者偵測到。肝癌切除術后復發的再次切除手術中,由ICG熒光技術發現了常規超聲檢查沒有發現的復發或轉移癌灶。ICG肝癌手術導航技術在腹腔鏡肝癌手術中顯示了其更大的優越性,彌補了術者無法用手捫查病變的缺陷,有利于淺表小肝癌的偵測。但在使用過程中,由于ICG不具有主動靶向功能,對于肝硬化結節、肝臟增生不良結節等,該方法下也可以顯示較強的熒光,導致假陽性的發生,據報道,該方法下假陽性率高達40-50%。Ishizawa T.等報道的準確率為65%(35/57病變),當肝硬化時,肝癌/硬化肝組織熒光對比度下降,檢測敏感性會下降。同時,ICG也應用于前哨淋巴結的清掃、血管成像,在整形外科手術中也有應用,但是不具有主動靶向功能的ICG在臨床應用方面還是受到了極大的局限性。
整合素αVβ3在正常組織器官及成熟血管內皮細胞中不表達或低表達,在多種腫瘤(包括肺癌、成膠質細胞瘤、乳腺癌、骨肉瘤、肝癌、胰腺癌等)細胞表面和新生血管內皮細胞中有高表達,在腫瘤的新生血管生成、侵襲和轉移過程中起重要作用。這種差異通過分子影像學的方法來體現。
根據世界衛生組織(WHO)發表的《全球癌癥報告2014》,研究稱2012年全球癌癥患者和死亡病例都在迅猛地增加,新增癌癥病例有近一半出現在亞洲,其中大部分在中國,中國新增癌癥病例高居第一位。WHO報告預測全球癌癥病例將呈現迅猛增長態勢,由2012年的1400萬人,逐年遞增至2025年的1900萬人,到2035年將達到2400萬人。同時,2012年全世界共新增1400萬癌癥病例并有820萬人死亡。其中,中國新增307萬癌癥患者并造成約220萬人死亡,分別占全球總量的21.9%和26.8%。在過去的50年來,雖然各個國家在腫瘤治療方面的研究資金的投入在不斷的增加,比如美國,在2009年的美國國家癌癥研究所科研預算就達到了60億美金,但是,縱觀這50年來癌癥的治療效果,并沒有顯著的改善。但是對于實體瘤,手術治療是首選的方法。如果整個實體瘤能夠被完全的通過手術切除,那么腫瘤患者是可以被治愈的。但是,目前腫瘤患者的治療效果仍然非常差,主要存在兩方面的問題:1)現有的術前常規檢查手段CT、MRI、B超等,由于自身的分辨率的限制,對于微小腫瘤未能及時發現;2)在術中,醫生綜合術前檢查結果和術中的視診、觸診等來判斷腫瘤的邊界,醫生憑主觀經驗決定如何切除腫瘤。以上的因素導致了,手術后,腫瘤患者體內微小腫瘤殘留,以及手術切緣有存留腫瘤細胞(陽性切緣),這些是造成患者術后腫瘤復發以及預后差、甚至死亡的主要原因。而且,對于術后復發的腫瘤患者,二次手術或者術后化療的效果也是非常差,如乳腺癌,肝癌,結直腸癌,頭頸部癌等腫瘤的復發患者。面對以上現實問題,臨床醫生需要一種先進的技術,這種技術可以幫助臨床醫師發現微小腫瘤灶以及在首次手術過程中就能獲得一個陰性切緣,提高腫瘤患者術后生存率,改善他們的生活質量。在臨床腫瘤治療方法研究中,自2008年日本醫生開始將熒光手術導航應用于肝臟腫瘤切除手術后,術中實時熒光導航技術就受到了臨床醫生的重視。與現有的成像儀器相比,術中熒光成像擁有低成本、簡單容易、安全(比如沒有輻射)、實時、高分辨率等優勢,對于微小腫瘤的實時檢測、高分辨率識別以及高特異性更是它的優勢。目前在臨床上研究比較成熟的是基于吲哚菁綠為熒光材料的近紅外熒光手術導航儀。這項技術已經應用于在乳腺癌前哨淋巴結檢測、胃癌轉移淋巴結檢測、原位肝癌、肝癌轉移灶、結直腸癌肝轉移等外科手術。但是,由于吲哚菁綠并沒有主動靶向性,在應用過程中的假陽性高。
已經有少量的近紅外熒光手術導航儀已經實現了商業化生產,在臨床上也已經開始使用,但是,目前仍然缺乏具有腫瘤特異性靶向的熒光分子探針。目前,能用于臨床的僅有吲哚菁綠這一種,且效果不甚理想,因此,本領域仍需要投入大量的科研力量來尋找更多的能夠用于近紅外熒光手術導航儀的熒光分子探針,從而使在近紅外熒光手術導航系統應用于臨床的過程中,具有主動靶向腫瘤的熒光分子探針真正輔助術者在術中精準的定位腫瘤和腫瘤邊界,減少術后殘癌率和復發率,提高腫瘤患者生存率和生活治療,減少社會醫療資源的負擔。
技術實現要素:
本發明的目的是提供一種靶向腫瘤的近紅外介孔二氧化硅納米探針及其制備方法,以期至少解決上述現有技術中存在的問題之一。
本發明的一個方面提供一種靶向腫瘤的近紅外介孔二氧化硅納米探針的制備方法,其包括步驟:
步驟一:配制濃度為1.5~2.5mg/mL的十六烷基三甲基溴化銨溶液作為母液,調節母液的pH值呈堿性;取正硅酸乙酯(TEOS)分散于乙醇溶液中,得到TEOS分散液;
步驟二:在60~80℃下,邊攪拌邊向母液中滴加TEOS分散液,得到澄清透明的SiO2原液;
步驟三:向SiO2原液中加入吲哚菁綠溶液后混勻,離心棄上清,收集并烘干沉淀物,得到上載了熒光劑的介孔硅球(ICG@SiO2)干粉;
步驟四:將上載了熒光劑的介孔硅球干粉分散于水中得到濃度為5~15mg/mL的ICG@SiO2溶液,然后加入APTES和Lasp,攪拌溶解后置于180~210℃灼燒100~150min,得到白色干粉;
步驟五:將白色干粉分散于水中,超聲清洗后離心棄上清,收集沉淀物,得到介孔硅球納米粒子;
步驟六:將介孔硅球納米粒子加入聚乙二醇溶液內,混勻后以PBS緩沖液稀釋,得到表面氨基功能化的上載了熒光劑的介孔硅球納米粒子,即靶向腫瘤的近紅外介孔二氧化硅納米探針。
其中,步驟一中,所述調節母液的pH值呈堿性優選調節母液的pH值至8~8.5;
所述TEOS和乙醇的體積比(V/V)優選為1:10~1:8。
步驟二中,所述攪拌優選采用恒溫水浴磁力攪拌器攪拌;
所述滴加TEOS分散液優選分次滴加,每次優選滴加200μL,每兩次滴加操作中優選間隔30分鐘,滴加完成后優選繼續攪拌20min,直到激光照射有丁達爾現象。
步驟三中,所述SiO2原液和吲哚菁綠溶液的質量比優選5:1~7:1,其中,所述吲哚菁綠溶液的濃度以10mg/mL計;
所述混勻優選震蕩混勻;
所述離心的條件優選以10000rpm轉速離心15分鐘。
步驟四中,所述APTES的加入量為50~200μL/mL,所述Lasp的加入量為200~300μg/mL;
所述灼燒優選使用馬弗爐進行。
步驟五中,所述離心的條件優選以8000rpm轉速離心15分鐘;
所述將白色干粉分散于水中和所述超聲清洗后離心棄上清的操作優選反復進行5次。
步驟六中,所述混勻優選震蕩混勻;
所述聚乙二醇溶液的用量優選為每mg介孔硅球納米粒子加入1mL聚乙二醇溶液中;
所述PBS緩沖液的使用量優選為:所述聚乙二醇溶液和所述PBS緩沖液的體積比為1:5。
本發明的另一個方面提供上述制備方法制得的靶向腫瘤的近紅外介孔二氧化硅納米探針。
在符合本領域常識的基礎上,上述各優選條件,可任意組合,即得本發明各較佳實例。
本發明所用試劑和原料均市售可得。
本發明至少具有下述有益效果之一:
1、本發明所涉及的制備方法簡便容易操作,納米粒子具有比表面積大、粒徑小,且單分散性良好等優點;
2、本發明所制備的多功能介孔納米粒子具有穩定的熒光特性、介孔性和良好的主動靶向性;
3、本發明所制備的多功能介孔納米粒子的載藥量高達49%,生物利用度高,提供了表面修飾功能基團的合成方法,同時在介孔硅層表面還可以復合多種其他種類的功能基團,為生物醫學應用多種多功能的復合納米粒子的制備提供了有益借鑒;
4、本發明所制備的多功能介孔納米粒子具有重要的應用價值,尤其在腫瘤手術治療方面,結合近紅外熒光手術導航系統,在術中可以輔助術者實時的精準定位腫瘤的位置和腫瘤邊界,切實減少患者的術后復發率,提高患者術后的生存率和生活質量,減輕社會醫療負擔,表現出良好的應用前景和經濟價值。
附圖說明
圖1為根據本發明的具體實施方式的靶向近紅外介孔硅球納米探針的制備方法流程圖;
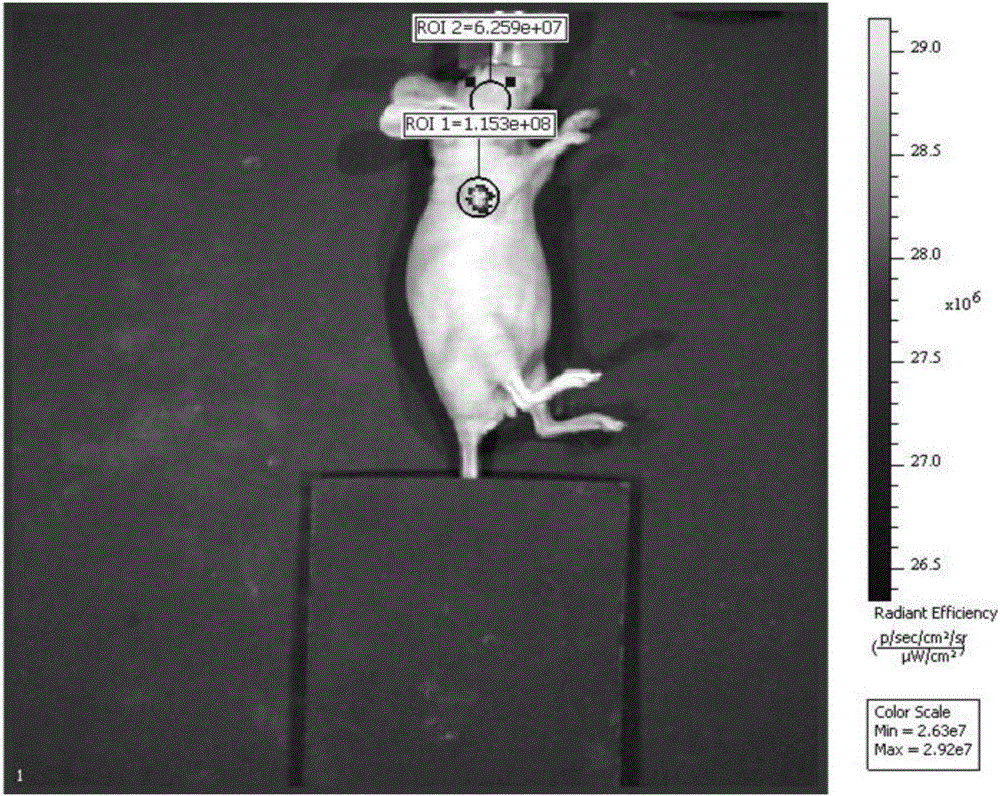
圖2為實施例2靶向腫瘤的近紅外介孔硅球納米探針(ICG/MSN-Lasp)在裸鼠體內的熒光信號檢測圖;
圖3為實施例2的無靶向功能的近紅外介孔硅球納米探針(ICG/MSN)制劑在裸鼠體內的熒光信號檢測圖;以及
圖4為實施例3的靶向腫瘤的近紅外介孔硅球納米探針結合近紅外熒光手術導航儀,術者在為皮下肝癌裸鼠完成熒光導航手術,其中,A為術前,B為術后。
具體實施方式
為使本發明的目的、技術方案和優點更加清楚明白,以下結合具體實施例,并參照附圖,對本發明作進一步的詳細說明。
本發明提供一種靶向腫瘤的近紅外介孔二氧化硅納米探針的制備方法,包括步驟:
步驟一:配制濃度為1.5~2.5mg/mL的十六烷基三甲基溴化銨溶液作為母液,調節母液的pH值呈堿性;取正硅酸乙酯(TEOS)分散于乙醇溶液中,得到TEOS分散液;
步驟二:在60~80℃下,邊攪拌邊向母液中滴加TEOS分散液,得到澄清透明的SiO2原液;
步驟三:向SiO2原液中加入吲哚菁綠溶液后混勻,離心棄上清,收集并烘干沉淀物,得到上載了熒光劑的介孔硅球(ICG@SiO2)干粉;
步驟四:將上載了熒光劑的介孔硅球干粉分散于水中得到濃度為5~15mg/mL的ICG@SiO2溶液,然后加入APTES和Lasp,攪拌溶解后置于180~210℃灼燒100~150min,得到白色干粉;
步驟五:將白色干粉分散于水中,超聲清洗后離心棄上清,收集沉淀物,得到介孔硅球納米粒子;
步驟六:將介孔硅球納米粒子加入聚乙二醇溶液內,混勻后以PBS緩沖液稀釋,得到表面氨基功能化的上載了熒光劑的介孔硅球納米粒子,即靶向腫瘤的近紅外介孔二氧化硅納米探針。
本發明還提供由該制備方法制得的靶向腫瘤的近紅外介孔二氧化硅納米探針。
實施例1
請參考圖1,其為本發明靶向腫瘤的近紅外介孔硅球納米探針的制備方法流程圖,具體地,其步驟如下:
步驟一:稱取250mg的十六烷基三甲基溴化銨溶于120mL去離子水里,得到十六烷基三甲基溴化銨溶液;將875μL的氫氧化鈉溶液(2M)滴入溶液中,置于80℃恒溫水浴磁力攪拌器上反應5分鐘,調節母液的pH呈8.5;
取100μL的正硅酸乙酯(TEOS)分散于900μL乙醇溶液中,得到TEOS分散液。
步驟二:向母液中分5次緩慢的滴入TEOS分散液,每次滴入200μL,滴入次數間隔30min,在此過程中,保持反應條件為80℃恒溫水浴磁力攪拌器攪拌。待滴加完成后,持續攪拌20分鐘,得到SiO2原液。
步驟三:向SiO2原液中加入1mL 10mg/mL的吲哚菁綠溶液,振蕩15分鐘,以10000rpm轉速進行離心15分鐘,棄上清液,收集并烘干沉淀物,得到上載了熒光劑的介孔硅球干粉;
步驟四:取5mg介孔硅球干粉,分散于500μL去離子水中,滴入100μL的3-氨丙基-三乙氧基硅烷(APTES),150μg天冬氨酸(Lasp),攪拌溶解后,置于坩堝中,在馬弗爐中180℃高溫灼燒120min,制得白色干粉。
步驟五:將白色干粉分散于5mL水中,超聲清洗后,以8000rpm轉速離心15分鐘,舍棄上清液,收集沉淀物,重復上述步驟離心、洗滌5次,得到直徑100nm的介孔硅球。
步驟六:將上述得到的上載了熒光劑的介孔硅球納米粒子加入1mL聚乙二醇溶液內,振蕩5分鐘后用PBS液稀釋為5mL,得到表面氨基功能化的上載了熒光劑的介孔硅球納米粒子,即制得了靶向腫瘤的近紅外介孔二氧化硅納米探針。
實驗測得本發明所制備的多功能介孔納米粒子的載藥量高達49%,生物利用度高,提供了表面修飾功能基團的合成方法,同時在介孔硅層表面還可以復合多種其他種類的功能基團,為生物醫學應用多種多功能的復合納米粒子的制備提供了有益借鑒。
實施例2
將實施例1制備得到的靶向性近紅外介孔硅球納米探針,用10Kd的超濾管將上述溶液進行超濾,然后用超純水洗滌3次,然后用PBS液稀釋得到濃度為2mg/mL近紅外主動靶向探針制劑。此納米制劑中的納米顆粒的平均粒徑為100納米。
將濃度為2mg/mL的上述近紅外熒光納米探針制劑注射入患有乳腺癌裸鼠體內進行熒光檢測,檢測結果如圖2所示。從圖2中可以看出,該近紅外熒光納米探針的近紅外熒光信號峰與裸鼠本身的的背景信號峰分離的很好,腫瘤區域和腫瘤周圍正常組織的對比度達到了5倍多,這樣背景干擾就小,可以給術者提供清晰的腫瘤位置和精確的腫瘤邊界,調腫瘤的檢測率、切除率。
將濃度為2mg/mL的上述近紅外熒光納米探針制劑注射入患有裸鼠體內進行熒光檢測,并將相同濃度的溶液PBS液內的未進行主動靶向修飾的熒光硅球探針(ICG/MSN)注入患有乳腺癌的裸鼠中進行熒光檢測作為對照,檢測結果如圖3所示。由圖3中可以看出,由于ICG/MSN不具有主動靶向性,在腫瘤區域熒光信號弱,腫瘤邊界不清晰,未能給術者提供清晰的腫瘤位置和精確的腫瘤邊界。
實施例3
將上述實施例2中得到的濃度為2mg/mL的近紅外熒光納米探針制劑注射入患有肝癌裸鼠體內進行熒光檢測,并在近紅外熒光手術導航儀輔助下,術者完成實時熒光導航手術切除腫瘤,手術實施過程如圖4所示(其中,A為術前,B為術后),在主動靶向近紅外熒光探針和熒光手術導航儀的輔助下,術者可以精確的定位腫瘤邊界,并參考客觀的熒光腫瘤邊界進行腫瘤的完全切除,即使是對于亞毫米的殘余病灶,術者依靠近紅外熒光信號,同樣的能夠進行精準的手術切除,減少手術殘癌率和手術切緣陽性率。
以上所述的具體實施例,對本發明的目的、技術方案和有益效果進行了進一步詳細說明,應理解的是,以上所述僅為本發明的具體實施例而已,并不用于限制本發明,凡在本發明的精神和原則之內,所做的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 介孔碳?二氧化硅復合體負載納米鈀催化劑及其合成方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 一種中空核殼式磁性介孔氮化碳及其制備方法與流程
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應用與流程
- 一種介孔二氧化硅微球的淀粉復合止血敷料的制作方法與工藝
- 介孔二氧化硅負載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復合材料及其制備方法和應用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學發光納米材料及其制備方法與流程
- 一種具有高效凝血功能的介孔二氧化硅顆粒的高效制備方法與流程
- 大孔徑介孔碳/二氧化硅負載金納米催化劑及其合成方法與流程
- 介孔碳?二氧化硅復合體負載納米鈀催化劑及其合成方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應用與流程
- 一種原位制備納米二氧化硅/端羥基聚二甲基硅氧烷雜化材料的方法與流程
- 一種介孔二氧化硅微球的淀粉復合止血敷料的制作方法與工藝
- 介孔二氧化硅負載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復合材料及其制備方法和應用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學發光納米材料及其制備方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應用與流程
- 一種介孔二氧化硅微球的淀粉復合止血敷料的制作方法與工藝
- 介孔二氧化硅負載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復合材料及其制備方法和應用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學發光納米材料及其制備方法與流程
- 一種具有高效凝血功能的介孔二氧化硅顆粒的高效制備方法與流程
- 一種毛刷狀介孔二氧化硅纖維材料及其制備方法與流程
- 一種介孔二氧化硅包覆磁性多壁碳納米管復合材料及其制備方法與流程