一種碳量子點的活化、分離及對牛血清蛋白分子進行熒光標記的方法與流程
本發明屬于生物技術領域,具體涉及一種經化學修飾的碳量子點的制備方法,可用于對牛血清蛋白的熒光標記,也可用于對于其它含伯胺基的生物分子的熒光標記。
背景技術:
熒光標記方法是指通過化學反應將具有熒光特性的基團或分子與生物分子聯接起來,使得生物分子具有熒光特性,從而便于人們跟蹤生物分子的行為。目前廣為使用的熒光基團是Cy3、Cy5等,它們都是有機熒光素,可用于標記生物分子(Hagner-McWhirter.,Laurin Y.,Larsson A.,Bjerneld E.J.,O.Cy5total protein normalization in Western blot analysis(蛋白質印跡分析中Cy5標記的總蛋白標準化).Analytical Biochemistry 2015;486:54-61.)。但是它們存在一定的缺點,例如它們的抗光漂白性能很差,不能經受較長時間的紫外照射,這對某些研究工作非常不利(Wang L.,Fan J.,Qiao X.,Peng X.,Dai B.,Wang B.et al.Novel asymmetric Cy5dyes:Synthesis,photostabilities and high sensitivity in protein fluorescence labeling(蛋白熒光標記中新穎的反對稱Cy5染料的合成、光穩定性和高靈敏性).Journal Of Photochemistry And Photobiology A-Chemistry2010;210:168-172.),該文中使用的有機熒光素1h內光降解在10%左右。而近年來發展起來的重金屬量子點(CdS、CdSe等)技術,也使得熒光標記領域又增加一名新成員(蔣茶,徐淑坤,楊冬芝,等,CdS量子點的制備及細胞膜初步熒光標記.2007.26(5):1-4.),但是它的最大缺點是毒性較高,對生物組織的破壞性較大。
碳量子點作為一種新型的碳納米材料,具有顯著的表面效應、量子尺寸效應,呈現出很多新奇的理化性質,例如在紫外燈的照射下能夠發出一定波長的熒光。同時由于這種量子點無毒、廉價、制備簡單、環境友好,成為近年來研究的熱點。目前對碳量子點的研究中多數限于其制備方法(Bhunia S.K.,Saha A.,Maity A.R.,Ray S.C.,Jana N.R.Carbon Nanoparticle-based Fluorescent Bioimaging Probes(以碳納米點為基礎的熒光生物成像探針).Scientific Reports2013;3:1473;Dong Y.,Shao J.,Chen C.,Li H.,Wang R.,Chi Y.et al.Blue luminescent graphene quantum dots and graphene oxide prepared by tuning the carbonization degree of citric acid(通過調節檸檬酸的碳化程度制備藍色熒光石墨烯量子點和氧化石墨烯).Carbon 2012;50:4738-4743.),而對于其實際應用的報道很少,特別是將其應用于對生物分子的熒光標記的報道更少。
技術實現要素:
為克服克服現有技術中含有活性基團的有機熒光素價格非常昂貴、且抗光漂白性能較差,不能經受紫外線長時間的照射,紫外線長時間的照射會使得有機熒光素發生光解,技術人員在進行長時間熒光成像觀察的時候,熒光圖像的穩定性得不到保證等問題,本發明提供了一種碳量子點的活化、分離及對牛血清蛋白分子的熒光標記方法,該方法以廉價的檸檬酸為原料,首先制備具有熒光特性的碳量子點,再進行化學活化、分離,并最終應用于對牛血清蛋白的熒光標記。
本發明涉及一種碳量子點的活化、分離及對牛血清蛋白分子的熒光標記方法,具體步驟如下:
(1)稱取1.0~3.0g的檸檬酸,在烘箱中180℃下進行熱解反應,獲得碳量子點,產物用四氫呋喃溶解;往碳量子點的四氫呋喃溶液中加入0.8~1.6g N-羥基丁二酰亞胺、1.2~2.0g二環己基碳二亞胺和8~25mL四氫呋喃溶劑,控制溫度為55~65℃,磁力攪拌下反應3~6h,生成N-羥基丁二酰亞胺活化的碳量子點;
(2)將步驟(1)的反應產物放入冰箱的冷凍室持續1h以上,再過濾除去固體,取出上清液;將上清液再放入冰箱冷凍室,重復上次的操作,直至溶液中無固體析出;
(3)取出步驟(2)獲得的上清液,蒸餾除去溶液中的四氫呋喃,加入冷水,充分振蕩,立即加入乙酸乙酯,繼續充分振蕩,分出酯層;
(4)取2~5mL步驟(3)獲得的酯層,蒸除其中的乙酸乙酯溶劑,加入12mL磷酸鹽緩沖溶液溶解;取4mL該溶液,加入6mL牛血清蛋白的磷酸鹽緩沖溶液,25℃下反應8h,獲得碳量子點標記的牛血清蛋白溶液,實現牛血清蛋白分子的熒光標記。
進一步的,本發明可以應用到其它含伯胺基生物分子的熒光標記中。
與現有技術相比,本發明具有以下技術效果:
1、本發明經NHS活化的碳量子點的價格比現有的含活性基團的有機熒光素要廉價得多。
2、本發明經NHS活化的碳量子點抗光漂白性要優于有機熒光素。
3、本發明提供了一種對碳量子點的活化、分離方法,并由此實現對牛血清蛋白分子的熒光標記。這種方法可以推廣至對所有含伯胺基的生物分子的熒光標記,因而具有廣泛的應用前景。
附圖說明
圖1是本發明中的碳量子點透射電鏡圖;由圖可知,碳量子點的尺寸為3nm左右。
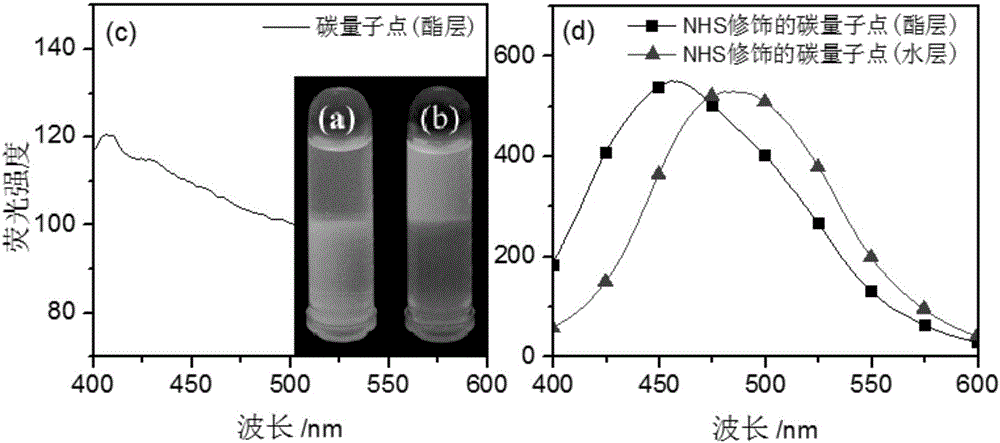
圖2是碳量子點和NHS修飾的碳量子點在乙酸乙酯中溶解度比較的照片及酯層和水層的熒光光譜;其中:(a)為碳量子點的照片;(b)為NHS修飾碳量子點的照片,顯然本發明中的碳量子點不溶于乙酸乙酯(上層為酯層),酯層清晰透明;(c)為酯層的熒光光譜,顯然酯層的熒光很弱,說明本發明所制備的碳量子點難溶于乙酸乙酯;而經NHS修飾的碳量子點在乙酸乙酯中具有良好的溶解度(上層為酯層),酯層中含有大量碳量子點;(d)為酯層和水層的熒光光譜,顯然NHS修飾的碳量子點在乙酸乙酯中溶解度良好。
圖3是本發明中碳量子點及NHS修飾的碳量子點的紅外光譜圖。
圖4是本發明中NHS修飾的碳量子點水溶液在比色皿中經手提式紫外燈(8W)照射一定的時間以后的熒光光譜圖;其中:右上角的插圖顯示峰值熒光強度與照射時間的關系;由圖可知,在紫外燈連續照射60min以后,本發明中的NHS修飾碳量子點的熒光強度下降僅為5%左右。
圖5為實施例1中碳量子點標記的牛血清蛋白溶液凝膠電泳照片(上)和相應的熒光照片(下);其中:(a)為Marker的條帶,說明所使用的蛋白分子量在66kD左右;(b1~b3)為未標記的牛血清蛋白條帶,熒光照片顯示其沒有熒光;(c1~c3)分別為加入20,5和10μL碳量子點標記的牛血清蛋白溶液的條帶;熒光照片顯示它們都具有熒光,且熒光基團與蛋白結合良好,并未發生分離現象,說明它們是共價鍵聯接。
具體實施方式
以下結合附圖和科學原理對本發明作進一步的解釋。
以單一的檸檬酸為原料,180℃下,經熔融、熱解、反應,最終生成碳量子點。熱解、反應過程中,檸檬酸分子之間發生脫水反應,過程如下圖所示:
可能的脫水方式有:羧基之間的脫水、羥基與亞甲基氫之間的脫水、羥基之間的脫水等,分子間脫水是一個完全隨機的過程,分子之間脫水以后,可能形成環烴結構,其表面含有羥基、羧基等基團,水溶液呈現酸性,利用這些表面羧基的化學活性,可以實現對碳量子點的化學修飾。所生成的碳量子點的形貌像如附圖1所示,透射電子顯微鏡圖像其大小在3nm左右,晶面間距為0.22nm。
由于碳量子點表面含有大量極性基團,因此碳量子點具有較強的極性,能與水完全互溶,在四氫呋喃中也具有較好的溶解度,但是在乙酸乙酯中溶解度很差,如附圖2(a)所示。其表面的羧基可以與N-羥基丁二酰亞胺(NHS)和二環己基碳二亞胺(DCC)反應:
生成活潑的NHS酯。由于碳量子點表面生成酯的結構,于是其在乙酸乙酯中的溶解度增大,如附圖2(b)所示。附圖2(a)為碳量子點在乙酸乙酯中的溶解情況,附圖2(b)為NHS酯修飾的碳量子點在乙酸乙酯中的溶解情況。可以看出:修飾反應之前,碳量子點幾乎不溶于乙酸乙酯,而經NHS修飾以后,其在乙酸乙酯中的溶解度明顯增大,附圖2(c)和(d)證明了這一事實。附圖2(c)顯示:乙酸乙酯層的熒光非常弱,在450~500nm附近幾乎沒有熒光發射;而附圖2(d)顯示:經NHS修飾的碳量子點在酯層中的含量明顯增加,酯層顯示出較強的熒光發射,在450nm附近有較強的熒光發射,不過水層仍然具有一定的熒光,這說明并不是所有的碳量子點都與NHS發生了反應。根據這種性質,利用萃取的方法可以將修飾產物從反應體系中分離出來,實現NHS酯修飾的碳量子點的分離和純化。其酯化反應可由紅外光譜證明,如附圖3所示。附圖3(a)為碳量子點的紅外光譜圖,碳量子點在3449cm-1處有一強寬峰,為羧基中的羥基和醇羥基的伸縮振動峰;碳量子點的羰基(羧基羰基,酮羰基)和C=C吸收的疊加產生一個寬吸收峰。附圖3(b)為NHS修飾的碳量子點的紅外光譜圖,顯然,在1700cm-1附近兩者有很大的區別,1863和1732cm-1處為NHS的特征峰。
本發明所獲得NHS修飾的碳量子點,具有很好的抗光漂白性能,如附圖4所示。在紫外燈的持續照射下,1h內其熒光強度下降為5%左右。
由于碳量子點表面的NHS酯較為活潑,能在極溫和的條件下與含伯胺基的分子反應。例如:NHS修飾的碳量子點可與牛血清蛋白反應:
牛血清蛋白多肽鏈中的伯胺基與碳量子點表面的NHS酯反應,最終獲得具有熒光性質的碳量子點標記的牛血清蛋白分子。附圖5的凝膠電泳圖像證明了其與牛血清蛋白的反應,凝膠電泳實驗證明:碳量子點與牛血清蛋白分子通過化學鍵聯接,說明它們之間確實發生了化學反應。從附圖5還可以看出,牛血清蛋白與碳量子點反應之后,其分子量略有增大(牛血清蛋白的分子量為66kD);另外,由于牛血清蛋白與蛋白分子的化學鍵聯接,使得牛血清蛋白分子具有熒光特性。這種方法可以推廣至與更多的含伯胺基生物分子反應,用于對生物分子的熒光標記。由于碳量子點具有無毒性和抗光漂白性,使得NHS酯活化的碳量子點在生物熒光標記領域具有非常良好的應用前景。
以下通過具體實施例對本發明作進一步的描述。但本發明不局限于下述實施例。
實施例1
(1)將1.0g檸檬酸加入到不銹鋼制的容器中,并攤平,放入烘箱中加熱至180℃,持續反應60min后,室溫下冷卻。加入10mL四氫呋喃,充分溶解5h以上,獲得碳量子點的四氫呋喃溶液。
(2)將步驟(1)產物中加入0.8g N-羥基丁二酰亞胺、1.2g二環己基碳二亞胺和8mL四氫呋喃溶劑,控制溫度為65℃,磁力攪拌下反應3h。產物放入冰箱的冷凍室,讓未反應的N-羥基丁二酰亞胺及二環己基碳二亞胺析出,取出上清液。將上清液再放入冰箱冷凍室,重復上次的操作,直至溶液中無固體析出。
(3)蒸餾除去溶液中的四氫呋喃,再加入15mL冷水,充分振蕩;立即加入乙酸乙酯15mL,以萃取生成的產物,同時除去未反應的碳量子點。于是獲得N-羥基丁二酰亞胺修飾碳量子點的乙酸乙酯溶液。
(4)取5mL步驟(3)的產物,蒸除其中的乙酸乙酯溶劑,加入12mL PBS(pH=7.4)溶解。取4mL該溶液,加入6mL牛血清蛋白的PBS溶液(4mg mL-1),25℃下反應8h,獲得碳量子點標記的牛血清蛋白溶液。
實施例2
(1)將2.0g檸檬酸加入到不銹鋼制的容器中,并攤平,放入烘箱中加熱至180℃,持續反應60min后,室溫下冷卻。加入15mL四氫呋喃,充分溶解5h以上,獲得碳量子點的四氫呋喃溶液。
(2)將步驟(1)產物中加入1.2g N-羥基丁二酰亞胺、1.8g二環己基碳二亞胺和15mL四氫呋喃溶劑,控制溫度為60℃,磁力攪拌下反應4h。產物放入冰箱的冷凍室,讓未反應的N-羥基丁二酰亞胺及二環己基碳二亞胺析出,取出上清液。將上清液再放入冰箱冷凍室,重復上次的操作,直至溶液中無固體析出。
(3)蒸餾除去溶液中的四氫呋喃,再加入15mL冷水,充分振蕩;立即加入乙酸乙酯15mL,以萃取生成的產物,同時除去未反應的碳量子點。于是獲得N-羥基丁二酰亞胺修飾碳量子點的乙酸乙酯溶液。
(4)取3mL步驟(3)的產物,蒸除其中的乙酸乙酯溶劑,加入12mL PBS(pH=7.4)溶解。取4mL該溶液,加入6mL牛血清蛋白的PBS溶液(4mg mL-1),25℃下反應8h,獲得碳量子點標記的牛血清蛋白溶液。
實施例3
(1)將3.0g檸檬酸加入到不銹鋼制的容器中,并攤平,放入烘箱中加熱至180℃,持續反應60min后,室溫下冷卻。加入20mL四氫呋喃,充分溶解5h以上,獲得碳量子點的四氫呋喃溶液。
(2)將步驟(1)產物中加入1.6g N-羥基丁二酰亞胺、2.0g二環己基碳二亞胺和25mL四氫呋喃溶劑,控制溫度為55℃,磁力攪拌下反應6h。產物放入冰箱的冷凍室,讓未反應的N-羥基丁二酰亞胺及二環己基碳二亞胺析出,取出上清液。將上清液再放入冰箱冷凍室,重復上次的操作,直至溶液中無固體析出。
(3)蒸餾除去溶液中的四氫呋喃,再加入15mL冷水,充分振蕩;立即加入乙酸乙酯15mL,以萃取生成的產物,同時除去未反應的碳量子點。于是獲得N-羥基丁二酰亞胺修飾碳量子點的乙酸乙酯溶液。
(4)取2mL步驟(3)的產物,蒸除其中的乙酸乙酯溶劑,加入12mL PBS(pH=7.4)溶解。取4mL該溶液,加入6mL牛血清蛋白的PBS溶液(4mg mL-1),25℃下反應8h,獲得碳量子點標記的牛血清蛋白溶液。
- 還沒有人留言評論。精彩留言會獲得點贊!