一種用于超級電容器的MnTe2/Ni電極材料及其制備方法與流程
本發明涉及電池領域,尤其涉及超級電容器的電極材料領域及其制備方法。
背景技術:
超級電容器是一種新型儲能器件,它采用具有高比表面積的多孔碳材料作為電極或利用電極活性物質進行欠電位沉積,使其發生快速、可逆的化學吸附/脫附或氧化/還原反應來獲得法拉第數量級的電容量,因此它既具有電池的能量貯存特性,又具有電容器的功率特性,它比傳統電解電容器的比能量高上千倍,而漏電電流小數千倍,可充放電10 萬次以上而不需要維護和保養,可用于極大電流瞬間放電的工作狀態、而不易產生發熱著火等現象。鑒于超級電容器具有高比功率、循環壽命長、使用溫度范圍寬、充電時間短、綠色環保等優異特性,目前在很多領域都受到廣泛關注,它既可以應用于消費類電子產品領域,又可以應用于太陽能能源發電系統、智能電網系統、新能源汽車、工業節能系統、脈沖電源系統等眾多領域。
而電極材料是決定超級電容器性能的最重要因素之一,從國、內外的超級電容器產品來看,其電極材料主要采用傳統碳系材料,產品的能量密度低。自從加拿大Conway 為首的課題組進行以氧化釕等過渡金屬氧化物電極材料的研究,發現有著多種價態的過渡金屬氧化物、由于具備贗電容性質、能同時提供較高的能量密度、其電容量是傳統碳系材料的雙電層電容的10~100 倍、且此類電極材料具有高度的充放電可逆性,是前景非常光明的超級電容器電極材料。在過渡金屬氧化物中,RuO2有著很高的比電容,但是它很高的成本、很低的儲量及會帶來嚴重的環境污染限制了它的實際應用。其他過渡金屬氧化物比如MnO2,NiO和Co3O4,也被廣泛研究,這些電極材料比起RnO2來說,在能量密度相對低,其中MnO2有豐富的儲量、較低的成本、環境友好、具有高理論比電容值,可由于其導電性很差導致其實際比電容較低。
基于以上,為了得到各方面具有更好特性的超級電容器電極材料,開發新的電極材料可以考慮兩種途徑,一是尋找新材料;二是對已有材料進行復合,通過材料間的協同作用克服單組分的缺點,以期得到理想的電極材料。其中新材料除了本身可以作為超級電容器電極材料,其和傳統材料的復合可以帶來更多可能的選擇。不斷開發新而有用的材料是解決能源問題的重大突破口。
另一方面,超級電容器的儲能主要基于電解質在活性電極材料表面進行法拉第反應而獲得,因而活性電極材料的比表面積直接影響儲能的容量大小,納米材料由于豐富的納米形態而形成的豐富的表面納米結構,往往能夠產生非常大的比表面。且納米材料一方面具有高的比表面積,另一方面還可以改善電子、離子傳輸擴散路徑,從而提高電極性能。因此,近年來,納米級復合金屬氧化物材料在超級電容器電極中的研究成為熱點。
由于過渡金屬氧化物電極材料在能量密度上占有一定的優勢,科研工作者們總是嘗試著研究各種過渡金屬氧化物,而碲化物、硒化物等傳統過渡金屬氧化物具有更好的導電率,可能具有更高的電化學效率,對它的研究可以極大拓展超級電容器電極材料的選擇。
技術實現要素:
本發明旨在目前超級電容器電極材料的基礎上,研究開發出一種可應用于超級電容器電極的新材料。在我們的研究中知道,碲化錳被發現有不少價態,諸如MnTe、MnTe2,價態變化的可能性會使氧化還原反應帶來高比容量成為可能;而且碲化錳作為半導體,擁有比較好的導電性。另一方面,在我們的研究中發現,碲化錳在不同的條件下可制備出了不同微觀形態,可以通過制備方法、原材料選擇和工藝參數的控制,獲得不同的微觀形貌;而超級電容器的電極材料的形貌對超級電容器有著很重要的影響,其形貌的可變化,為我們研究中,通過制備方法設計和工藝參數控制,找到其適合超級電容器的電極材料的微觀形貌提供了可能。
因此,本發明旨在提供一種應用于超級電容器的碲化錳/Ni電極材料及其制備方法,通過制備方法設計和工藝參數控制,達到具有預期微觀形貌和電學性能,以使其應用于超級電容器電極材料并具有超級電容器要求的優良特性。
本發明提供了一種用于超級電容器的MnTe2/Ni電極材料,其中MnTe2作為電極活性物質覆蓋于Ni襯底上,MnTe2成半球形的蜂窩結構,半球形的蜂窩結構的直徑大小為5μm左右,其中MnTe2半球形蜂窩結構由片厚小于1μm的片狀MnTe2合圍而形成大量的蜂窩孔隙。
本發明還提供了上述用于超級電容器的MnTe2/Ni電極材料的制備方法,包括如下步驟:
1)稱量碲源和錳源以及還原劑;將稱量好的各物質放入反應釜中,加入溶劑;充分攪拌至沒有顆粒狀固體,放入泡沫鎳片;其中碲源為Te粉末,錳源為MnCl2·4H2O ,還原劑為NaBH4,溶劑為乙醇胺;
2)將反應釜放入加熱爐,在一定反應溫度下保溫一段時間;之后讓反應釜隨爐冷卻; 其中反應溫度為200~220℃,保溫時間為12~14小時;
3)取出反應好的泡沫鎳片,用無水乙醇和去離子水反復清洗,之后放入60℃的干燥箱中干燥,制得MnTe2/Ni電極材料。
進一步地,步驟1)所用反應物Te、 MnCl2·4H2O與 NaBH4的摩爾比為1:0.5~1:3,每毫摩Te粉添加12ml的溶劑乙醇胺。
進一步地,步驟1)所用反應物Te、 MnCl2·4H2O與 NaBH4的摩爾比為1:1:3。
進一步地,步驟2)中反應溫度為200℃,反應時間12h。
本發明的有益成果在于:
1)本發明制備工藝非常簡單、制備方法的反應條件易于控制、耗時短,生產成本低、設備資金投入少,適合大規模工業化生產。
2)本發明制備的MnTe2/Ni材料呈膜狀結構完整附著于泡沫鎳網上,利用泡沫鎳網多孔的結構獲得較大的電極比表面積,最大化利用活性物質的電化學性能。
3)本發明制備的電極襯底鎳網具有較好的導電性,直接在鎳網上生長可以最小化電極的電阻,減少不必要的阻抗。相比粉末涂覆的電極,具有更好的比電容、穩定性、小阻抗。
附圖說明
圖1為實施例1測得的XRD相圖。
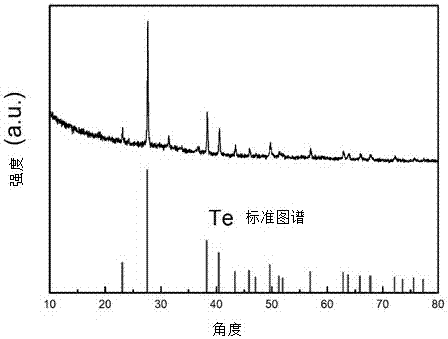
圖2為對比例2測得的XRD相圖。
圖3為實施例1制得的MnTe2/Ni材料的SEM圖。
圖4為實施例1制得的MnTe2/Ni材料的進一步放大的SEM圖。
圖5為實施例1制得的MnTe2/Ni為電極材料的超級電容器測試的10、20、50mV/s掃描速度下的循環伏安曲線。
圖6為實施例1制得的MnTe2/Ni為電極材料的超級電容器測試的恒電流充放電測試曲線。
圖7為實施例1制得的MnTe2/Ni為電極材料的超級電容器測試的EIS能譜圖。
具體實施方式
下面以具體的實施例對本發明做進一步的說明。
實施例1~4及對比例1及2的實驗步驟如下:
1、按照下面表1中摩爾數稱量碲源和錳源以及還原劑NaBH4;將稱量好的各物質放入聚四氟乙烯反應釜中,加入24ml的溶劑乙醇胺;充分攪拌至沒有顆粒狀固體,放入泡沫鎳片;
2、將反應釜放入加熱爐,以特定的反應溫度保溫一段時間;之后讓反應釜隨爐冷卻;保溫時間和反應溫度如下面表1;
3、取出反應好的泡沫鎳片,用無水乙醇和去離子水反復清洗,之后放入60℃的干燥箱中干燥,制得最終的材料。
對比例3的實驗步驟如下:
1、按照下面表1摩爾數稱量碲源和錳源;將稱量好的物質放入聚四氟乙烯反應釜中,加入20ml還原劑水合肼,加入10ml的溶劑去離子水;充分攪拌至沒有顆粒狀固體,放入泡沫鎳片;
2、將反應釜放入加熱爐,以特定的反應溫度保溫一段時間;之后讓反應釜隨爐冷卻;保溫時間和反應溫度如下面表1;
3、取出反應好的泡沫鎳片,用無水乙醇和去離子水反復清洗,之后放入60℃的干燥箱中干燥,制得最終的材料。
表1:各實施例和對比例的原材料和工藝參數表
性能測試:
1)XRD測試:將各實施例及對比例制得的最終產物進行XRD測試,從泡沫鎳獲取表面的涂層物質進行測試,如圖1,2的分別為實施例1和對比例2測得的XRD相圖,圖1顯示的測試峰與MnTe2標準圖像峰在28.68°,31.52°,36.556°,38.8°,28.68°,70.357°,77.622°的峰吻合,實施例1最終獲得產物為MnTe2/Ni材料;圖2顯示的測試峰與Te的標準圖像相符合,對比例2沒有形成MnTe2或者MnTe等碲化錳材料。進一步通過EDS能譜測試顯示實施例1中Mn與Te元素的比例為1:2,與XRD測試結果吻合;而電子衍射斑顯示實施例1中MnTe2結晶性很好。其它各實施例和對比例XRD測試結果如表2所示,從整個反應合適的反應溫度和時間才能形成MnTe2,在本發明的原材料及其比例下,200~220℃且反應時間12~14小時能形成結晶性能較好的MnTe2;而置換還原劑和溶劑為水合肼和去離子水后,不能形成MnTe2或者MnTe等碲化錳材料。
2)SEM測試:將各實施例及對比例制得的最終材料進行電子顯微鏡SEM觀察其微觀形貌,如附圖3,4為實施例1制得的MnTe2/Ni材料的SEM圖,可以看到電極活性物質MnTe2覆蓋于Ni襯底上,MnTe2成半球形的蜂窩結構,半球形的蜂窩結構的直徑大小為5μm左右,其中MnTe2半球形蜂窩結構由片厚小于1μm的片狀MnTe2合圍而形成大量的蜂窩孔隙。實施例2~4形成的MnTe2/Ni材料的微觀形貌與實施例1相同。
3)電化學性能測試:將各實施例及對比例制得的最終材料分別制成電極片裝配成三電極體系進行恒流充放電測試、循環伏安測試,循環充放電測試和交流阻抗測試。
圖5為實施例1測得的10、20、50mV/s的掃描速度下的循環伏安曲線,電壓范圍為0-0.6V,可以看到,循環伏安曲線上有一個明顯的氧化峰和一個明顯還原峰,說明電極活性物質MnTe2可以被發生氧化還原反應,具有贗電容性質;在氧化峰時,二價Mn被氧化成高價錳,在還原峰時高價錳被還原成二價錳。實施例2~4具有同樣的氧化峰還原峰。對比例1雖然XRD顯示沒有形成MnTe2,但是在循環伏安測試時,顯示有氧化峰還原峰,說明也具一定的贗電容性質,進一步確定是在該反應溫度等工藝條件下,襯底泡沫鎳片上的鎳與表面的碲發生反應,生成一部分碲化鎳,導致產生贗電容性能。但在對比例2中反應溫度相對低,測試結果顯示沒有相應的電化學性能。對比例3中,置換還原劑和溶劑為水合肼和去離子水后,所制的最終材料也在測試中未呈現超級電容器的電化學性能。而且在發明人進一步的研究中,以水合肼為還原劑,置換Mn源為MnCl2·4H2O以外的無機Mn鹽或置換碲源為TeO2或同時置換Mn源和碲源,最終的產物均不能形成MnTe2或者MnTe等碲化錳材料,電化學測試中也均未呈現超級電容器的電化學性能。
如圖6為實施例1測得的恒電流充放電測試曲線。曲線顯示電壓隨時間變化非線性關系,說明電極表面上主要發生的是準法拉第反應,即有贗電容產生,與循環伏安曲線測試結果吻合;計算其比電容,在10mA放電電流下,實施例1的質量比電容為116.9F·g-1,其它各實施例和對比例的測試數據如表2,從比電容數據,最優的參數選擇為實施例1。
對各實施例進行了交流阻抗測試測試(EIS能譜圖)其電荷轉移阻抗,如圖7為實施例1制得的MnTe2/Ni為電極材料的超級電容器測試的EIS能譜圖,從中可以計算出,其電荷轉移電阻為0.017 ohm,具有很小的電荷轉移電阻,使其應用于超級電容器電化學性能更優異。根據各實施例測得的EIS能譜圖計算的電荷轉移阻抗值如下表所示。
超級電容器要求高循環壽命使其區別于一般儲能器件,對各實施例制得MnTe2/Ni為電極材料的超級電容器進行多次恒流充放電測試,獲得5000次循環后電容器的比容量、充放電效率的變化情況。實施例1的結果顯示5000次循環后電容保持100%,充放電效率95%以上,具有非常優異循環穩定性能。
表2 各實施例和對比例性能測試結果表
以上所述,僅是本發明的較佳實施例而已,并非對本發明作任何形式上的限制。任何熟悉本領域的技術人員,在不脫離本發明技術方案范圍情況下,都可利用上述揭示的方法和技術內容對本發明技術方案作出許多可能的變動和修飾,或修改為等同變化的等效實施例。因此,凡是未脫離本發明的技術方案的內容,依據本發明的技術實質對以上實施例所做的任何簡單修改、等同變化及修飾,均仍屬于本發明技術方案保護的范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!