一種高效能的鋰離子電池正極材料及其制備方法和應用與流程
本發明涉及電化學領域,具體地涉及一種高效能的鋰離子電池正極材料及其制備方法和應用。
背景技術:
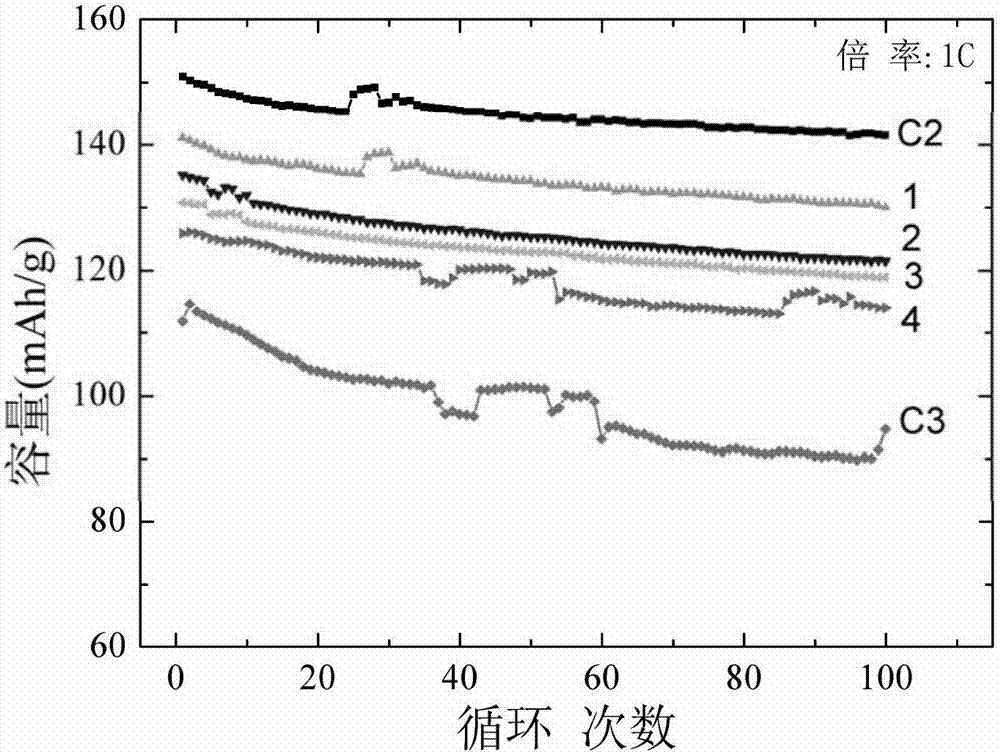
:鋰離子電池廣泛應用于信息、能源、交通、軍事等領域,被稱為是有可能改變世界(能源)格局的突破性技術,其在電動汽車、智能電網中的廣泛應用備受矚目。鋰離子電池除具有高能量密度外,還具備無記憶效應、自放電小等優點,成為電動自行車、電動汽車用動力電池以及移動基站儲能電源的首選。但是,目前的鋰離子電池倍率性能一般較差,使得電池充放電時間過長,大功率負載應用時其放電容量較低,這直接導致電動汽車難以獲得加速、爬坡等優良驅動動力,且加劇了大電流放電時的熱失控風險,進而導致電池實際壽命和電池續航能力的銳減。正極材料是制約鋰離子電池應用性能和性價比的關鍵材料之一。提高正極材料的比容量,特別是高倍率放電容量,是提升鋰離子電池動力性能和使用壽命的關鍵。然而現有的高比容量的正極材料通常會有安全性問題,或會增加材料成本等不足。混合材料的設計出發點是讓電池獲得價格更加低廉、性能更加全面且效能更加平衡的實際應用。現有的混合材料技術普遍采用層狀材料、尖晶石材料以及橄欖石型材料混合,以充分利用兩種或兩種以上組分材料各自的優勢。但是,現有的混合材料技術中均沒有展示出混合材料相對于各組分材料在電化學性能上尤其是高倍率性能上的協同效應,沒有任何案例表明組分材料在混合后在高倍率充放電時能夠獲得電化學性能的加成效果,即在一定電化學條件下,混合材料放電比容量可超過組分材料在相同電化學條件下的放電比容量的簡單加和。因此,本領域急需開發一種成本低、安全性能較好且倍率性能可得到較大改善的新型的正極材料。技術實現要素:本發明的目的在于提供一種成本低、安全性能較好且倍率性能可得到較大改善的新型的正極材料。本發明的第一方面,提供了一種鋰離子電池正極材料,所述正極材料具有下組特征:i)所述正極材料為高電導材料a和低電導材料b的混合物;ii)所述高電導材料a的阻抗為ra,所述低電導材料b的阻抗為rb,rb/ra≥2;iii)所述高電導材料a和所述低電導材料b至少有一種為非球形顆粒,且按所述正極材料的總重量計,其中球形顆粒的含量≤50wt%;和iv)所述高電導材料a的中位徑為da50,所述低電導材料b的中位徑為db50,|da50-db50|/min(da50,db50)≥10%。在另一優選例中,所述高電導材料a選自下組:鈷酸鋰(licoo2)、鎳酸鋰(linio2)、錳酸鋰(limn2o4)、鎳錳酸鋰(linixmnyo4,x+y=2,)、鎳鈷錳酸鋰(linixcoymnzo2,x+y+z=1)、鎳鈷鋁酸鋰(linixcoyalzo2,x+y+z=1)、富鋰材料(li(li1/3-(2x+y)/3mn2/3-(x+2y)/3nixcoyo2,x<1,y<1,x+y<1)、磷酸亞鐵鋰(lifepo4)、磷酸錳鋰(limnpo4)、磷酸釩鋰(li3v2(po4)3)、高錳材料(li2mno3和/或li4mn2o5)、硅酸鹽材料(li2msio4,m選自下組:ti、v、ni、mn、fe、co、或其組合)、高鋰材料(lixmo4,x≥5,m選自下組:ti、v、ni、mn、fe、co、或其組合)。在另一優選例中,所述低電導材料b選自下組:鈷酸鋰(licoo2)、鎳酸鋰(linio2)、錳酸鋰(limn2o4)、鎳錳酸鋰(linixmnyo4,x+y=2,)、鎳鈷錳酸鋰(linixcoymnzo2,x+y+z=1)、鎳鈷鋁酸鋰(linixcoyalzo2,x+y+z=1)、富鋰材料(li(li1/3-(2x+y)/3mn2/3-(x+2y)/3nixcoyo2,x<1,y<1,x+y<1)、磷酸亞鐵鋰(lifepo4)、磷酸錳鋰(limnpo4)、磷酸釩鋰(li3v2(po4)3)、高錳材料(li2mno3和/或li4mn2o5)、硅酸鹽材料(li2msio4,m選自下組:ti、v、ni、mn、fe、co、或其組合)、高鋰材料(lixmo4,x≥5,m選自下組:ti、v、ni、mn、fe、co、或其組合)。在另一優選例中,所述高電導材料a為鎳鈷錳酸鋰;和/或所述低電導材料b為錳酸鋰。在另一優選例中,所述鎳鈷錳酸鋰為linixcoymnzo2,其中x+y+z=1,0.15≤x≤0.5,0.15≤y≤0.5,0.15≤z≤0.5。在另一優選例中,所述鎳鈷錳酸鋰為linixcoymnzo2,其中x+y+z=1,0.2≤x ≤0.4,0.2≤y≤0.4,0.2≤z≤0.45。在另一優選例中,所述鎳鈷錳酸鋰為lini1/3co1/3mn1/3o2。在另一優選例中,rb/ra>2。在另一優選例中,rb/ra>2.2,較佳地rb/ra>2.3。在另一優選例中,所述正極材料中,所述高電導材料a的質量為wa,所述低電導材料b的質量為wb,wa/(wa+wb)=10-90%。在另一優選例中,所述正極材料中,所述高電導材料a的質量為wa,所述低電導材料b的質量為wb,wa/(wa+wb)=20-80%,較佳地30-75%,更佳地35-75%。在另一優選例中,所述正極材料中球形顆粒的含量≤40wt%,較佳地≤30wt%,更佳地≤20wt%,最佳地≤10wt%,最佳地≤1wt%。在本發明中,min(da50,db50)表示da50和db50中的最小值。在另一優選例中,|da50-db50|/min(da50,db50)≥13%,較佳地≥16%。在另一優選例中,(db50-da50)/da50≥10%,較佳地13%,更佳地≥16%。在另一優選例中,所述正極材料是采用本發明第二方面所述的方法制備的。在另一優選例中,在放電倍率≥5c且在相同放電倍率下,所述正極材料的放電容量為q,所述高電導材料a的放電容量為qa,所述低電導材料b的放電容量的qb,q≥(wa/(wa+wb))*qa+(wb/(wa+wb))*qb。本發明的第二方面,提供了一種本發明第一方面所述的正極材料的制備方法,包括如下步驟:1)提供高電導材料a和低電導材料b;和2)混合所述高電導材料a和所述低電導材料b,得到本發明第一方面所述的正極材料。在另一優選例中,所述高電導材料a和所述低電導材料b如本發明第一方面所述。在另一優選例中,步驟2)中,所述“混合”通過研磨機的研磨進行混合。在另一優選例中,所述“混合”的混合時間為0.1-24小時,較佳地0.3-12小時,更佳地0.5-5小時。本發明的第三方面,提供了一種鋰離子電池,所述鋰離子電池直接以本發明第一方面所述的正極材料作為正極活性材料。本發明的第四方面,提供了一種本發明第一方面所述的正極材料的用途,用于制備鋰離子電池。本發明的第五方面,提供了一種改善鋰離子電池倍率性能的方法,使用本發明第一方面所述的正極材料作為正極活性材料。應理解,在本發明范圍內中,本發明的上述各技術特征和在下文(如實施例)中具體描述的各技術特征之間都可以互相組合,從而構成新的或優選的技術方案。限于篇幅,在此不再一一累述。附圖說明圖1是電池1-5和c1在不同的放電倍率下的放電容量的加成效果圖,其中縱坐標為負值表示沒有協同加成效果,縱坐標為正值表示存在協同加成效果。圖2為電池c2、c3和1-4在放電倍率為1c下的循環性能測試結果。圖3為本發明正極混合材料中鋰離子擴散路徑的協同效應圖解。具體實施方式本發明人經過長期而深入的研究,意外地制備了一種在高放電倍率下倍率性能具有協同效應的正極混合材料,以所述正極材料制備的鋰離子電池特別適合應用于電動汽車等需要快速充放電的設備。具體地,本發明人通過將具有特定阻抗比關系、特定形貌特征和特定粒徑關系的高電導材料a和低電導材料b按照特定的質量比通過特定的研磨混合方式混合,制備得到一種在高放電倍率下倍率性能具有協同效應的正極材料。使用所述正極材料作為鋰離子電池的正極活性材料可有效提高鋰離子電池的性價比,使得可以較低的成本獲得更優的倍率性能和更高的放電電壓平臺。在此基礎上,發明人完成了本發明。術語如本文所用,術語“鋰離子電池正極材料”、“正極材料”、“正極混合材料”或者“混合正極材料”可互換使用,均指具有下組特征的材料:i)所述正極混合材料為高電導材料a和低電導材料b的混合物;ii)所述高電導材料a的阻抗為ra,所述低電導材料b的阻抗為rb,rb/ra≥2;iii)所述高電導材料a和所述低電導材料b中有一種或兩種是非球形顆粒,且按所述正極混合材料的總重量計,其中球形顆粒的含量≤50wt%;和iv)所述高電導材料a的中位徑為da50,所述低電導材料b的中位徑為db50,|da50-db50|/min(da50,db50)≥10%。如本文所用,術語“高電導材料”或者“高電導組分”可互換使用。如本文所用,術語“低電導材料”或者“低電導組分”可互換使用。正極材料三元材料鋰鎳鈷錳為licoo2的衍生品,其在4.3v以下的放電容量可達160mah/g,但是其成本較高且放電電壓平臺較低,并且其晶格中li+和ni2+容易發生混排。錳酸鋰雖然低成本且放電電壓平臺較高,但是其容量較低且其在循環過程中容易發生晶型轉變以及錳離子的溶解和jahn-teller效應,這會導致電池容量衰減嚴重。現有的大多數單一化學組分的正極材料通常不能滿足市場對鋰離子電池高效能應用的全部性能要求。正是為了解決正極材料存在的上述一系列問題,本發明人經過大量的實驗研究提供了一種鋰離子電池正極材料,所述正極材料具有下組特征:i)所述正極混合材料為高電導材料a和低電導材料b的混合物;ii)所述高電導材料a的阻抗為ra,所述低電導材料b的阻抗為rb,rb/ra≥2;iii)所述高電導材料a和所述低電導材料b中有一種或兩種是非球形顆粒,且按所述正極混合材料的總重量計,其中球形顆粒的含量≤50wt%;和iv)所述高電導材料a的中位徑為da50,所述低電導材料b的中位徑為db50,|da50-db50|/min(da50,db50)≥10%。在另一優選例中,所述高電導材料a包括(但并不限于):鈷酸鋰(licoo2)、鎳酸鋰(linio2)、錳酸鋰(limn2o4)、鎳錳酸鋰(linixmnyo4,x+y=2,)、鎳 鈷錳酸鋰(linixcoymnzo2,x+y+z=1)、鎳鈷鋁酸鋰(linixcoyalzo2,x+y+z=1)、富鋰材料(li(li1/3-(2x+y)/3mn2/3-(x+2y)/3nixcoyo2,x<1,y<1,x+y<1)、磷酸亞鐵鋰(lifepo4)、磷酸錳鋰(limnpo4)、磷酸釩鋰(li3v2(po4)3)、高錳材料(li2mno3和/或li4mn2o5)、硅酸鹽材料(li2msio4,m選自下組:ti、v、ni、mn、fe、co、或其組合)、高鋰材料(lixmo4,x≥5,m選自下組:ti、v、ni、mn、fe、co、或其組合)、用其他過渡金屬部分代替復合氧化物所得正極材料、用其他陽離子、陰離子或稀土元素摻雜所得正極材料、導電聚合物、或其混合。在另一優選例中,所述低電導材料b包括(但并不限于):鈷酸鋰(licoo2)、鎳酸鋰(linio2)、錳酸鋰(limn2o4)、鎳錳酸鋰(linixmnyo4,x+y=2,)、鎳鈷錳酸鋰(linixcoymnzo2,x+y+z=1)、鎳鈷鋁酸鋰(linixcoyalzo2,x+y+z=1)、富鋰材料(li(li1/3-(2x+y)/3mn2/3-(x+2y)/3nixcoyo2,x<1,y<1,x+y<1)、磷酸亞鐵鋰(lifepo4)、磷酸錳鋰(limnpo4)、磷酸釩鋰(li3v2(po4)3)、高錳材料(li2mno3和/或li4mn2o5)、硅酸鹽材料(li2msio4,m選自下組:ti、v、ni、mn、fe、co、或其組合)、高鋰材料(lixmo4,x≥5,m選自下組:ti、v、ni、mn、fe、co、或其組合)、用其他過渡金屬部分代替復合氧化物所得正極材料、用其他陽離子、陰離子或稀土元素摻雜所得正極材料、導電聚合物、或其混合。在一優選例中,所述高電導材料a為鎳鈷錳酸鋰;和/或所述低電導材料b為錳酸鋰。在另一優選例中,所述鎳鈷錳酸鋰為linixcoymnzo2,其中x+y+z=1,0.15≤x≤0.5,0.15≤y≤0.5,0.15≤z≤0.5。在另一優選例中,所述鎳鈷錳酸鋰為linixcoymnzo2,其中x+y+z=1,0.2≤x≤0.4,0.2≤y≤0.4,0.2≤z≤0.45。在另一優選例中,所述鎳鈷錳酸鋰為lini1/3co1/3mn1/3o2。在本發明中,rb/ra>2;和/或rb/ra≤10。在另一優選例中,rb/ra>2.2,較佳地rb/ra>2.3。在另一優選例中,rb/ra<10,較佳地rb/ra<8,更佳地rb/ra<6。在另一優選例中,ra≤6.5ω,較佳地ra≤6.3ω,更佳地ra≤6ω。在另一優選例中,rb≥12ω,較佳地rb≥12.5ω,更佳地rb≥13ω。在本發明中,所述正極材料中,所述高電導材料a的質量為wa,所述低電導材料b的質量為wb,wa/(wa+wb)=10-90%。在另一優選例中,所述正極材料中,所述高電導材料a的質量為wa,所述低電導材料b的質量為wb,wa/(wa+wb)=20-80%,較佳地30-75%,更佳地35-75%。在另一優選例中,所述正極材料中球形顆粒的含量≤40wt%,較佳地≤30wt%,更佳地≤20wt%,最佳地≤10wt%,最佳地≤1wt%。在本發明中,min(da50,db50)表示da50和db50中的最小值。在另一優選例中,|da50-db50|/min(da50,db50)≥13%,較佳地≥16%。在另一優選例中,(db50-da50)/da50≥10%,較佳地13%,更佳地≥16%。在另一優選例中,所述正極材料是采用本發明所述的方法制備的。在本發明中,在放電倍率≥5c且在相同放電倍率下,所述正極材料的放電容量為q,所述高電導材料a的放電容量為qa,所述低電導材料b的放電容量的qb,q≥(wa/(wa+wb))*qa+(wb/(wa+wb))*qb。應理解,在所述正極材料中,當rb/ra<2時,最終所得正極材料的阻抗并不能得到有效的降低,鋰離子擴散的改善效果也不明顯;當球形顆粒的含量>50wt%時,會導致所述正極材料中二次顆粒較多,使得其中顆粒的粒徑變大,這無疑會增大鋰離子的擴散路徑;當|da50-db50|/min(da50,db50)<10%時,即當所述正極材料中顆粒間粒徑相差太小時,會使得顆粒間混合不均勻,導致顆粒間空隙較大,進而增大了鋰離子的擴散難度。技術原理分析正極材料的可逆容量隨充放電倍率增加而降低。兩種正極組分材料在不同負載(即在不同倍率)時,其導電性一般不同。經過大量的實驗研究,本發明人發現:混合材料的應用性能直接與組分材料的物性,特別是導電性、形貌以及混合方式等相關,而不是簡單地由組分材料的化學式所決定。所以,僅僅根據組分材料的化學式是不可能預測和判斷所得混合材料的應用性能的,特別是高倍率可逆容量性能。從專利和學術文獻中所報道的案例,不難發現,采用同 樣兩種具有不同化學式的組分材料,經過不同的混合工藝加工后,其性能常常大相徑庭。而本發明人通過大量的對比實驗發現,只要組分材料的物性具有本發明所描述的特征性差異,即使采用完全不同的化學式作為組分材料,也完全可以在高倍率放電中獲得可逆容量的協同加成效果。具體地,將高電導組分材料和低電導組分材料混合形成正極材料后,在該正極材料的使用過程中,所述高電導組分材料不僅可提供鋰離子嵌脫時的可逆應用容量,而且可作為所述低電導組分材料的導電劑,進而提高所述低電導組分材料在高負載應用時的可逆容量;當所述正極材料達到一定閾值條件時,所述正極材料在高倍率(≥5c)下的倍率性能將展現出顯著協同效應的加成效果。進一步的研究表明:所述正極材料的協同效應的閾值條件與其中各組分材料的導電性及其顆粒結構等一系列微納結構密切相關。具體地,所述閾值條件如下:1)低電導材料b的阻抗rb與高電導材料a的阻抗ra的比值rb/ra≥2;2)所述高電導材料a和所述低電導材料b至少有一種為非球形顆粒,且按所述正極材料的總重量計,其中球形顆粒的含量≤50wt%3)所述高電導材料a的中位徑da50與所述低電導材料b的中位徑db50符合|da50-db50|/min(da50,db50)≥10%。典型地,以鎳鈷錳三元材料和錳酸鋰材料混合所形成的正極材料為例,其中,鎳鈷錳三元材料屬于層狀結構,鋰離子可以在其二維平面上自由脫嵌,因此其具有良好的離子導電性與電子導電性,如果合成工藝合理,一般為高電導組分材料;而錳酸鋰屬于尖晶石結構,雖然具有三維通道,但是其晶格結構穩定,因此鋰離子脫嵌能較大,這導致鋰離子導電性與電子導電性均較差,相比之下,一般為低電導組分材料。在上述具體的正極材料中,所述低電導組分材料錳酸鋰與所述高電導組分材料鎳鈷錳三元材料的電荷轉移電阻比為13.94/5.801=2.4(≥2),且所述正極材料中基本不含球形顆粒,并且錳酸鋰(中位徑為10.04μm)與鎳鈷錳三元材料(中位徑為8.53μm)的中位徑差(10.04-8.53)/8.53=17.7%(≥10%),達到協同效應的閾值條件。因此,該混合正極材料的倍率性能在放電倍率≥5c時可呈現出顯著的協同加成效果。更典型地,以錳酸鋰與鈷酸鋰混合所形成的正極材料為例,其中,錳酸鋰與鈷酸鋰的電荷轉移電阻比13.94/3.11=4.48(≥2),高于體現協同效應的閾值條件,且所述正極材料中基本不含球形顆粒,并且鈷酸鋰(中位徑為12.69μm)與錳 酸鋰(中位徑為10.04μm)的中位徑差(12.69-10.04)/10.04=26.39%(≥10%)。因此,該混合正極材料的倍率性能在放電倍率≥5c時呈現出明顯的協同加成效果。與此形成鮮明對比的是,雖然鎳鈷錳三元材料與鈷酸鋰材料各自都具有較好的導電性,但是兩者的電荷轉移電阻比5.801/3.11=1.865,不符合≥2的導電性閾值條件。因此,該混合正極材料的倍率性能在放電倍率≥5c時并沒有呈現出明顯的協同加成效果。如圖3所示,本發明人經過進一步的研究發現:在高倍率放電時,高電導組分與低電導組分之間可近似為一個并聯等效電路,這使得鋰離子在顆粒間遭遇堵塞時,可以通過高電導通道加速擴散。其中dlmo與dncm分別代表錳酸鋰與三元材料的導電性。因此,當混合材料中獨立組分b的電荷轉移電阻是獨立組分a的2倍,甚至更高時,通過匹配微納結構及優化混合工藝,兩者就會在高倍率(不低于5c)放電時展現出顯著協同效應的加成效果。正極材料的制備方法本發明還提供了一種所述的正極材料的制備方法,包括如下步驟:1)提供高電導材料a和低電導材料b;和2)混合所述高電導材料a和所述低電導材料b,得到所述的正極材料。在另一優選例中,所述高電導材料a和所述低電導材料b如本發明所述。在本發明中,步驟2)中,所述“混合”通過研磨機的研磨進行混合。在另一優選例中,所述“混合”的混合時間為0.1-24小時,較佳地0.3-12小時,更佳地0.5-5小時。在本發明中,所述正極材料中的兩種不同電導的組分經研磨作用混合以實現充分混勻的目的,相比于常規的球磨混合,采用所述研磨混合可有效減少混合過程對各組分的損耗,并且可有效避免二次顆粒的形成,降低正極材料的球形化程度。進一步而言,由于兩組分采用研磨混合后直接作為鋰離子電池的正極活性材料,故在所得正極材料中,所述高電導組分和所述低電導組分之間僅為物理混合,兩組分之間基本不發生化學反應,即所述高電導組分和所述低電導組分 仍保持各自獨立的化學組分和晶體結構,從而可以充分發揮各自的優勢。在本發明中,所述正極材料中的兩種不同電導的組分經研磨作用混合以實現充分混勻的目的,相比于常規的球磨混合,采用所述研磨混合可有效減少混合過程對各組分的損耗,并且可有效避免二次顆粒的形成,降低正極材料的球形化程度。進一步而言,由于兩組分采用研磨混合后直接作為鋰離子電池的正極活性材料,故在所得正極材料中,所述高電導組分和所述低電導組分之間僅為物理混合,兩組分之間基本不發生化學反應,即所述高電導組分和所述低電導組分仍保持各自獨立的化學組分和晶體結構,從而可以充分發揮各自的優勢。鋰離子電池本發明還提供了一種鋰離子電池,所述鋰離子電池直接以所述的正極材料作為正極活性材料。本發明還提供了一種所述的正極材料的用途,用于制備鋰離子電池。本發明還提供了一種改善鋰離子電池倍率性能的方法,使用所述的正極材料作為正極活性材料。在另一優選例中,所述正極材料還包括導電劑和粘結劑,所述導電劑和所述粘結劑沒有特別限制,可以參照本領域現有技術進行選擇本領域已有的材料。典型地,所述導電劑包括(但并不限于):superp、炭黑、碳納米管、石墨烯、或其組合。典型地,所述粘結劑包括(但并不限于):聚四氟乙烯、乙烯-丙烯-二烯三元共聚物、聚醚、聚酯、甲基丙烯酸甲酯類聚合物、丙烯腈類聚合物、偏二氟乙烯類聚合物、或其組合。在本發明中,所述鋰離子電池還包括電解質、隔膜和負極材料,所述電解質、所述隔膜和所述負極材料均沒有特別限制,可以參照本領域現有技術進行選擇本領域已有的材料。典型地,所述電解質包括(但并不限于):非水電解質溶液、聚合物電解質或固體電解質。典型地,所述隔膜包括(但并不限于):pp膜、pe膜。典型地,所述負極材料包括(但并不限于):鋰-碳層間化合物、鋰-硅層間化合物、鋰-過渡金屬氧化物、鋰-過渡金屬氮化物、鋰-鈦尖晶石化合物、鋰錫鐵等金屬合金、導電聚合物包裹的鋰金屬納米或亞微米顆粒、或其組合。與現有技術相比,本發明具有以下主要優點:(1)所述正極材料成本低、安全性好;(2)所述正極材料在高放電倍率下具有優異的倍率性能;(3)相比于其中的各組分獨立應用時,所述正極材料在高放電倍率下倍率性能呈現出顯著的協同加成效果,且放電倍率越高,協同加成效應越顯著;(4)所述正極材料為需快速充放電的設備提供了一種新的、性價比更高、綜合性能更優異的選擇;(5)所述制備方法工藝簡單、成本低、環保安全。下面結合具體實施例,進一步闡述本發明。應理解,這些實施例僅用于說明本發明而不用于限制本發明的范圍。下列實施例中未注明具體條件的實驗方法,通常按照常規條件或按照制造廠商所建議的條件。除非另外說明,否則百分比和份數按重量計算。除非另行定義,文中所使用的所有專業與科學用語與本領域熟練人員所熟悉的意義相同。此外,任何與所記載內容相似或均等的方法及材料皆可應用于本發明方法中。文中所述的較佳實施方法與材料僅作示范之用。通用測試方法阻抗測試方法檢測儀器:電化學工作站(chi6600)檢測參數:測試電壓4.3v,擾動電壓5mv,測試頻率10-2-105hz,測試點:循環至第四圈。形貌觀察檢測儀器:掃描電鏡(s-4800)檢測參數:二次電子分辨率:1.0nm(15kv);2.0nm(1kv);催化劑(ptonc)粒徑檢測檢測儀器:粒徑儀(s3500-special,microtrac,usa)檢測參數:分散劑:去離子水實施例1正極材料1按照質量比為30:70的比例稱取候選單組分正極材料limn2o4和lini1/3co1/3mn1/3o2,分別采用電化學工作站進行導電性檢測和采用掃描電鏡和粒徑儀進行微納結構檢測,然后在研磨機中進行混合得正極材料1。實施例2正極材料2同實施例1,區別在于:單組分正極材料limn2o4和lini1/3co1/3mn1/3o2的混合質量比為40:60。實施例3正極材料3同實施例1,區別在于:單組分正極材料limn2o4和lini1/3co1/3mn1/3o2的混合質量比為50:50。實施例4正極材料4同實施例1,區別在于:單組分正極材料limn2o4和lini1/3co1/3mn1/3o2的混合質量比為60:40。實施例5正極材料5同實施例3,區別在于:采用鈷酸鋰licoo2代替lini1/3co1/3mn1/3o2。對比例1正極材料c1同實施例3,區別在于:采用鈷酸鋰licoo2代替limn2o4。表1為本發明所用單組分正極材料limn2o4、lini1/3co1/3mn1/3o2和licoo2的阻抗測試結果。表1正極材料rct/ωlimn2o413.94lini1/3co1/3mn1/3o25.801licoo23.11從表1可知,在正極材料1-4中,所用單組分材料limn2o4和lini1/3co1/3mn1/3o2的阻抗比為2.4(≥2),lini1/3co1/3mn1/3o2為高電導組分,limn2o4為低電導組分;在正極材料5中,所用單組分材料limn2o4和licoo2的阻抗比為4.48(≥2),licoo2為高電導組分,limn2o4為低電導組分;而在正極材料c1中,所用單組分材料lini1/3co1/3mn1/3o2和licoo2的阻抗比為1.86(<2),licoo2為高電導組分,lini1/3co1/3mn1/3o2為低電導組分。sem觀測結果表明:上述三種單組分材料中均未見到顯著的球形顆粒。粒徑檢測結果顯示:limn2o4的d50為10.04um,d10≥3.94um,d90≤20.18um;lini1/3co1/3mn1/3o2的d50為8.53um,d10≥3.01um,d90≤28.28um;licoo2的d50為12.69um,d10≥7.78um,d90≤20.60um實施例6扣式電池1-5和c1分別將實施例1-5和對比例1制備好的正極材料1-5和c1作為鋰離子電池正極活性材料,按照正極活性材料:superp:pvdf=85%:10%:5%的質量比準確稱取,研磨混合均勻,接著加入nmp溶劑混合成糊狀物,磁力攪拌3h,并將其涂覆在預處理過的鋁箔上。將涂覆后的鋁箔在鼓風干燥箱50℃干燥2h后,再轉入真空干燥箱120℃真空干燥24h,冷卻取出極片,用大約10mp的壓力壓實后,用切片機切成所需大小的鋰離子電池用正極片。用上述得到的極片作為扣式電池的 正極,純鋰片作為負極,1mol/l的lipf6(溶劑:ec/dmc=1:1)作為電解液,隔膜采用celgard2550,在充滿氬氣的手套箱中組裝成型號為cr2032的扣式電池1-5和c1。對比例2扣式電池c2同實施例5,區別在于:僅以lini1/3co1/3mn1/3o2作為正極活性材料。對比例3扣式電池c3同實施例5,區別在于:僅以limn2o4作為正極活性材料。對比例4扣式電池c4同實施例5,區別在于:僅以licoo2作為正極活性材料。倍率性能測試將扣式電池1-5和c1-c4分別在3.0-4.3v(相對于li/li+電極)的電壓范圍內,在32ma/g(即0.2c)、160ma/g(即1c)、800ma/g(即5c)、1600ma/g(即10c)的電流密度下,在充放電測試系統(藍電測試系統ct2001a)中進行恒流充放電測試,其中測試溫度保持在室溫。表2為扣式電池1-5和c1-c4的倍率性能測試結果,單位為mah/g。表2將表2數據進一步處理得到圖1,其中縱坐標差值的計算公式如式(i)所示:〔q/[(wa/(wa+wb))*qa+(wb/(wa+wb))*qb]〕-1(i)其中q為正極混合材料的放電容量,qa為高電導材料a的放電容量,qb為低 電導材料b的放電容量,wa為高電導材料a的質量,wb為低電導材料b的質量。結合表2和圖1可知:當混合材料中單組分滿足發生協同的閾值條件時,混合材料協同效應明顯,放電可逆容量的加成效果隨放電倍率的增加而增加。循環性能測試將扣式電池1-4和c2,c2分別在3.0-4.3v(相對于li/li+電極)的電壓范圍內,160ma/g(即1c)的電流密度下,在充放電測試系統(藍電測試系統ct2001a)中進行恒流充放電測試,其中測試溫度保持在室溫。圖2為電池c2、c3和1-4在放電倍率為1c下的循環性能測試結果。從圖2可以看出:以正極混合材料2,3分別為正極活性材料所制備的鋰離子電池在循環100次過程中的放電穩定性顯著優于分別以各單一組分材料為正極活性材料所制備的鋰離子電池的循環穩定性。在本發明提及的所有文獻都在本申請中引用作為參考,就如同每一篇文獻被單獨引用作為參考那樣。此外應理解,在閱讀了本發明的上述講授內容之后,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落于本申請所附權利要求書所限定的范圍。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1