穩定的咪唑并菲啶材料的制作方法
本發明大體上涉及新穎化合物;包含所述化合物的組合物;和所述化合物和組合物的應用,包括包含所述化合物和/或組合物的有機電致發光裝置。
聯合研究協議
所要求的本發明是由達成聯合大學公司研究協議的以下各方中的一或多者,以以下各方中的一或多者的名義和/或結合以下各方中的一或多者而作出:南加州大學和環宇顯示器公司(Universal Display Corporation)。所述協議在作出所要求的本發明的日期當天和之前就生效,并且所要求的本發明是因在所述協議的范圍內進行的活動而作出。
背景技術:
一般來說,OLED包含安置在陽極與陰極之間并且電連接到陽極和陰極的至少一個有機層。當施加電流時,陽極注入空穴并且陰極注入電子到有機層中。所注入的空穴和電子各自朝帶相反電荷的電極遷移。當電子和空穴局限于同一分子上時,形成“激子”,其為具有激發能量狀態的局部化電子-空穴對。當激子經由光電發射機制弛豫時,發射光。在一些情況下,激子可以局限于激元或激態復合物上。非輻射機制(例如熱弛豫)也可能發生,但通常被視為不合需要的。
最初的OLED使用從單態發射光(“熒光”)的發射分子,如例如美國專利第4,769,292號中所公開,所述專利以全文引用的方式并入。熒光發射通常在小于10納秒的時間范圍中發生。
最近,已經論證了具有從三重態發射光(“磷光”)的發射材料的OLED。巴爾多(Baldo)等人的“從有機電致發光裝置的高效磷光發射(Highly Efficient Phosphorescent Emission from Organic Electroluminescent Devices)”,自然(Nature),第395卷,第151-154頁,1998;(“巴爾多-I”)和巴爾多等人的“基于電致磷光的非常高效綠色有機發光裝置(Very high-efficiency green organic light-emitting devices based on electrophosphorescence)”,應用物理學報(Appl.Phys.Lett.),第75卷,第3期,4-6(1999)("Baldo-II"),其以全文引用的方式并入。磷光可以稱為“禁阻”躍遷,因為所述躍遷需要自旋態變化,并且量子力學指示這種躍遷是不利的。因此,磷光通常發生在超過至少10納秒并且典型地大于100納秒的時間幀中。如果磷光的自然輻射壽命太長,那么三重態可以通過非輻射機制而衰變,以便不發射光。往往還在非常低的溫度下在含有雜原子、具有非共用電子對的分子中觀察到有機磷光。2,2'-聯吡啶是這種分子。非輻射衰變機制典型地是溫度依賴性的,以使得在液氮溫度下展現磷光的有機材料典型地在室溫下不展現磷光。但,如巴爾多所證實,此問題可以通過選擇在室溫下發磷光的磷光化合物而得到解決。代表性發射層包括經摻雜或未經摻雜的磷光有機金屬材料,例如美國專利第6,303,238號、第6,310,360號、第6,830,828號和第6,835,469號、美國專利申請公開第2002-0182441號和WO 2002/074015中所公開。
磷光前面可以是從三重態激發態躍遷為中間的非三重態狀態,從所述非三重態狀態發生發射衰變。舉例來說,配位到鑭系元素的有機分子往往從局域化于鑭系金屬上的激發態發磷光。然而,此類材料不直接從三重態激發態發磷光,而實際上從集中于鑭系金屬離子上的原子激發態發射。銪二酮絡合物說明了一組這些類型的物質。
可以通過限制、優選地通過鍵結緊密接近于具有高原子數的原子的有機分子,優于熒光增強來自三重態的磷光。稱為重原子效應的此現象通過稱為自旋軌道耦合的機制而產生。可以從有機金屬分子(例如三(2-苯基吡啶)銥(III))的激發的金屬到配位體電荷轉移(MLCT)狀態觀察到這種磷光躍遷。
技術實現要素:
在一個方面,本發明提供了一種化合物,其具有結構式(1a):
其中A是任何適合鍵聯基團;如本文在氮原子N1和N2的情況下所用的整數“1”和“2”除了用作方便描述的標記之外沒有意義;如本文在碳原子C1a到C1c的情況下所用的標記1a到1c除了用作方便描述的標記之外沒有意義;Rab、Rga和R1b到R1f是任何適合取代基;Rga和R1b到R1f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(1a)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團。在具有結構式(1a)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(1a)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中R是任何適合取代基。在具有結構式(1a)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中每個R獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在具有結構式(1a)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在一個實施例中,具有結構式(1a)的化合物可以或可以不包含配位體(L)。在一個實施例中,具有結構式(1a)的化合物包含配位體(L)。在一個實施例中,具有結構式(1a)的化合物不包含配位體(L)。在一個實施例中,具有結構式(1a)的化合物包含配位體(L),所述配位體是經取代或未經取代的環金屬化配位體。
在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”連接在一起形成環。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”連接在一起形成飽和環。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”連接在一起形成飽和五元環或飽和六元環或其組合。
在一些實施例中,具有結構式(1a)的化合物具有三重態激發態。在具有結構式(1a)的化合物的一些實施例中,當化合物處于三重態激發態時,鍵聯基團A使N2與C1b之間的鍵結穩定免于裂解。在一些實施例中,具有結構式(1)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(1a)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(1a)的化合物的峰值發射波長范圍介于400nm到500nm。
在另一方面,本發明提供了具有結構式(2a)和(2b)的化合物:
其中A1和A2各自是第一鍵聯基團;R1b到R1f和R2b到R2f是任何適合取代基;具有結構式(2a)和(2b)的化合物可以經由形成于Rab與Rac之間或Rga與Rgb之間或這兩種情況的第二鍵聯基團鍵聯在一起;并且R1b到R1f和R2b到R2f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(2a)和(2b)的化合物的一些實施例中,第一鍵聯基團A1和A2包含2到3個鍵聯原子。在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子,所述鍵聯原子中的每一者獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在一些實施例中,A1與A2不同。在一些實施例中,A1與A2相同。在具有結構式(2a)和(2b)的化合物的一些實施例中,R1b到R1f和R2b到R2f獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(2a)和(2b)的化合物的一些實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有1到3個鍵聯原子的第二鍵聯基團,所述鍵聯原子各自獨立地選自由以下組成的群組:B、N、P、O、S、Se、C、Si、Ge或其組合。在一個此類實施例中,第二鍵聯基團獨立地選自由以下組成的群組:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR”'、-CRR”'-CRR”'-、SiRR”'和GeRR”',其中每個R或R”'是任何適合取代基。在一些此類實施例中,每個R或R”'獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在另一此類實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有至少兩個鍵聯原子的第二鍵聯基團,其獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。例示性第二鍵聯基團包括:
其中每個R獨立地選自H、甲基或苯基。
在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者具有三重態激發態。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A1和A2。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者的峰值發射波長小于500nm。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者的峰值發射波長小于480nm。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者的峰值發射波長范圍介于400nm到500nm。
在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2獨立地選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基或苯基。在具有結構式(2a)和(2b)的化合物的一些實施例中,第二鍵聯基團選自NR、O、-CH2-CH2-、-CHR'-CHR'-、-CR'R”'-CH2-、-CRR”'-CRR”'-和其組合,其中R'和R”'獨立地是甲基或苯基。
在另一方面,本發明提供了一種化合物,其具有結構式(3a):
其中A是第一鍵聯基團;L2和L3是鍵聯基團;R1a到R1f和R3a到R3f是任何適合取代基;R1f、R3a、R3c和R3d的任何組合任選地接合形成一或多個稠合環;其中L2與R1f和/或R3a任選地接合形成一個、兩個或更多個稠合環;其中L3與R3c和/或R3d任選地接合形成一個、兩個或更多個稠合環;并且R1b到R1f和R2b到R2f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。在一些實施例中,L2與R1f任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3d任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3c任選地接合形成一或多個稠合環。在一些實施例中,L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。
在具有結構式(3a)的化合物的一些實施例中,每個第一鍵聯基團A具有2到3個鍵聯原子。在具有結構式(3a)的化合物的一些實施例中,每個第一鍵聯基團A具有2到3個鍵聯原子,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(3a)的化合物的一些實施例中,L2和L3獨立地選自由以下組成的群組:單鍵、BR、NR、PR、O、S、Se、C─O、S─O、SO2、CRR'、SiRR'和GeRR'。在具有結構式(3a)的化合物的一些實施例中,R1a到R1f和R3a到R3f、R和R'各自獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(3a)的化合物的一些實施例中,兩個相鄰R1f、R3a、R3c、R3d、R和R'任選地接合在一起形成稠合環。
在具有結構式(3a)的化合物的一些實施例中,第一鍵聯基團A獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在一些實施例中,具有結構式(3a)的化合物具有三重態激發態。在一些實施例中,具有結構式(3a)的化合物具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A。在一些實施例中,具有結構式(3a)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(3a)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(3a)的化合物的峰值發射波長范圍介于400nm到500nm。
在具有結構式(3a)的化合物的一些實施例中,第一鍵聯基團A選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”是甲基或苯基。在具有結構式(3a)的化合物的一些實施例中,L3選自由以下組成的群組:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR'、SiRR'和GeRR'。在具有結構式(3a)的化合物的一些實施例中,R1f或R3a與R或R'接合在一起形成稠合環。在具有結構式(3a)的化合物的一些實施例中,R3c或R3d與R或R'接合在一起形成稠合環。
在一個方面,本發明提供了一種化合物,其具有結構式(1):
其中M是具有大于40的原子量的金屬,n具有至少1的值,并且m+n是可以與所述金屬連接的最大配位體數。在一些實施例中,所述金屬選自由以下組成的群組:Re、Ru、Os、Rh、Ir、Pd、Pt和Au。在其它實施例中,M是銥(Ir);n是2或3;m是0或1;m+n是3。A是任何適合鍵聯基團。R1a到R1g是任何適合取代基。R1b到R1g所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(1)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團。在具有結構式(1)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(1)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中R是任何適合取代基。在具有結構式(1)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中每個R獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在具有結構式(1)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在一個實施例中,具有結構式(1)的化合物可以或可以不包含配位體(L)。在一個實施例中,具有結構式(1)的化合物包含配位體(L)。在一個實施例中,具有結構式(1)的化合物不包含配位體(L)。在一個實施例中,具有結構式(1)的化合物包含配位體(L),所述配位體是經取代或未經取代的環金屬化配位體。
在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成環。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成飽和環。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成飽和五元環或飽和六元環或其組合。
在一些實施例中,具有結構式(1)的化合物具有三重態激發態。在具有結構式(1)的化合物的一些實施例中,當化合物處于三重態激發態時,鍵聯基團A使N2與C1b之間的鍵結穩定免于裂解。在一些實施例中,具有結構式(1)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(1)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(1)的化合物的峰值發射波長范圍介于400nm到500nm。
在具有結構式(1)的化合物的一些實施例中,鍵聯基團A選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”是甲基或苯基。
在另一方面,本發明提供了一種裝置,其包含具有結構式(1)的化合物。在一些實施例中,所述裝置包含第一有機發光裝置,所述第一有機發光裝置進一步包含陽極;陰極;和有機層,所述有機層安置在所述陽極與所述陰極之間、包含具有結構式(1)的化合物。在裝置的一些實施例中,所述有機層進一步包含主體。在裝置的一些實施例中,所述有機層進一步包含主體,所述主體包含含有至少一個選自由以下組成的群組的基團的有機分子:咔唑、二苯并噻吩、二苯并呋喃、氮雜咔唑、氮雜-二苯并噻吩和氮雜-二苯并呋喃。
在一些實施例中,根據本發明的裝置是消費型產品或照明面板。
在另一方面,本發明提供了一種化合物,其具有結構式(2):
其中M是鉑(Pt);其中A1和A2各自是第一鍵聯基團;其中R1b到R1f和R2b到R2f是任何適合取代基;并且Rab與Rac或Rga與Rgb是可以鍵結在一起形成第二鍵聯基團的取代基。R1b到R1f和R2b到R2f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子。在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子,所述鍵聯原子中的每一者獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在一些實施例中,A1與A2不同。在一些實施例中,A1與A2相同。在具有結構式(2)的化合物的一些實施例中,R1b到R1f和R2b到R2f獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(2)的化合物的一些實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有1到3個鍵聯原子的第二鍵聯基團,所述鍵聯原子各自獨立地選自由以下組成的群組:B、N、P、O、S、Se、C、Si、Ge或其組合。在具有結構式(2)的化合物的一些此類實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成獨立地選自由以下組成的群組的第二鍵聯基團:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR”'、-CRR”'-CRR”'-和GeRR”',其中每個R或R”'是任何適合取代基。在一些此類實施例中,每個R或R”'獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在一些其它實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有至少兩個鍵聯原子的第二鍵聯基團,其獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。例示性第二鍵聯基團包括:
其中每個R獨立地選自H、甲基或苯基。
在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在一些實施例中,具有結構式(2)的化合物具有三重態激發態。在一些實施例中,具有結構式(2)的化合物具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A。在一些實施例中,具有結構式(2)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(2)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(2)的化合物的峰值發射波長范圍介于400nm到500nm。
在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基或苯基。在具有結構式(2)的化合物的一些實施例中,第二鍵聯基團選自NR、O、-CH2-CH2-、-CHR'-CHR'-、-CR'R”'-CH2-、-CRR”'-CRR”'-和其組合,其中R'和R”'獨立地是甲基或苯基。
在另一方面,本發明提供了一種裝置,其包含第一有機發光裝置,所述第一有機發光裝置進一步包含陽極;陰極;和有機層,所述有機層安置在所述陽極與所述陰極之間并且包含具有結構式(2)的化合物。在根據本發明的裝置的一些實施例中,所述有機層進一步包含主體。在根據本發明的裝置的一些實施例中,所述主體包含含有至少一個選自由以下組成的群組的基團的有機分子:咔唑、二苯并噻吩、二苯并呋喃、氮雜咔唑、氮雜-二苯并噻吩和氮雜-二苯并呋喃。在一些實施例中,根據本發明的裝置是消費型產品或照明面板,其中所述裝置包含第一有機發光裝置,所述第一有機發光裝置進一步包含陽極;陰極;和有機層,所述有機層安置在所述陽極與所述陰極之間并且包含具有結構式2的化合物。
在另一方面,本發明提供了一種化合物,其具有結構式(3):
其中M是鉑(Pt);A是第一鍵聯基團;L2和L3是鍵聯基團;R1a到R1f和R3a到R3f是任何適合取代基;并且R1f、R3a、R3c和R3d的任何組合任選地接合形成一或多個稠合環。R1b到R1f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。L2與R1f或L2與R3a或L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。L3與R3c或L3與R3d或L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。
在具有結構式(3)的化合物的一些實施例中,第一鍵聯基團A具有2到3個鍵聯原子。在具有結構式(3)的化合物的一些實施例中,第一鍵聯基團A具有2到3個鍵聯原子,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(3)的化合物的一些實施例中,L2和L3獨立地選自由以下組成的群組:單鍵、BR、NR、PR、O、S、Se、C─O、S─O、SO2、CRR'、SiRR'和GeRR'。在具有結構式(3)的化合物的一些實施例中,R1a到R1f和R3a到R3f、R和R'各自獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(3)的化合物的一些實施例中,兩個相鄰R1f、R3a、R3c、R3d、R和R'任選地接合在一起形成稠合環。在一些實施例中,L2與R1f和/或R3a任選地接合形成一或多個稠合環。在一些其它實施例中,L3與R3c和/或R3d任選地接合形成一或多個稠合環。在一些實施例中,L2與R1f任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3d任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3c任選地接合形成一或多個稠合環。在一些實施例中,L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。
在具有結構式(3)的化合物的一些實施例中,第一鍵聯基團A獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在一些實施例中,具有結構式(3)的化合物具有三重態激發態。在一些實施例中,具有結構式(3)的化合物具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A。在一些實施例中,具有結構式(3)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(3)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(3)的化合物的峰值發射波長范圍介于400nm到500nm。
在具有結構式(3)的化合物的一些實施例中,第一鍵聯基團A選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基或苯基。在具有結構式(3)的化合物的一些實施例中,L3選自由以下組成的群組:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR'、SiRR'和GeRR'。在具有結構式(3)的化合物的一些實施例中,R1f或R3a與R或R'接合在一起形成稠合環。在具有結構式(3)的化合物的一些實施例中,R3c或R3d與R或R'接合在一起形成稠合環。
在另一方面,本發明提供了一種裝置,其包含第一有機發光裝置,所述第一有機發光裝置進一步包含陽極;陰極;有機層,所述有機層安置在所述陽極與所述陰極之間、包含具有結構式(1)、(2)或(3)的化合物。在一些實施例中,根據本發明的裝置包含有機層,所述有機層包含具有結構式(1)、(2)或(3)的化合物,其中所述有機層進一步包含主體。在一些實施例中,根據本發明的裝置包含有機層,所述有機層包含具有結構式(1)、(2)或(3)的化合物,其中所述有機層進一步包含主體,其中所述主體包含含有至少一個選自由以下組成的群組的基團的有機分子:咔唑、二苯并噻吩、二苯并呋喃、氮雜咔唑、氮雜-二苯并噻吩和氮雜-二苯并呋喃。
在一些實施例中,根據本發明的裝置是消費型產品或照明面板,其中所述裝置包含第一有機發光裝置,所述第一有機發光裝置進一步包含陽極;陰極;有機層,所述有機層安置在所述陽極與所述陰極之間、包含具有結構式(1)、(2)或(3)的化合物。
附圖說明
當結合例示性實施例的附圖閱讀時,將更好地理解前述發明內容以及根據本發明的化合物、組合物和裝置的例示性實施例的以下詳細描述。然而,應理解,本發明不限于所示精確排列和手段。
在圖中:
圖1展示了例示性有機發光裝置100;并且
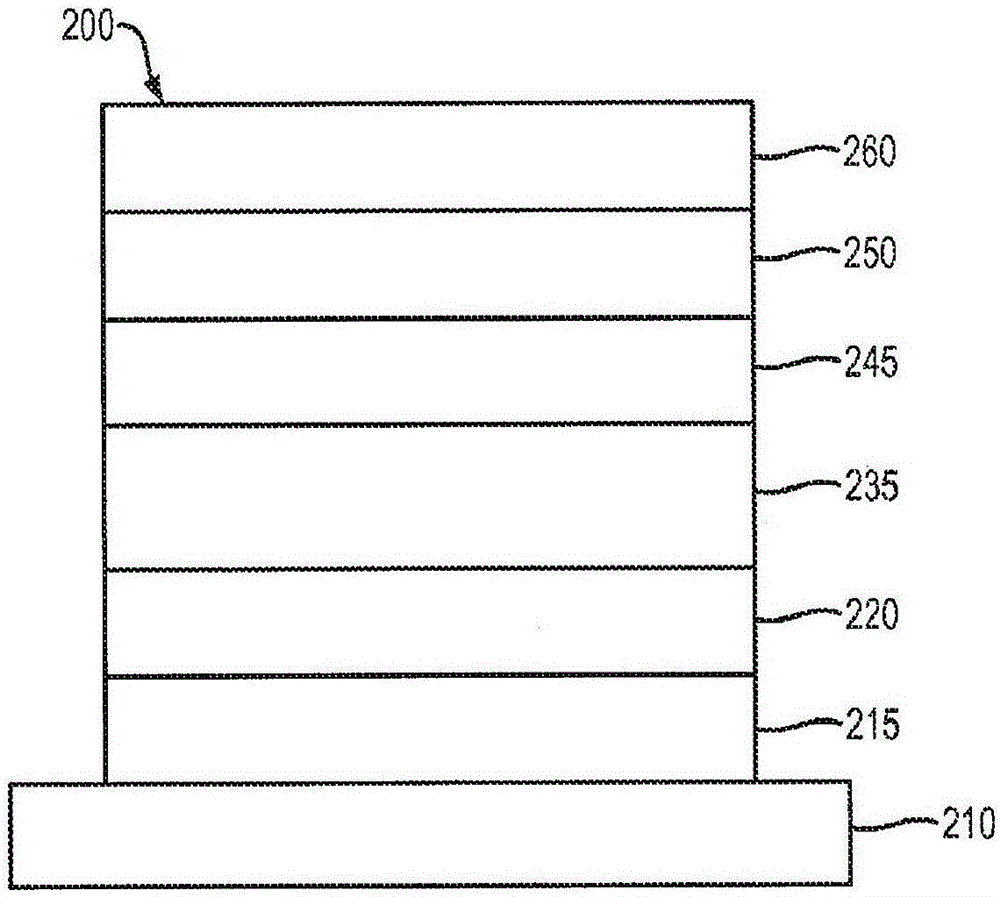
圖2說明了根據本發明的例示性有機發光裝置200。
圖3a和3b說明了比較實例1的最小化斷鍵幾何構型(頂部)和最小化非斷鍵幾何構型(底部)的計算模型。
圖4說明了比較化合物4的MALDI負模式質譜。最高強度峰對應于咪唑環的斷裂。
圖5說明了3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的x射線晶體結構。
圖6說明了3,3-二甲基-3,4-二氫-1,2a1-二氮雜-3-硅苯并[fg]乙烯合蒽的x射線晶體結構。
圖7描繪了化合物49在77K和室溫2-甲基THF溶劑和固態PMMA基質中的發射光譜。
具體實施方式
咪唑并菲啶是當連接到鉑和銥金屬兩者時可以提供460nm發射的適用配位體。磷光咪唑并菲啶絡合物可以在高光致發光量子產率和高裝置效率下提供深藍色發射。不幸地,對于基于銥和鉑兩者的藍色發射絡合物,裝置壽命都有限。我們在本文中提供了通過將一鍵定位在配位體上來提高咪唑并菲啶配位體的穩定性的策略,所述鍵通過計算理論、質譜片段分析和光氧化研究顯示為弱鍵,這歸因于多環環應力和電子結構。
參考圖1,展示了例示性有機發光裝置100。裝置100可以包括襯底110、陽極115、空穴注入層120、空穴輸送層125、電子阻擋層130、發射層135、空穴阻擋層140、電子輸送層145、電子注入層150、保護層155和陰極160。陰極160是具有第一導電層162和第二導電層164的復合陰極。
參考圖2,展示了根據本發明的例示性有機發光裝置200。裝置200可以包括襯底210、陽極215、空穴注入層220、發射層235、電子輸送層245、電子注入層250和陰極260。
襯底210可以是提供所要結構性質的任何適合襯底。襯底210可以是柔性或剛性的。襯底210可以是透明的、半透明的或不透明的。塑料和玻璃是優選的剛性襯底材料的實例。塑料和金屬箔是優選的柔性襯底材料的實例。襯底210可以是半導體材料以便有助于制造電路。舉例來說,襯底210可以是硅晶片,在其上制造電路,能夠控制OLED隨后沉積于襯底上。可以使用其它襯底。襯底210的材料和厚度可以經選擇以獲得所要結構和光學性質。
陽極215可以是足夠導電以將空穴輸送到有機層的任何適合陽極。陽極215的材料優選地功函數高于約4eV(“高功函數材料”)。優選的陽極材料包括導電金屬氧化物,例如氧化銦錫(ITO)和氧化銦鋅(IZO)、氧化鋁鋅(AlZnO);和金屬。陽極215(和襯底210)可以足夠透明以產生底部發射裝置。優選的透明襯底與陽極組合是沉積于玻璃或塑料(襯底)上的市售ITO(陽極)。柔性并且透明襯底-陽極組合公開于美國專利第5,844,363號中,所述專利以全文引用的方式并入。陽極215可以是不透明的和/或反射性的。反射陽極215對于一些頂部發射裝置可以是優選的以增加從裝置頂部發射的光的量。陽極215的材料和厚度可以經選擇以獲得所要導電和光學性質。在陽極215是透明的時,特定材料的厚度范圍可以是足夠厚以提供所要導電性,又足夠薄以提供所要透明程度。可以使用其它陽極材料和結構。
I.定義
如本文所用,術語“烷基”意指直鏈或支鏈飽和非環烴基,其可以任選地經任何適合取代基取代。因此,根據本發明的烷基可以包含伯、仲、叔和季碳原子的任何組合。例示性烷基包括(但不限于)C1-C20烷基、C1-C18烷基、C1-C16烷基、C1-C14烷基、C1-C12烷基、C1-C10烷基、C1-C8烷基、C1-C6烷基、C1-C4烷基、C1-C3烷基和C2烷基。特定實例包括甲基、乙基、1-丙基、2-丙基、2-甲基-1-丙基、1-丁基、2-丁基、叔丁基、正辛基、正癸基和正十六烷基。
如本文所用,術語“雜烷基”是指其中一或多個碳原子經雜原子置換的如本文所述的烷基。適合雜原子包括氧、硫、氮、磷等。雜烷基的實例包括(但不限于)烷氧基、氨基、硫酯、聚(乙二醇)和經烷基取代的氨基。
如本文所用,術語“烯基”意指具有一或多個碳-碳雙鍵的非環支鏈或非支鏈烴基。例示性烯基包括(但不限于)C1-C20烯基、C2-C18烯基、C2-C16烯基、C2-C14烯基、C2-C12烯基、C2-C10烯基、C2-C8烯基、C2-C6烯基、C2-C4烯基、C2-C3烯基和C2烯基。特定實例包括(但不限于)乙烯基、丙烯基、1-丁烯基、2-丁烯基、異丁烯基、1-戊烯基、2-戊烯基、3-甲基-1-丁烯基、2-甲基-2-丁烯基和2,3-二甲基-2-丁烯基。
如本文所用,術語“亞烷基”意指任選地經取代的飽和直鏈或支鏈烴基。例示性亞烷基包括(但不限于)C1-C20亞烷基、C2-C18亞烷基、C2-C16亞烷基、C2-C14亞烷基、C2-C12亞烷基、C2-C10亞烷基、C2-C8亞烷基、C2-C6亞烷基、C2-C4亞烷基、C2-C3亞烷基和C2亞烷基。亞烷基的特定實例包括(但不限于)亞甲基、二亞甲基和三亞甲基。
如本文所用,術語“炔基”意指具有至少一個碳-碳三鍵的非環支鏈或非支鏈烴。例示性炔基包括(但不限于)C1-C20炔基、C2-C18炔基、C2-C16炔基、C2-C14炔基、C2-C12炔基、C2-C10炔基、C2-C8炔基、C2-C6炔基、C2-C4炔基、C2-C3炔基和C2炔基。炔基的特定實例包括(但不限于)炔丙基和3-戊炔基、乙炔基、丙炔基、1-丁炔基、2-丁炔基、1-戊炔基、2-戊炔基和3-甲基-1-丁炔基。
如本文所用,術語“芳基”意指任選地經取代的單環或多環芳香族烴。芳基的特定實例包括(但不限于)苯基、苯基、4-甲基苯基、2,6-二甲基苯基、萘基、蒽基和菲基。
如本文所用,術語“芳烷基”意指通過烷基橋連接的如本文所定義的一或多個芳基(例如,-烷基-(芳基)j,其中j是1、2或3)。芳烷基的特定實例包括(但不限于)苯甲基(—CH2-苯基,即,Bn)、二苯基甲基(—CH2—(苯基)2)和三苯甲基(—C-(苯基)3)。
如本文所用,術語“雜芳基”意指具有至少一個雜原子和至少一個碳原子的任選地經取代的單環或多環芳香族烴。在一些實施例中,至少一個雜原子選自氮、氧、硅、硒和硫。雜芳基的特定實例包括(但不限于)呋喃基、苯并呋喃基、噻吩基、苯并噻吩基、吡咯基、吲哚基、異吲哚基、氮雜吲哚基、吡啶基、喹啉基、異喹啉基、噁唑基、異噁唑基、苯并噁唑基、吡唑基、咪唑基、苯并咪唑基、噻唑基、苯并噻唑基、異噻唑基、噠嗪基、嘧啶基、吡嗪基、三嗪基、噌啉基、酞嗪基和喹唑啉基。
除非另外說明,否則如本文所用,術語“雜環”和所述術語的變化形式(包括“雜環基(heterocyclic group)”和“雜環基(heterocyclyl)”)意指具有至少兩種不同元素作為環成員原子的任選地經取代的單環或多環系統,并且其中單環或多環系統是飽和、不飽和或芳香族的。在一些實施例中,雜環包含碳原子和至少一個雜原子。在一些實施例中,雜環包含碳原子和至少一個選自氮、氧、硅、硒和硫的雜原子,并且其中氮、氧、硅、硒和硫雜原子可以任選地氧化,并且氮雜原子可以任選地季銨化。雜環的實例包括(但不限于)呋喃基、苯并呋喃基、噻吩基、苯并噻吩基、吡咯基、吲哚基、異吲哚基、氮雜吲哚基、吡啶基、喹啉基、異喹啉基、噁唑基、異噁唑基、苯并噁唑基、吡唑基、咪唑基、苯并咪唑基、噻唑基、苯并噻唑基、異噻唑基、噠嗪基、嘧啶基、吡嗪基、三嗪基、噌啉基、酞嗪基和喹唑啉基。因此,除了上文所列的芳香族雜芳基之外,雜環還包括(但不限于)嗎啉基、吡咯烷酮基、吡咯烷基、哌嗪基、哌啶基、乙內酰脲基、戊內酰胺基、環氧乙烷基、氧雜環丁烷基、四氫呋喃基、四氫吡喃基、四氫吡啶基、四氫嘧啶基、四氫噻吩基、四氫硫吡喃基、四氫嘧啶基、四氫噻吩基和四氫硫吡喃基。
如本文所用,并且如本領域技術人員一般將理解,如果第一能級較接近真空能級,那么第一“最高占用分子軌道”(HOMO)或“最低未占用分子軌道”(LUMO)能級“大于”或“高于”第二HOMO或LUMO能級。由于將電離電位(IP)測量為相對于真空能級的負能量,因此較高HOMO能級對應于具有較小絕對值的IP(負得較少的IP)。類似地,較高LUMO能級對應于具有較小絕對值的電子親和性(EA)(負得較少的EA)。在常規能級圖上,真空能級在頂部,材料的LUMO能級高于同一材料的HOMO能級。“較高”HOMO或LUMO能級表現為比“較低”HOMO或LUMO能級更靠近這個圖的頂部。
如本文所用,術語“三重態能量”是指對應于既定材料的磷光光譜中可辯別的最高能量特征的能量。最高能量特征未必是在磷光光譜中具有最大強度的峰,并且可以是例如這個峰的高能量側上的明顯肩部的局部最大值。
II.配位體
在一個方面,本發明提供了一種化合物,其具有結構式(1a):
其中A是任何適合鍵聯基團;如本文在氮原子N1和N2的情況下所用的整數“1”和“2”除了用作方便描述的標記之外沒有意義;如本文在碳原子C1a到C1c的情況下所用的標記1a到1c除了用作方便描述的標記之外沒有意義;并且R1a到R1g是任何適合取代基。R1b到R1f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(1a)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團。在具有結構式(1a)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(1a)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中R是任何適合取代基。在具有結構式(1a)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中每個R獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在具有結構式(1a)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在一個實施例中,具有結構式(1a)的化合物可以或可以不包含配位體(L)。在一個實施例中,具有結構式(1a)的化合物包含配位體(L)。在一個實施例中,具有結構式(1a)的化合物不包含配位體(L)。在一個實施例中,具有結構式(1a)的化合物包含配位體(L),所述配位體是經取代或未經取代的環金屬化配位體。
在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成環。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成飽和環。在具有結構式(1a)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成飽和五元環或飽和六元環或其組合。
在一些實施例中,具有結構式(1a)的化合物具有三重態激發態。在具有結構式(1a)的化合物的一些實施例中,當化合物處于三重態激發態時,鍵聯基團A使N2與C1b之間的鍵結穩定免于裂解。在一些實施例中,具有結構式(1)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(1a)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(1a)的化合物的峰值發射波長范圍介于400nm到500nm。具有式(1a)的結構的化合物的特定實例包括(但不限于)以下展示的化合物(1-1)到(1-181)。
在另一方面,本發明提供了具有結構式(2a)和(2b)的化合物:
其中A1和A2各自是第一鍵聯基團;R1b到R1f和R2b到R2f是任何適合取代基;具有結構式(2a)和(2b)的化合物的Rab和Rac可以經由形成于Rab與Rac之間或Rga與Rgb之間或這兩種情況的第二鍵聯基團鍵聯在一起;并且R1b到R1f和R2b到R2f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子。在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子,所述鍵聯原子中的每一者獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在一些實施例中,A1與A2不同。在一些實施例中,A1與A2相同。在具有結構式(2a)和(2b)的化合物的一些實施例中,R1b到R1f和R2b到R2f獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(2a)和(2b)的化合物的一些實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有1到3個鍵聯原子的第二鍵聯基團,所述鍵聯原子獨立地選自由以下組成的群組:B、N、P、O、S、Se、C、Si、Ge或其組合。在一個此類實施例中,第二鍵聯基團獨立地選自由以下組成的群組:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR”'、-CRR”'-CRR”'-、SiRR”'和GeRR”',其中每個R或R”'是任何適合取代基。在一些此類實施例中,每個R或R”'獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在另一此類實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有至少兩個鍵聯原子的第二鍵聯基團,其獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。例示性第二鍵聯基團包括:
其中每個R獨立地選自H、甲基或苯基。
在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者具有三重態激發態。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A1和A2。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者的峰值發射波長小于480nm。在一些實施例中,具有結構式(2a)和(2b)的化合物中的每一者的峰值發射波長范圍介于400nm到500nm。
在具有結構式(2a)和(2b)的化合物的一些實施例中,每個第一鍵聯基團A1和A2獨立地選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基和苯基。在具有結構式(2a)和(2b)的化合物的一些實施例中,第二鍵聯基團選自NR、O、-CH2-CH2-、-CHR'-CHR'-、-CR'R”'-CH2-、-CRR”'-CRR”'-和其組合。
具有經由由Rga與Rgb和/或Rab與Rac鍵結在一起形成的第二鍵聯基團系栓的式(2a)和(2b)的結構的化合物的實例包括(但不限于)以下展示的化合物(2-1)到(2-3)。
在另一方面,本發明提供了一種化合物,其具有結構式(3a):
其中A是第一鍵聯基團;L2和L3是鍵聯基團;R1a到R1f和R3a到R3f是任何適合取代基;并且R1f、R3a、R3c和R3d的任何組合任選地接合形成一或多個稠合環;其中L2與R1f和/或R3a任選地接合形成一個、兩個或更多個稠合環;其中L3與R3c和/或R3d任選地接合形成一個、兩個或更多個稠合環;并且R1b到R1f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在具有結構式(3a)的化合物的一些實施例中,第一鍵聯基團A具有2到3個鍵聯原子。在具有結構式(3a)的化合物的一些實施例中,第一鍵聯基團A具有2到3個鍵聯原子,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(3a)的化合物的一些實施例中,L2和L3獨立地選自由以下組成的群組:單鍵、BR、NR、PR、O、S、Se、C─O、S─O、SO2、CRR'、SiRR'、GeRR',其中每個R或R'是任何適合取代基。在具有結構式(3a)的化合物的一些實施例中,R1a到R1f和R3a到R3f、R和R'各自獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(3a)的化合物的一些實施例中,兩個相鄰R1f、R3a、R3c、R3d、R和R'任選地接合在一起形成稠合環。L2與R1f或L2與R3a或L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。L3與R3c或L3與R3d或L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R1f任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3d任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3c任選地接合形成一或多個稠合環。在一些實施例中,L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。
在具有結構式(3a)的化合物的一些實施例中,第一鍵聯基團A獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在一些實施例中,具有結構式(3a)的化合物具有三重態激發態。在一些實施例中,具有結構式(3a)的化合物具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A。在一些實施例中,具有結構式(3a)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(3a)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(3a)的化合物的峰值發射波長范圍介于400nm到500nm。
在具有結構式(3a)的化合物的一些實施例中,第一鍵聯基團A選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基或苯基。在具有結構式(3a)的化合物的一些實施例中,L3和L3獨立地選自由以下組成的群組:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR'、SiRR'和GeRR'。在具有結構式(3a)的化合物的一些實施例中,R1f或R3a與R或R'接合在一起形成稠合環。在具有結構式(3a)的化合物的一些實施例中,R3c或R3d與R或R'接合在一起形成稠合環。
具有式(3a)的結構的化合物的實例包括(但不限于)以下展示的化合物(3-1)到(3-6)。
III.有機金屬化合物
本發明提供了有機金屬化合物的若干實施例。在一些實施例中,所述化合物可以是發射摻雜劑。在一些實施例中,所述化合物可以經由磷光、熒光、熱激活延遲熒光(即TADF,也稱為E型延遲熒光)、三重態-三重態消滅或這些工藝的組合產生發射。
在一個方面,本發明提供了一種化合物,其具有結構式(1):
M是具有大于40的原子量的金屬,n具有至少1的值,并且m+n是可以與所述金屬連接的最大配位體數;A是任何適合鍵聯基團;R1a到R1g是任何適合取代基。R1b到R1g所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。
在一些實施例中,M表示選自周期表的7到11族過渡金屬的金屬。在一些實施例中,M表示選自釕、銠、鈀、銀、錸、鋨、銥、鉑和金的金屬。在一些優選實施例中,M表示銥(Ir),n是2或3;m是0或1;m+n是3。
在具有結構式(1)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團。在具有結構式(1)的化合物的一個實施例中,A是具有2到3個鍵聯原子的鍵聯基團,其中所述鍵聯原子各自獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成環。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成飽和環。在具有結構式(1)的化合物的一些實施例中,A是獨立地選自由以下組成的群組的鍵聯基團:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'與R”連接在一起形成飽和五元環或飽和六元環或其組合。
在一些優選實施例中,A是亞烷基。在一些實施例中,A是選自亞甲基、二亞甲基和三亞甲基的亞烷基。在一些優選實施例中,A獨立地選自由以下組成的群組:─CH2─Si(CH3)2─、─CH2─Si(Ph)2─、─CH2─Si(CH3)2─、─CH2─CH2─、─CH2─CH2─CH2─、─C(CH3)2─C(CH3)2─、─CH(CH3)─CH(CH3)─、─C(Ph)2─C(Ph)2─、─CH(Ph)─CH(Ph)─和─CH2─CH(Ph)2─。在一些優選實施例中,A選自:
在具有結構式(1)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中R是任何適合取代基。在具有結構式(1)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中每個R獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在具有結構式(1)的化合物的一個實施例中,R1a到R1g獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在一個實施例中,具有結構式(1)的化合物可以或可以不包含配位體(L)。在一個實施例中,具有結構式(1)的化合物包含配位體(L)。在一個實施例中,具有結構式(1)的化合物不包含配位體(L)。在一個實施例中,具有結構式(1)的化合物包含配位體(L),所述配位體是經取代或未經取代的環金屬化配位體。
在一些實施例中,具有結構式(1)的化合物具有三重態激發態。在具有結構式(1)的化合物的一些實施例中,當化合物處于三重態激發態時,鍵聯基團A使N2與C1b之間的鍵結穩定免于裂解。在一些實施例中,具有結構式(1)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(1)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(1)的化合物的峰值發射波長范圍介于400nm到500nm。
在具有結構式(1)的化合物的一些實施例中,鍵聯基團A選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基或苯基。
配位體L表示鍵結到金屬M的配位體。在一些實施例中,形成于配位體L與金屬M之間的鍵結是共價鍵、離子鍵或配位鍵。在一些實施例中,配位體L經由雜原子配位到金屬M。在一些實施例中,配位體L經由選自由以下組成的群組的雜原子配位到金屬M:氮、氧、硫和碳原子。在一些實施例中,配位體L經由選自由以下組成的群組的雜原子配位到金屬M:氮、氧和碳原子。
在一些實施例中,形成于配位體L與金屬M之間的鍵結可以是共價鍵、離子鍵或配位鍵。在一些實施例中,形成于配位體L與金屬M之間的鍵結是離子的。在一些實施例中,配位體L是陰離子配位體(即,以配位體的至少一個陰離子鍵結到金屬的配位體)。在一些實施例中,配位體L包含至少一個陰離子基團。在一些實施例中,配位體L包含1到3個陰離子。在一些實施例中,配位體L包含2個陰離子。在一些實施例中,配位體L包含1個陰離子。
在一些實施例中,鍵結經由碳原子形成于配位體L與金屬M之間。經由碳原子鍵結到金屬M的配位體的實例包括(但不限于)亞氨基配位體、芳香族碳環配位體(例如,基于苯、萘、蒽、菲的配位體)、雜環配位體(例如,基于噻吩、吡啶、吡嗪、嘧啶、噻唑、噁唑、吡咯、咪唑、吡唑的配位體和基于含有這些環的任何組合的縮合環的配位體)。
在一些實施例中,形成于配位體L與金屬M之間的鍵結是經由氮原子。經由氮原子鍵結到金屬M的配位體的實例包括(但不限于)含氮雜環配位體(例如,吡啶、吡嗪、嘧啶、噠嗪、三嗪、噻唑、噁唑、吡咯、咪唑、吡唑、三唑、噁二唑和噻二唑配位體,和具有雜環環的任何組合的縮合環)、烷氨基配位體(例如,四甲基乙二胺)、芳氨基配位體(例如,苯氨基)、酰氨基配位體(例如,乙酰氨基、苯甲酰氨基)、烷氧羰基氨基配位體(例如,甲氧羰基氨基)、芳氧羰基氨基配位體(例如,苯氧羰基氨基)、磺酰氨基配位體(例如,甲烷磺酰氨基、苯磺酰氨基)和亞氨基配位體。
在一些實施例中,形成于配位體L與金屬M之間的鍵結是經由氧原子。經由氧原子鍵結到金屬M的配位體的實例包括(但不限于)烷氧基配位體(例如,甲氧基、乙氧基、丁氧基、2-乙基己氧基)、芳氧基配位體(例如,苯氧基、1-萘氧基、2-萘氧基)、雜環氧基配位體(例如,吡啶氧基、吡唑氧基、嘧啶氧基、喹啉氧基)、酰氧基配位體(例如,乙酰氧基、苯甲酰氧基)、硅烷氧基配位體(例如,三甲基硅烷氧基、三苯基硅烷氧基)、羰基配位體(例如,酮配位體、酯配位體、酰胺配位體)和醚配位體(例如,二烷基醚配位體、二芳基醚配位體、呋喃基配位體)。
在一些實施例中,形成于配位體L與金屬M之間的鍵結是經由硫原子。經由硫原子鍵結到金屬M的配位體的實例包括(但不限于)烷硫基配位體(例如,甲硫基、乙硫基)、芳硫基配位體(例如,苯硫基)、雜環硫基配位體(例如,吡啶基硫基、2-苯并咪唑基硫基、2-苯并噁唑基硫基、2-苯并噻唑基硫基)、硫羰基配位體(例如,硫酮配位體、硫酯配位體)和硫醚配位體(例如,二烷基硫醚配位體、二芳基硫醚配位體、噻吩基配位體)。
在一些實施例中,配位體L優選是芳香族碳環配位體、烷氧基配位體、芳氧基配位體、醚配位體、烷硫基配位體、芳硫基配位體、烷氨基配位體、芳氨基配位體、酰氨基配位體和含氮雜環配位體(例如,吡啶、吡嗪、嘧啶、噠嗪、三嗪、噻唑、噁唑、吡咯、咪唑、吡唑、三唑、噁二唑和噻二唑配位體、基于喹啉、苯并噁唑、苯并咪唑的配位體)。在一些實施例中,配位體L更優選是芳香族碳環配位體、芳氧基配位體、芳硫基配位體、芳氨基配位體、吡啶配位體、吡嗪配位體、咪唑配位體、含有這些配位體中任一者的縮合配位體(例如,喹啉、喹喔啉、苯并咪唑配位體)。在一些優選實施例中,配位體L是芳香族碳環配位體、芳氧基配位體、芳硫基配位體或芳氨基配位體。
在一些實施例中,配位體L與金屬M形成配位鍵。與金屬M形成配位鍵的配位體L的實例包括(但不限于)吡啶環、吡嗪環、嘧啶環、三嗪環、噻唑環、噁唑環、吡咯環、三唑環、含有這些環中任一者的縮合環(例如,喹啉、苯并噁唑、苯并咪唑和假吲哚環)。
在一些實施例中,形成于配位體L之間的鍵結是單齒的。在一些實施例中,形成于配位體L之間的鍵結是二齒、三齒或四齒的。配位體L的其它實例包括(但不限于)鹵素配位體、1,3-二酮配位體(例如,乙酰基丙酮配位體)、含有吡啶配位體的單陰離子雙齒配體(例如,吡啶甲酸、2-(2-羥苯基)-吡啶配位體)。
在一些實施例中,R1a到R1g中的每一者獨立地表示氫原子或任何適合取代基。適合取代基的實例包括(但不限于)烷基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到10個碳原子,例如甲基、乙基、異丙基、叔丁基、正辛基、正癸基、正十六烷基、環丙基、環戊基、環己基)、烯基(優選具有2到30個碳原子、更優選具有2到20個碳原子并且尤其優選具有2到10個碳原子,例如乙烯基、烯丙基、2-丁烯基、3-戊烯基)、炔基(優選具有2到30個碳原子、更優選具有2到20個碳原子并且尤其優選具有2到10個碳原子,例如炔丙基、3-戊炔基)、芳基(優選具有6到30個碳原子、更優選具有6到20個碳原子并且尤其優選具有6到12個碳原子,例如苯基、對甲基苯基、萘基、蒽基)、氨基(優選具有0到30個碳原子、更優選具有0到個碳原子并且尤其優選具有0到10個碳原子,例如氨基、甲氨基、二甲氨基、二乙氨基、二苯甲基氨基、二苯氨基、二甲苯氨基)、烷氧基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到10個碳原子,例如甲氧基、乙氧基、丁氧基、2-乙基己氧基)、芳氧基(優選具有6到30個碳原子、更優選具有6到20個碳原子并且尤其優選具有6到12個碳原子,例如苯氧基、1-萘氧基、2-萘氧基)、雜環氧基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如吡啶氧基、吡唑氧基、嘧啶氧基、喹啉氧基)、酰基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如乙酰基、苯甲酰基、甲酰基、特戊酰基)、烷氧羰基(優選具有2到30個碳原子、更優選具有2到20個碳原子并且尤其優選具有2到12個碳原子,例如甲氧羰基、乙氧羰基)、芳氧羰基(優選具有7到30個碳原子、更優選具有7到20個碳原子并且尤其優選具有7到12個碳原子,例如苯氧羰基)、酰氧基(優選具有2到30個碳原子、更優選具有2到20個碳原子并且尤其優選具有2到10個碳原子,例如乙酰氧基、苯甲酰氧基)、酰氨基(優選具有2到30個碳原子、更優選具有2到20碳原子并且尤其優選具有2到10個碳原子,例如乙酰氨基、苯甲酰氨基)、烷氧羰基氨基(優選具有2到30個碳原子、更優選具有2到20個碳原子并且尤其優選具有2到12個碳原子,例如甲氧羰基氨基)、芳氧羰基氨基(優選具有7到30個碳原子、更優選具有7到20個碳原子并且尤其優選具有7到12個碳原子,例如苯氧羰基氨基)、磺酰氨基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如甲磺酰氨基、苯磺酰氨基)、氨磺酰基(優選具有0到30個碳原子、更優選具有0到20個碳原子并且尤其優選具有0到12個碳原子,例如氨磺酰基、甲基氨磺酰基、二甲基氨磺酰基、苯氨磺酰基)、氨甲酰基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如氨甲酰基、甲基氨甲酰基、二乙基氨甲酰基、苯氨甲酰基)、烷硫基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如甲硫基、乙硫基)、芳硫基(優選具有6到30個碳原子、更優選具有6到20個碳原子并且尤其優選具有6到12個碳原子,例如苯硫基)、雜環硫基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如吡啶基硫基、2-苯并咪唑基硫基、2-苯并噁唑基硫基、2-苯并噻唑基硫基)、磺酰基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如甲磺酰基、甲苯磺酰基)、亞磺酰基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如甲亞磺酰基、苯亞磺酰基)、脲基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如脲基、甲基脲基、苯基脲基)、磷酸酰氨基(優選具有1到30個碳原子、更優選具有1到20個碳原子并且尤其優選具有1到12個碳原子,例如二乙基磷酰氨基、苯基磷酰氨基)、羥基、巰基、鹵素原子(例如,氟、氯、溴、碘)、氰基、磺基、羧基、硝基、異羥肟酸基、亞磺酸基、肼基、亞氨基、雜環基(優選具有1到30個碳原子、更優選具有1到12個碳原子并且含有例如氮、氧和硫的雜原子,具體例如咪唑基、吡啶基、喹啉基、呋喃基、噻吩基、哌啶基、嗎啉基、苯并噁唑基、苯并咪唑基、苯并噻唑基、咔唑基、氮呯基)、硅烷基(優選具有3到40個碳原子、更優選具有3到30個碳原子并且尤其優選具有3到24個碳原子,例如三甲基硅烷基、三苯基硅烷基)和硅烷氧基(優選具有3到40個碳原子、更優選具有3到30個碳原子并且尤其優選具有3到24個碳原子,例如三甲基硅烷氧基、三苯基硅烷氧基)。在一些實施例中,這些取代基中任一者可以進一步經另一取代基取代。
具有式(1)的結構的化合物的特定實例包括(但不限于)以下展示的化合物1-98。
在一些方面,根據本發明的化合物具有結構式(2):
其中M是任何適合金屬;其中A1和A2各自是第一鍵聯基團;R1b到R1f和R2b到R2f是任何適合取代基;并且Rab與Rac或Rga與Rgb是可以鍵結在一起形成第二鍵聯基團的取代基;除非本文中另外具體提到或從上下文顯而易見,否則R1b到R1f中的每一者具有如上文關于結構式(1)中的R1b到R1f所定義的相同含義;除非本文中另外具體提到或從上下文顯而易見,否則R2b到R2f中的每一者具有如上文關于結構式(1)中的R1b到R1f所定義的相同含義;R1b到R1f和R2b到R2f中的每一者具有獨立地選自用于結構式(1)中的R1b到R1f的選項的值。R1b到R1f和R2b到R2f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。在具有結構式(2)的化合物的一些實施例中,R1b到R1f和R2b到R2f獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基,其中R是任何適合基團,包括H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。除非本文中另外具體提到或從上下文顯而易見,否則M具有與結構式(1)中的M相同的含義。在結構式(2)的化合物的一些優選實施例中,M是鉑(Pt)。
在式(2)的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子。在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2包含2到3個鍵聯原子,所述鍵聯原子中的每一者獨立地選自由以下組成的群組:C、Si、O、S、N、B或其組合。在一些實施例中,A1與A2不同。在一些其它實施例中,A1與A2相同。
在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。
在具有結構式(2)的化合物的一些實施例中,每個第一鍵聯基團A1和A2選自-CH2-CH2-、-CH2-CH2-CH2-、-CHR'-CHR”-、-CR'R”-CH2-、-CR'R”-CR'R”-、-CH2-CH2-CH2-、-CH2-S-、-S-CH2-、-O-SiR'R”-、-SiR'R”-O-,其中R'和R”獨立地是甲基或苯基。
在結構式(2)的化合物的一些實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有1到3個鍵聯原子的第二鍵聯基團,所述鍵聯原子各自獨立地選自由以下組成的群組:B、N、P、O、S、Se、C、Si、Ge或其組合。在具有結構式(2)的化合物的一些實施例中,Rab與Rac和/或Rga與Rgb鍵結在一起形成獨立地選自由以下組成的群組的第二鍵聯基團:BR、NR、PR、O、S、Se、C=O、S=O、SO2、CRR”'、-CRR”'-CRR”'-、SiRR”'和GeRR”',其中每個R或R”'是任何適合基團。在一些此類實施例中,每個R或R”'獨立地選自H、鹵基、烷基、烯基、炔基、雜烷基、芳烷基、芳基和雜芳基。在具有結構式(2)的化合物的一些其它實施例中,Rab與Rac和/或Rga與Rgb可以鍵結在一起形成具有至少兩個鍵聯原子的第二鍵聯基團,其獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”是任何適合取代基。例示性第二鍵聯基團包括:
其中每個R獨立地選自H、甲基或苯基。
在一些實施例中,具有結構式(2)的化合物具有三重態激發態。在一些實施例中,具有結構式(2)的化合物具有三重態激發態以及當化合物處于三重態激發態時使N2與C1b之間的鍵結穩定免于裂解的鍵聯基團A。在一些實施例中,具有結構式(2)的化合物的峰值發射波長小于500nm。在一些實施例中,具有結構式(2)的化合物的峰值發射波長小于480nm。在一些實施例中,具有結構式(2)的化合物的峰值發射波長范圍介于400nm到500nm。具有式(1)的結構的化合物的特定實例包括(但不限于)以下展示的化合物99和100。
在一些方面,根據本發明的化合物具有以下結構式(3):
其中M是任何適合金屬;A是第一鍵聯基團;R1a到R1f和R3a到R3g是任何適合取代基;L2和L3是鍵聯基團;相鄰R1f、R3a、R3c和R3d可以接合在一起形成一或多個稠合環;其中L2與R1f和/或R3a任選地接合形成一個、兩個或更多個稠合環;其中L3與R3c和/或R3d任選地接合形成一個、兩個或更多個稠合環;并且R1b到R1f和R2b到R2f所連接的環原子中的任一者可以經氮原子置換,其中當所述環原子經氮原子置換時,所述相應R基團不存在。L2與R1f或L2與R3a或L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。L3與R3c或L3與R3d或L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R1f任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L2與R3a和R1f兩者任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3d任選地接合形成一個、兩個或更多個稠合環。在一些實施例中,L3與R3c任選地接合形成一或多個稠合環。在一些實施例中,L3與R3c和R3d兩者任選地接合形成一個、兩個或更多個稠合環。
除非本文中另外具體提到或從上下文顯而易見,否則M具有與結構式(1)中的M相同的含義。在結構式(2)的化合物的一些優選實施例中,M是鉑(Pt)。在具有結構式(3)的化合物的一些優選實施例中,R1a到R1f和R3a到R3f、R和R'各自獨立地選自氫、烷基、烯基、炔基、芳烷基、CN、CF3、CO2R、C(O)R、C(O)NR2、NR2、NO2、OR、SR、SO2、SOR、SO3R、鹵基、芳基、雜芳基、經取代芳基、經取代雜芳基或雜環基。在具有結構式(3)的化合物的一些優選實施例中,兩個相鄰R1f、R3a、R3c、R3d、R和R'可以接合在一起形成稠合環。在具有結構式(3)的化合物的一些優選實施例中,第一鍵聯基團A獨立地選自由以下組成的群組:-CR'R”-CR'R”-、-CR'R”-CR'R”-CR'R”-、-CR'R”-NR”-、-CR'=CR'-CR'R”-、-O-SiR'R”-、-CR'R”-S-、-CR'R”-O-、-C-SiR'R”-,其中R'和R”獨立地是H、具有1到6個碳原子的烷基、苯基和經取代苯基,或其中R'和R”連接在一起形成飽和五元環或飽和六元環和其組合。在具有結構式(3)的化合物的一些實施例中,L2和L3獨立地選自由以下組成的群組:單鍵、BR、NR、PR、O、S、Se、C─O、S─O、SO2、CRR'、SiRR'和GeRR'。
具有式(1)的結構的化合物的特定實例包括(但不限于)以下展示的化合物101到109。
根據本發明的各種實施例的金屬絡合物可以展現多種所要特征。在一些實施例中,具有結構式(1)-(3)的金屬絡合物可以展現高量子效率下、窄光譜寬度下和/或位于所要波長范圍(例如可見范圍或近紅外范圍)內的峰值發射波長下的光致發光。此外,這些光致發光特征可以在廣泛范圍的激發波長內相對恒定。在一些實施例中,具有結構式(1)-(3)的金屬絡合物可以具有其它所要特征,例如關于其帶隙能量和電導率。此外,有利地,具有結構式(1)-(3)的金屬絡合物可以以低成本并且容易地由市售可得起始物質合成。
在一些實施例中,具有式(1)、(2)或(3)的結構的金屬絡合物的峰值發射波長小于500nm。在一些實施例中,具有式(1)、(2)或(3)的結構的金屬絡合物的峰值發射波長小于480nm。在一些實施例中,具有式(1)、(2)或(3)的結構的金屬絡合物的峰值發射波長是400nm到500nm,包括400nm和500nm。
在一些實施例中,具有結構式(1)、(2)或(3)的金屬絡合物具有三重態激發態以及當所述化合物處于所述三重態激發態時,以下展示的使N2與C1b之間的鍵結穩定免于裂解的所述鍵聯基團A。
因此,在一些實施例中,具有結構式(1)、(2)或(3)的金屬絡合物是磷光發光物質。在一些實施例中,具有結構式(1)、(2)或(3)的金屬絡合物是熒光發光物質。在一些實施例中,具有結構式(1)、(2)或(3)的金屬絡合物是熒光和磷光發光物質兩者。
具有結構式(1)-(3)的金屬絡合物適用于例如有機發光二極管(OLED),其利用材料當其通過電流激發時發射光的傾向。因此,在一些方面,本發明提供了一種有機發光材料,其包含至少一種具有結構式(1)、(2)或(3)的金屬絡合物。在一些實施例中,本發明提供了一種有機發光材料,其包含至少兩種選自具有結構式(1)、(2)或(3)的化合物的金屬絡合物。
根據本發明的各種實施例的有機發光材料可以展現多種所要特征。在一些實施例中,所述有機發光材料可以展現高量子效率下、窄光譜寬度下和位于所要波長范圍(例如可見范圍或近紅外范圍)內的峰值發射波長下的光致發光。此外,這些光致發光特征可以在廣泛范圍的激發波長內相對恒定。所述有機發光材料可以具有其它所要特征,例如關于其帶隙能量和電導率。有利地,所述有機發光材料可以以低成本并且容易地形成用于各種應用,包括消費型產品和照明面板。
在一些實施例中,相對于包含發光材料的發光層的總質量,根據本發明的發光材料中的光致發光物質(例如,具有結構式(1)、(2)或(3)的金屬絡合物)的含量在0.1質量%到50質量%之間(包括0.1質量%和50質量%)。在一些實施例中,相對于包含發光材料的發光層的總質量,根據本發明的發光材料中的光致發光物質的含量在0.3質量%到40質量%之間(包括0.3質量%和40質量%)。在一些實施例中,相對于包含發光材料的發光層的總質量,根據本發明的發光材料中的光致發光物質的含量在0.5質量%到30質量%之間(包括0.5質量%和30質量%)。
IV.裝置
在一些方面,本發明提供了一種有機電致發光裝置,其包含至少一種具有結構式(1)、(2)或(3)的金屬絡合物。在一些實施例中,根據本發明的有機電致發光裝置包含第一有機發光裝置,所述第一有機發光裝置進一步包含陽極;陰極;有機層,其安置在所述陽極與所述陰極之間,并且包含至少一種具有結構式(1)、(2)或(3)的金屬絡合物。在有機電致發光裝置的一些優選實施例中,所述有機層進一步包含主體材料。在有機電致發光裝置的一些優選實施例中,所述主體材料包含有機化合物。在有機電致發光裝置的一些優選實施例中,所述主體材料包含具有含有至少一個選自由以下組成的群組的基團的分子的有機化合物:咔唑、二苯并噻吩、二苯并呋喃、氮雜咔唑、氮雜-二苯并噻吩和氮雜-二苯并呋喃。
一般來說,適用于本發明的有機電致發光裝置的有機層可以取決于例如所述有機電致發光裝置的應用和目的而具有任何適合層配置。因此,在有機電致發光裝置的一些實施例中,所述有機層在透明電極或半透明電極上形成。在一些此類實施例中,所述有機層在所述透明電極或所述半透明電極的前表面或任何適合表面上形成。此外,所述有機層的適合形狀、大小和/或厚度可以取決于例如所述有機電致發光裝置的應用和目的而利用。具有襯底、陰極、陽極和有機層的本發明有機電致發光裝置的配置的特定實例包括(但不限于)以下:
(A)陽極/空穴輸送層/發光層/電子輸送層/陰極;
(B)陽極/空穴輸送層/發光層/阻擋層/電子輸送層/陰極;
(C)陽極/空穴輸送層/發光層/阻擋層/電子輸送層/電子注入層/陰極;
(D)陽極/空穴注入層/空穴輸送層/發光層/阻擋層/電子輸送層/陰極;和
(E)陽極/空穴注入層/空穴輸送層/發光層/阻擋層/電子輸送層/電子注入層/陰極。
包括有機電致發光裝置的襯底、陰極和陽極的其它裝置配置描述于日本專利公開案第2008-270736號中。
<襯底>
可用于本發明的有機電致發光裝置的適合襯底優選是不散射或減少從有機層發射的光的襯底。在一些實施例中,所述襯底優選由展現優越耐熱性、尺寸穩定性、耐溶劑性、電絕緣性質和/或可加工性的有機材料組成。
適用于本發明的襯底優選是不散射或減弱從有機化合物層發射的光的襯底。用于襯底的材料的特定實例包括(但不限于)無機材料,例如氧化鋯穩定釔(YSZ)和玻璃;聚酯,例如聚對苯二甲酸乙二醇酯、聚鄰苯二甲酸丁二醇酯和聚萘二甲酸乙二醇酯;和有機材料,例如聚苯乙烯、聚碳酸酯、聚醚砜、聚芳酯、聚酰亞胺、聚環烯烴、降冰片烯樹脂、聚氯三氟乙烯等。
在一些實施例中,當玻璃用作襯底時,優選使用無堿玻璃。適合無堿玻璃的特定實例見于川口貴廣(Takahiro Kawaguchi)的在2013年9月12日出版的美國專利申請公開案第2013/0237401號中。在一些實施例中,當堿石灰玻璃用作襯底時,優選的是使用在上面已經涂覆了二氧化硅屏障涂層等的玻璃。在一些實施例中,當有機材料用作襯底時,優選的是使用具有以下屬性中的一或多者的材料:極佳的耐熱性、尺寸穩定性、耐溶劑性、電絕緣性能和可加工性。
一般來說,關于襯底的形狀、結構、大小等不存在特定限制,但這些屬性中的任一者可以根據發光元件的應用、目的等適合地選擇。一般來說,板樣襯底作為襯底的形狀是優選的。襯底的結構可以是單層結構或層合結構。此外,襯底可以由單一成員或兩種或更多種成員形成。
盡管襯底可以是透明并且無色的或透明并且有色的,但從襯底不散射或減弱從有機發光層發射的光的觀點來看,襯底優選是透明并且無色的。在一些實施例中,濕氣滲透預防層(氣體阻擋層)可以提供于襯底的前表面或背表面上。濕氣滲透預防層(氣體阻擋層)的材料的實例包括(但不限于)無機物質,例如氮化硅和氧化硅。濕氣滲透預防層(氣體阻擋層)可以根據例如高頻濺鍍法等形成。
在應用熱塑性襯底的情況下,可以按需要進一步提供硬涂層層或涂層下的層。
<陽極>
任何陽極都可以用于本發明的有機電致發光裝置,只要其充當向有機層中供應空穴的電極。在本發明的有機電致發光裝置的一些實施例中,可以取決于例如有機電致發光裝置的應用和目的而使用已知電極材料的任何適合形狀、結構和/或大小。在一些實施例中,透明陽極是優選的。
陽極通常可以是任何材料,只要其具有作為用于向有機化合物層供應空穴的電極的功能,并且關于形狀、結構、大小等不存在特定限制。然而,其可以根據發光元件的應用和目的適合地選自熟知電極材料之中。在一些實施例中,陽極以透明陽極形式提供。
陽極的材料優選包括例如金屬、合金、金屬氧化物、導電化合物和其混合物。功函數為4.0eV或更大的材料是優選的。陽極材料的特定實例包括導電金屬氧化物,例如摻雜有銻、氟等的錫氧化物(ATO和FTO)、氧化錫、氧化鋅、氧化銦、氧化銦錫(ITO)和氧化銦鋅(IZO);金屬,例如金、銀、鉻和鎳;這些金屬和導電金屬氧化物的混合物或層合物;無機導電材料,例如碘化銅和硫化銅;有機導電材料,例如聚苯胺、聚噻吩和聚吡咯;和這些無機或有機導電材料與ITO的層合物。其中,鑒于生產率、高導電性、透明度等,導電金屬氧化物是優選的,并且尤其,ITO是優選的。
考慮材料構成陽極的適合性,陽極可以根據適當地選自以下的方法在襯底上形成:濕式方法,例如印刷法、涂布法等;物理方法,例如真空沉積法、濺鍍法、離子電鍍法等;和化學方法,例如CVD(化學氣相沉積)和等離子體CVD法等。舉例來說,當ITO經選擇作為陽極的材料時,陽極可以根據DC或高頻濺鍍法、真空沉積法、離子電鍍法等形成。
在本發明的有機電致發光元件中,待形成陽極的位置不受特別限制,但其可以根據發光元件的應用和目的適合地選擇。陽極可以在襯底的任一側上的整個表面或一部分表面上形成。
為了圖案化以形成陽極,可以應用化學蝕刻法(例如光刻法)、物理蝕刻法(例如通過激光蝕刻)、通過疊加掩模的真空沉積或濺鍍法、或剝離法或印刷法。
陽極的厚度可以根據構成陽極的材料適合地選擇,并且因此無法明確地確定,但其通常在10nm到50μm并且優選50nm到20μm范圍內。陽極層的厚度可以取決于用于其的材料而恰當地控制。陽極的電阻優選是103Ω/平方或更小,并且更優選是102Ω/平方或更小。在陽極透明的情況下,其可以是透明并且無色的,或透明并且有色的。為了從透明陽極側提取發光,優選的是陽極的透光率是60%或更大,并且更優選是70%或更大。透明陽極的詳細描述可以見于C.M.C.在1999年出版的由澤田豐(Yutaka Sawada)編輯的“TOUMEI DENNKYOKU-MAKU NO SHINTENKAI(透明電極薄膜的新穎開發(Novel Developments in Transparent Electrode Films))”中。
在具有低耐熱性的塑料襯底用于本發明的情況下,優選的是ITO或IZO用以獲得通過在150℃或更低的低溫下形成薄膜而制備的透明陽極。
<陰極>
任何陰極都可以用于本發明的有機電致發光裝置,只要其充當向有機層中供應電子的電極。在本發明的有機電致發光裝置的一些實施例中,可以取決于例如有機電致發光裝置的應用和目的而使用已知電極材料的任何適合形狀、結構和/或大小。在一些實施例中,透明陰極是優選的。
陰極通常可以是任何材料,只要其具有作為用于向有機化合物層注入電子的電極的功能,并且關于形狀、結構、大小等不存在特定限制。然而,其可以根據發光元件的應用和目的適合地選自熟知電極材料之中。
構成陰極的材料包括例如金屬、合金、金屬氧化物、導電化合物和其混合物。功函數為4.0eV或更大的材料是優選的。其特定實例包括堿金屬(例如,Li、Na、K、Cs等)、堿土金屬(例如,Mg、Ca等)、金、銀、鉛、鋁、鈉-鉀合金、鋰-鋁合金、鎂-銀合金、稀土金屬(例如銦和鐿)等。其可以單獨使用,但從滿足穩定性和電子可注入性兩者的觀點來看,優選的是其中的兩者或更多者組合使用。
在一些實施例中,鑒于電子可注入性,作為構成陰極的材料,堿金屬或堿土金屬是優選的,并且鑒于極佳防腐穩定性,含有鋁作為主要組分的材料是優選的。
術語“含有鋁作為主要組分的材料”是指單獨由鋁構成的材料;包含鋁和0.01重量%到10重量%堿金屬或堿土金屬的合金;或其混合物(例如,鋰-鋁合金、鎂-鋁合金等)。例示性陰極材料詳細地描述于JP-A第2-15595號和第5-121172號中。
形成陰極的方法不受特別限制,但其可以根據熟知方法形成。舉例來說,考慮材料構成陰極的適合性,陰極可以根據適當地選自以下的方法形成:濕式方法,例如印刷法、涂布法等;物理方法,例如真空沉積法、濺鍍法、離子電鍍法等;和化學方法,例如CVD和等離子體CVD法等。舉例來說,當(一或多種)金屬經選擇作為(一或多種)陰極的材料時,其中的一或兩者或更多者可以根據濺鍍法等同時或依序應用。
為了圖案化以形成陰極,可以應用化學蝕刻法(例如光刻法)、物理蝕刻法(例如通過激光蝕刻)、通過疊加掩模的真空沉積或濺鍍法、或剝離法或印刷法。
在本發明中,待形成陰極的位置不受特別限制,但其可以在整個或一部分有機化合物層上形成。
此外,由堿金屬或堿土金屬的氟化物、氧化物等制成的介電材料層可以按0.1nm到5nm的厚度插入陰極與有機化合物層之間。介電材料層可以被視為一類電子注入層。介電材料層可以根據例如真空沉積法、濺鍍法、離子電鍍法等形成。
陰極的厚度可以根據構成陰極的材料適合地選擇,并且因此無法明確地確定,但其通常在10nm到5μm并且優選50nm到1μm范圍內。
此外,陰極可以是透明或不透明的。透明陰極可以通過以下方式形成:制備具有1nm到10nm的小厚度的陰極材料,并且進一步使透明導電材料(例如ITO或IZO)層合到其上。
<保護層>
本發明的有機EL元件的全身可以通過保護層保護。任何材料都可以應用于保護層,只要材料具有防止會加速元件的磨損的成分(例如濕氣、氧氣等)滲透到元件中的功能。保護層的材料的特定實例包括金屬,例如In、Sn、Pb、Au、Cu、Ag、Al、Ti、Ni等;金屬氧化物,例如MgO、SiO、SiO2、Al2O3、GeO、NiO、CaO、BaO、Fe2O3、Y2O3、TiO2等;金屬氮化物,例如SiNx、SiNxOy等;金屬氟化物,例如MgF2、LiF、AlF3、CaF2等;聚乙烯;聚丙烯;聚甲基丙烯酸甲酯;聚酰亞胺;聚脲;聚四氟乙烯;聚氯三氟乙烯;聚二氯二氟乙烯;氯三氟乙烯與二氯二氟乙烯的共聚物;通過使含有四氟乙烯與至少一種共聚單體的單體混合物共聚獲得的共聚物;各自在共聚主鏈中具有環狀結構的含氟共聚物;各自具有1%或更大的吸水系數的吸水材料;各自具有0.1%或更小的吸水系數的濕氣滲透預防物質;等。
關于形成保護層的方法不存在特定限制。舉例來說,可以應用真空沉積法、濺鍍法、反應性濺鍍法、MBE(分子束外延)法、團簇離子束法、離子電鍍法、等離子體聚合法(高頻激發離子電鍍法)、等離子體CVD法、激光CVD法、熱CVD法、氣體源CVD法、涂布法、印刷法或轉移法。
<密封>
本發明的整個有機電致發光元件可以用密封蓋密封。此外,吸濕劑或惰性液體可以用以密封密封蓋與發光元件之間所界定的空間。盡管吸濕劑不受特別限制,但其特定實例包括氧化鋇、氧化鈉、氧化鉀、氧化鈣、硫酸鈉、硫酸鈣、硫酸鎂、五氧化二磷、氯化鈣、氯化鎂、氯化銅、氟化銫、氟化鈮、溴化鈣、溴化釩、分子篩、沸石、氧化鎂等。盡管惰性液體不受特別限制,但其特定實例包括石蠟;液體石蠟;基于氟的溶劑,例如全氟烷烴、全氟胺、全氟醚等;基于氯的溶劑;硅酮油;等。
<驅動>
在本發明的有機電致發光元件中,當DC(按需要可以含有AC組分)電壓(通常2伏特到15伏特)或DC施加到陽極和陰極上時,可以獲得發光。對于本發明的有機電致發光元件的驅動方法,JP-A第2-148687號、第6-301355號、第5-29080號、第7-134558號、第8-234685號和第8-241047號;日本專利第2784615號、美國專利第5,828,429號和第6,023,308號中描述的驅動方法是可適用的。
<應用>
根據本文所述的本發明的實施例制造的裝置可以并入到各種各樣的消費型產品中,所述消費型產品包括(但不限于)平板顯示器、計算機監視器、電視機、告示牌、用于內部或外部照明和/或發信號的燈、平視顯示器、全透明顯示器、柔性顯示器、激光印刷機、電話、手機、個人數字助理(PDA)、膝上型計算機、數碼相機、攝錄像機、取景器、微型顯示器、交通工具、大面積墻壁、劇院或體育館屏幕,或指示牌。
<有機層>
適用于本發明的有機電致發光裝置的有機層可以包含多個層,包括例如發光層、主體材料、電荷輸送層、空穴注入層和空穴輸送層。在本發明的有機電致發光裝置的一些實施例中,每個有機層可以通過以下方法形成:干式成膜法,例如沉積法或濺鍍法;或溶液涂布工藝,例如轉移法、印刷法、旋涂法或棒涂法。在本發明的有機電致發光裝置的一些實施例中,有機層的至少一個層優選通過溶液涂布工藝形成。
A.發光層
發光材料:
根據本發明的發光材料優選包括至少一種具有結構式(1)、(2)或(3)的金屬絡合物。相對于構成發光層的化合物的總質量,本發明的有機電致發光裝置的一些實施例包含約0.1質量%到約50質量%的量的發光材料。在一些實施例中,相對于構成發光層的化合物的總質量,本發明的有機電致發光裝置包含約1質量%到約50質量%的量的發光材料。在一些實施例中,相對于構成發光層的化合物的總質量,本發明的有機電致發光裝置包含約2質量%到約40質量%的量的發光材料。在一些實施例中,相對于發光層中所含有的化合物的全部量,發光層中的發光材料的總量優選是約0.1重量%到約30重量%。在一些實施例中,鑒于耐久性和外部量子效率,發光層中的發光材料的總量優選是約1重量%到約20重量%。在一些實施例中,發光層中的主體材料的總量優選是約70重量%到約99.9重量%。在一些實施例中,鑒于耐久性和外部量子效率,發光層中的主體材料的總量優選是約80重量%到99重量%。
在一些實施例中,本發明中的發光層可以包括發光材料和發光層中所含有的主體材料,其呈通過單重態激子發光(熒光)的熒光發射材料與主體材料的組合,或通過三重態激子發光(磷光)的磷光發光材料與主體材料的組合。在一些實施例中,本發明中的發光層可以包括發光材料和發光層中所含有的主體材料,其呈磷光發光材料與主體材料的組合。
B.主體材料
適用于本發明的主體材料可以是空穴輸送主體材料(有時稱為空穴輸送主體)和/或電子輸送主體材料(有時稱為電子輸送主體)。
空穴輸送主體材料
空穴輸送主體材料的特定實例包括(但不限于)吡咯、咔唑、氮雜咔唑、吡唑、吲哚、氮雜吲哚、咪唑、聚芳基烷、吡唑啉、吡唑啉酮、苯二胺、芳胺、氨基取代的查耳酮、苯乙烯基蒽、芴酮、腙、芪、硅氮烷、芳香族叔胺化合物、苯乙烯胺化合物、芳香族二亞甲基化合物、卟啉化合物、聚硅烷化合物、聚(N-乙烯咔唑)、苯胺共聚物、導電高分子寡聚物(例如噻吩寡聚物、聚噻吩等)、有機硅烷、碳薄膜、其衍生物等。一些優選的主體材料包括咔唑衍生物、吲哚衍生物、咪唑衍生物、芳香族叔胺化合物和噻吩衍生物。
電子輸送主體材料的特定實例包括(但不限于)吡啶、嘧啶、三嗪、咪唑、吡唑、三唑、噁唑、噁二唑、芴酮、蒽醌二甲烷、蒽酮、二苯醌、噻喃二氧化物、碳化二亞胺、亞芴基甲烷、二苯乙烯吡嗪、氟取代的芳香族化合物、萘、苝等的芳香環四羧酸酐、酞菁、其衍生物,包括多種由8-喹啉醇衍生物的金屬絡合物、金屬酞菁和具有苯并噁唑或苯并噻唑作為配位體的金屬絡合物表示的金屬絡合物。
優選的電子輸送主體是金屬絡合物、唑衍生物(苯并咪唑衍生物、咪唑并吡啶衍生物等)和吖嗪衍生物(吡啶衍生物、嘧啶衍生物、三嗪衍生物等)。
作為上文所述的空穴輸送主體材料的特定實例,列出以下化合物,但本發明不限于此。
C.薄膜厚度
在一些實施例中,發光層的薄膜厚度優選是約10nm到約500nm。在一些實施例中,取決于例如所要亮度均勻性、驅動電壓和亮度,發光層的薄膜厚度優選是約20nm到約100nm。在一些實施例中,發光層經配置成具有最佳化電荷從發光層通過到相鄰層而不降低發光效率的厚度。在一些實施例中,發光層經配置成具有維持最小驅動電壓最大發光效率的厚度。
D.層配置
發光層可以由單一層或兩個或更多個層組成,并且相應層可以產生不同發光色彩的發光。此外,在發光層具有層合結構的情況下,盡管配置層合結構的每個層的薄膜厚度不受特別限制,但優選每個發光層的總薄膜厚度屬于前述范圍內。
E.空穴注入層和空穴輸送層
空穴注入層和空穴輸送層是作用以接收來自陽極或陽極側的空穴和將空穴輸送到陰極側的層。待引入空穴注入層或空穴輸送層中的材料不受特別限制,但可以使用低分子化合物或高分子化合物中的任一者。
空穴注入層和空穴輸送層中所含有的材料的特定實例包括(但不限于)吡咯衍生物、咔唑衍生物、氮雜咔唑衍生物、吲哚衍生物、氮雜吲哚衍生物、咪唑衍生物、聚芳基烷衍生物、吡唑啉衍生物、吡唑啉酮衍生物、苯二胺衍生物、芳胺衍生物、氨基取代的查耳酮衍生物、苯乙烯基蒽衍生物、芴酮衍生物、腙衍生物、芪衍生物、硅氮烷衍生物、芳香族叔胺化合物、苯乙烯胺化合物、芳香族二亞甲基化合物、酞菁化合物、卟啉化合物、有機硅烷衍生物、碳等。
受電子摻雜劑可以引入本發明的有機EL元件中的空穴注入層或空穴輸送層中。作為待引入空穴注入層或空穴輸送層中的受電子摻雜劑,可以使用無機化合物或有機化合物中的任一者,只要化合物具有受電子性質和氧化有機化合物的功能。
具體來說,無機化合物包括金屬鹵化物,例如氯化鐵、氯化鋁、氯化鎵、氯化銦、五氯化銻等,和金屬氧化物,例如五氧化二釩、三氧化鉬等。
在采用有機化合物的情況下,優選可以應用具有取代基的化合物,所述取代基例如硝基、鹵素、氰基、三氟甲基等;醌化合物;酸酐化合物;富勒烯;等。
空穴注入和空穴輸送材料的特定實例包括例如以下的專利文件中描述的化合物:JP-A第6-212153號、第11-111463號、第11-251067號、第2000-196140號、第2000-286054號、第2000-315580號、第2001-102175號、第2001-160493號、第2002-252085號、第2002-56985號、第2003-157981號、第2003-217862號、第2003-229278號、第2004-342614號、第2005-72012號、第2005-166637號、第2005-209643號等。
空穴注入和空穴輸送材料的特定實例包括有機化合物:六氰基丁二烯、六氰基苯、四氰基乙烯、四氰基對醌二甲烷、四氟四氰基對醌二甲烷、對四氟醌、對四氯醌、對四溴醌、對苯醌、2,6-二氯苯醌、2,5-二氯苯醌、1,2,4,5-四氰基苯、1,4-二氰基四氟苯、2,3-二氯-5,6-二氰基苯醌、對二硝基苯、間二硝基苯、鄰二硝基苯、1,4-萘醌、2,3-二氯萘醌、1,3-二硝基萘、1,5-二硝基萘、9,10-蒽醌、1,3,6,8-四硝基咔唑、2,4,7-三硝基-9-芴酮、2,3,5,6-四氰基吡啶和富勒烯C60。其中,六氰基丁二烯、六氰基苯、四氰基乙烯、四氰基對醌二甲烷、四氟四氰基對醌二甲烷、對四氟醌、對四氯醌、對四溴醌、2,6-二氯苯醌、2,5-二氯苯醌、2,3-二氯萘醌、1,2,4,5-四氰基苯、2,3-二氯-5,6-二氰基苯醌和2,3,5,6-四氰基吡啶是更優選的,并且四氟四氰基對醌二甲烷。
由于一或多種受電子摻雜劑可以引入本發明的有機EL元件中的空穴注入層或空穴輸送層中,所以這些受電子摻雜劑可以單獨或以兩者或更多者的組合使用。盡管所用的這些受電子摻雜劑的確切量將取決于材料的類型,但空穴輸送層或空穴注入層的總重量的約0.01重量%到約50重量%是優選的。在一些實施例中,這些受電子摻雜劑的量在空穴輸送層或空穴注入層的總重量的約0.05重量%到約20重量%范圍內。在一些實施例中,這些受電子摻雜劑的量在空穴輸送層或空穴注入層的總重量的約0.1重量%到約10重量%范圍內。
在一些實施例中,鑒于降低驅動電壓,空穴注入層的厚度和空穴輸送層的厚度各自優選是約500nm或更小。在一些實施例中,空穴輸送層的厚度優選是約1nm到約500nm。在一些實施例中,空穴輸送層的厚度優選是約5nm到約50nm。在一些實施例中,空穴輸送層的厚度優選是約10nm到約40nm。在一些實施例中,空穴注入層的厚度優選是約0.1nm到約500nm。在一些實施例中,空穴注入層的厚度優選是約0.5nm到約300nm。在一些實施例中,空穴注入層的厚度優選是約1nm到約200nm。
空穴注入層和空穴輸送層可以由包含一或兩種或更多種上文所提及的材料的單層結構;或由多個具有均勻組成或非均勻組成的層組成的多層結構組成。
F.電子注入層和電子輸送層
電子注入層和電子輸送層是具有從陰極或陰極側接收電子和將電子輸送到陽極側的功能的層。用于這些層的電子注入材料或電子輸送材料可以是低分子化合物或高分子化合物。適用于電子注入和電子輸送層的材料的特定實例包括(但不限于)吡啶衍生物、喹啉衍生物、嘧啶衍生物、吡嗪衍生物、酞嗪衍生物、菲咯啉衍生物、三嗪衍生物、三唑衍生物、噁唑衍生物、噁二唑衍生物、咪唑衍生物、芴酮衍生物、蒽醌二甲烷衍生物、蒽酮衍生物、二苯醌衍生物、噻喃二氧化物衍生物、碳化二亞胺衍生物、亞芴基甲烷衍生物、二苯乙烯吡嗪衍生物、苝、萘等的芳香環四羧酸酐、酞菁衍生物、由8-喹啉醇衍生物的金屬絡合物、金屬酞菁和含有苯并噁唑或苯并噻唑作為配位體的金屬絡合物表示的金屬絡合物、由硅咯(Silole)例示的有機硅烷衍生物等。
電子注入層或電子輸送層可以含有供電子摻雜劑。適用于電子注入層或電子輸送層的供電子摻雜劑包括可以使用的任何適合材料,只要其具有供電子性質以及還原有機化合物的性質。供電子摻雜劑的特定實例包括堿金屬,例如Li;堿土金屬,例如Mg;過渡金屬,包括稀土金屬;和還原性有機化合物。供金屬摻雜劑的其它實例包括功函數為4.2V或更小的金屬,例如Li、Na、K、Be、Mg、Ca、Sr、Ba、Y、Cs、La、Sm、Gd、Yb等。還原性有機化合物的特定實例包括含氮化合物、含硫化合物、含磷化合物等。
供電子摻雜劑可以單獨或以兩者或更多者的組合使用。在一些實施例中,供電子摻雜劑以范圍介于電子輸送層材料或電子注入層材料的總重量的約0.1重量%到約99重量%的量含于電子注入層或電子輸送層中。在一些實施例中,供電子摻雜劑以范圍介于電子輸送層材料或電子注入層材料的總重量的約1.0重量%到約80重量%的量含于電子注入層或電子輸送層中。在一些實施例中,供電子摻雜劑以范圍介于電子輸送層材料或電子注入層材料的總重量的約2.0重量%到約70重量%的量含于電子注入層或電子輸送層中。
鑒于驅動電壓的降低,電子注入層的厚度和電子輸送層的厚度各自優選是500nm或更小。電子輸送層的厚度優選是1nm到500nm,更優選是5nm到200nm,并且甚至更優選是10nm到100nm。電子注入層的厚度優選是0.1nm到200nm,更優選是0.2nm到100nm,并且甚至更優選是0.5nm到50nm。
電子注入層和電子輸送層可以由包含一或兩種或更多種上文所提及的材料的單層結構;或由多個具有均勻組成或非均勻組成的層組成的多層結構組成。
本發明通過以下實例更詳細地闡述,但不希望因此限制其。本領域的技術人員將能夠基于描述在無發明性步驟的情況下制備其它電子裝置,并且將因此能夠在整個所要求的范圍中實施本發明。
實例
除非另外指示,否則以下合成在干燥溶劑中在保護性氣體大氣下進行。金屬絡合物另外在排除光的情況下進行處置。溶劑和試劑可以購自例如西格瑪-阿爾德里奇(Sigma-ALDRICH)或ABCR。
實例1:根據流程1制備3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的合成。
流程1
A.合成4-氯丁醛:
將草酰氯(22.54ml,263mmol)于DCM(400ml)中的溶液在iPrOH/CO2浴中冷卻。借助注射器緩慢添加DMSO(37.3ml,525mmol),并且冷攪拌1小時。逐滴添加4-氯丁-1-醇(19g,175mmol)于50mL DCM中的溶液。將冷混合物攪拌一小時,然后緩慢添加三乙胺(110ml,788mmol)。將懸浮液冷攪拌30分鐘,然后使其升溫到室溫。將反應物用水淬滅,酸化,并且分離有機物。去除溶劑接著蒸餾得到呈無色油狀的產物,8g。
B.合成2-溴-4-氯丁醛:
將4-氯丁醛(7.939g,74.5mmol)溶解于DCM(300ml)中,并且在冰浴中冷卻。經約1小時添加二溴(4.00ml,78mmol)于DCM(50ml)中的溶液。在添加之后,將紅色溶液冷攪拌30分鐘,然后緩慢升溫到室溫,并且再攪拌一小時。添加水,分離有機物,并且干燥和去除溶劑得到呈淺黃色油狀的粗產物,1.57g(80%)。
C.合成4-溴菲啶-6-胺:
2,6-二溴苯胺(15.33g,61.1mmol)、2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲腈(7.0g,30.6mmol)和單水合磷酸鉀(21.11g,92mmol)組合于二噁烷(120ml)和水(7.49ml)中。將混合物脫氣,然后添加(dppf)PdCl2絡合物,添加DCM(0.749g,0.917mmol),并且使混合物回流4小時。將黑色混合物分配在EtOAc與水/鹽水之間。將有機層用鹽水洗滌,干燥,并且去除溶劑。溶解于500mL EtOAc中,接著通過硅膠塞使用EtOAc洗脫和去除溶劑得到橙色殘余物,通過柱色譜法純化所述殘余物,得到呈黃/橙色固體狀的產物,5.86g,70%。
D.合成5-溴-3-(2-氯乙基)咪唑并[1,2-f]菲啶:
將4-溴菲啶-6-胺(5.86g,21.46mmol)、2-溴-4-氯丁醛(5.36g,28.9mmol)和碳酸氫鈉(3.60g,42.9mmol)組合于2-丙醇(102ml)和水(5.11ml)中。將懸浮液在室溫下攪拌4小時,然后在回流下攪拌過夜。在真空下去除溶劑,并且將殘余物涂布于硅藻土上。柱色譜法得到產物和起始脒的混合物,將所述混合物用于DCM中的過量乙酰氯和三乙胺處理。在處理之后,通過重復萃取到庚烷中從乙酰胺萃取所要產物,得到3.93g黃色粘性殘余物(51%)。
E.合成3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將5-溴-3-((2-氯乙基)咪唑并[1,2-f]菲啶(3.93g,10.93mmol)溶解于THF(200ml)中,在冰浴中冷卻,并且緩慢添加異丙基氯化鎂于THF中的溶液(2.0M,6.01ml,12.02mmol)。將溶液冷攪拌30分鐘,然后升溫到室溫,并且再攪拌2小時。將反應物淬滅,萃取到DCM中,并且使用柱色譜法純化反應產物,得到1.90g淺米色結晶固體(71%)。
3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的X射線結構展示于圖5中。3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的晶體結構可以由下表中列出的一或多種特征界定。
aR1=Σ||Fo|-|Fc||/Σ|Fo|;wR2=[Σ[w(Fo2-Fc2)2]/Σ[w(Fo2)2]]1/2;GOF=[Σw(|Fo|-|Fc|)2/(n-m)]1/2
實例2:合成4,4-二甲基-3,4-二氫-1,2a1-二氮雜-4-硅苯并[fg]乙烯合蒽和3,3-二甲基-3,4-二氫-1,2a1-二氮雜-3-硅苯并[fg]乙烯合蒽:
根據以下流程2制備以上配位體。
流程2
A.合成5-溴咪唑并[1,2-f]菲啶:
將4-溴菲啶-6-胺(4.0g,14.7mmol)溶解于100mL iPrOH中。添加氯乙醛(50%水溶液,3.6g,22mmol,1.5當量),接著添加NaHCO3(2.5g,2當量),并且使混合物回流2小時,然后在冰浴中冷卻。將茶色固體過濾出,用MeOH洗滌。改變接收燒瓶,并且將固體用水洗滌,得到清潔灰白色產物,3.2g。將水性洗液用EtOAc萃取,并且將這些萃取物與來自初始過濾的醇洗液合并。去除溶劑,得到1.3g橙色固體,使所述固體由EtOAc再結晶,得到呈茶色針狀的更清潔產物,0.46g。總產率:3.5g(80%)。
B.合成3,5-二溴咪唑并[1,2-f]菲啶:
將5-溴咪唑并[1,2-f]菲啶(2.0g,6.73mmol)溶解于DMF(125ml)中,然后在氮氣下緩慢添加NBS(1.318g,7.40mmol)于10mL DMF中的溶液。在室溫下攪拌3小時、然后平緩加熱過夜之后,將反應混合物分配于300mL水與EtOAc之間。進一步用EtOAc萃取水層,用水洗滌有機物,并且通過柱色譜法分離呈淺黃色固體狀的產物,1.99g(79%)。
C.合成5-溴-3-((氯甲基)二甲基硅烷基)咪唑并[1,2-f]菲啶:
將3,5-二溴咪唑并[1,2-f]菲啶(0.48g,1.28mmol)和氯(氯甲基)二甲基硅烷(0.17ml,1.28mmol)溶解于THF(25ml)中,并且在iPrOH/CO2浴中冷卻。緩慢添加丁基鋰于己烷中的溶液(2.5M,0.51ml,1.28mmol),將混合物冷攪拌30分鐘,然后使其升溫到室溫。添加鹽水以淬滅反應物,將有機物萃取到EtOAc中并且通過柱色譜法純化,得到呈無色粘性殘余物形式的產物,0.16g(31%)。
D.合成4,4-二甲基-3,4-二氫-1,2a1-二氮雜-4-硅苯并[fg]乙烯合蒽和3,3-二甲基-3,4-二氫-1,2a1-二氮雜-3-硅苯并[fg]乙烯合蒽:
將5-溴-3-((氯甲基)二甲基硅烷基)咪唑并[1,2-f]菲啶(0.13g,0.322mmol)溶解于THF(25ml)中,并且在冰浴中冷卻。緩慢添加異丙基氯化鎂于THF(2.0M,0.18ml,0.36mmol)中的溶液,然后升溫到室溫。用鹽水淬滅反應物,用DCM萃取有機物,并且色譜分離混合物,得到16mg呈粘性殘余物形式的4,4-二甲基-3,4-二氫-1,2a1-二氮雜-4-硅苯并[fg]乙烯合蒽(17%)和33mg呈結晶固體狀的3,3-二甲基-3,4-二氫-1,2a1-二氮雜-3-硅苯并[fg]乙烯合蒽(36%)。
此外,通過高效液相色譜法(Tosoh TSKgel ODS-100Z)升華純化并且分析此實例中所用的所有有機材料,并且使用在254nm下具有99.9%或更大的吸收強度面積比的材料。
3,3-二甲基-3,4-二氫-1,2a1-二氮雜-3-硅苯并[fg]乙烯合蒽的X射線結構展示于圖6中。3,3-二甲基-3,4-二氫-1,2a1-二氮雜-3-硅苯并[fg]乙烯合蒽的晶體結構可以由下表中列出的一或多種特征界定。
aR1=Σ||Fo|-|Fc||/Σ|Fo|;wR2=[Σ[w(Fo2-Fc2)2]/Σ[w(Fo2)2]]1/2;GOF=[Σw(|Fo|-|Fc|)2/(n-m)]1/2
實例3:合成6-異丙基-10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的鉑(II)絡合物:
流程3
A.合成2-溴-5-甲氧基苯甲腈:
使2-溴-5-甲氧基苯甲醛(100g,0.47mol,1當量)、羥胺鹽酸鹽(64.8g,0.93mol,2當量)、乙酸鈉(76.42g,0.93mol,2當量)和冰乙酸(500mL)的混合物回流過夜。在減壓下去除乙酸,并且將殘余物用二氯甲烷(約400mL)萃取。將有機層用飽和鹽水(3×200mL)洗滌,經硫酸鈉干燥,并且在減壓下濃縮。將所得殘余物用庚烷(50mL)濕磨,并且將固體用額外庚烷(2×50mL)洗滌,得到呈白色粉末狀的所要產物(82.6g,86%產率)。
B.合成5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲腈:
向2-溴-5-甲氧基苯甲腈(82.6g,0.39mol,1當量)、雙(頻哪醇根基)二硼(109.1g,0.43mol,1.1當量)和乙酸鉀(115.3g,1.17mol,3當量)于1,4-二噁烷(400mL)和DMSO(40mL)的混合物中的混合物充氮氣1小時。添加Pd(dppf)Cl2(7.13g,5mol%),并且將反應混合物在60℃下溫和地加熱2小時,然后回流過夜。通過硅藻土過濾混合物,并且用異丙醇和庚烷洗滌從濾液分離的固體,得到呈灰白色固體狀的所要產物(57.41g,57%產率)。從濾液分離額外產物(約10g)。
C.合成4-溴-2-異丙基-8-甲氧基菲啶-6-胺:
向5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲腈(57.41g,0.22mol,1當量)、2,6-二溴-4-異丙基苯胺(64.92g,0.22mol,1當量)和磷酸鉀(153.1g,0.66mol,3當量)于甲苯與水的4:1混合物(1250mL)中的混合物充氮氣1小時。添加反式Pd(PPh3)2Cl2(7.8g,11mmol,0.05當量),并且使反應混合物回流20小時。添加額外磷酸鉀(77g,0.33mol,1.5當量)和反式Pd(PPh3)2Cl2(1g,1.43mmol,0.0065當量),并且使反應混合物再回流3小時。分離各層,并且用熱水(2×400mL)洗滌有機層。將有機層經硫酸鈉干燥,并且在減壓下濃縮。將所得固體依序用二氯甲烷和庚烷濕磨。柱色譜法得到所要產物(30g)。
D.合成6-異丙基-10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-3,4二氫-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將4-溴-2-異丙基-8-甲氧基菲啶-6-胺(8.9g,25.8mmol,1當量)、單水合對甲苯磺酸(348mg)、新鮮制備之2-溴-4-氯丁醛(24g,129mmol,5當量)和異丙醇(500mL)的懸浮液在室溫下攪拌2.5小時。添加碳酸鈉(6.5g,77.4mmol,3當量)和去離子水(32ml),并且使反應混合物回流過夜。在冷卻到室溫之后,將反應混合物體積在減壓下減少到約100mL。將混合物用乙酸乙酯(350mL)稀釋,并且用飽和鹽水(200mL)洗滌。將有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到8.44g產物(76%產率)。
E.合成6-異丙基-10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
向6-異丙基-10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-3,4二氫-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(8.44g,19.6mmol,1.0當量)于無水THF(250mL)中的溶液充氮氣30分鐘。在冷卻到0℃之后,逐滴添加于THF中的2M異丙基氯化鎂(14.7mL,29.4mmol,1.5當量)。使反應混合物升溫達到室溫,并且攪拌過夜。用水(10mL)淬滅反應物,并且在減壓下去除THF。將殘余物用乙酸乙酯(400mL)稀釋,并且用飽和鹽水(2×200mL)洗滌。經硫酸鈉干燥有機層,并且通過柱色譜法純化殘余物,得到3.6g產物(58%產率)。
F.合成6-異丙基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇:
在-78℃下逐滴添加三溴化硼(5.4mL,56.78mmol,5當量)到6-異丙基-10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(3.6g,11.36mmol,1當量)于二氯甲烷(200mL)中的溶液中。使反應物升溫到室溫,并且攪拌過夜。將反應混合物小心地傾入300ml冰水中,并且將所得固體過濾并且依序用水(70mL)、乙酸乙酯(40mL)和庚烷(40mL)洗滌,得到3.6g產物(定量產率)。
G.合成4'-溴-2-硝基-1,1'-聯苯:
添加碳酸鉀(84g,608mmol,3.0當量)于水(450mL)中的溶液到2-碘-硝基苯(50g,200mmol,1.0當量)和4-溴苯硼酸(40.7g,202mol,1.0當量)于1,2-二甲氧基乙烷(660mL)中的混合物中。向反應物充氮氣5.0分鐘。添加四(三苯基膦)鈀(0)(2.32g,2mmol,1mol%),并且再向混合物充氮氣10分鐘。在回流過夜之后,將反應物冷卻到室溫,并且分離各層。用乙酸乙酯(500mL)萃取水層。將經合并的有機萃取物用飽和鹽水(500mL)洗滌,經硫酸鈉干燥,過濾,并且在減壓下濃縮。將殘余物溶解于含25%乙酸乙酯的庚烷(300mL)中,并且通過硅膠墊真空過濾(135g)。用含25%乙酸乙酯的庚烷(3×350mL)沖洗墊。在減壓下濃縮經合并的濾液,得到橙色固體。將此殘余物懸浮于庚烷(150mL)中,并且加熱到40℃后持續20分鐘。使懸浮液冷卻到室溫持續1.0小時。將固體通過真空過濾收集,用庚烷(50mL)洗滌,并且干燥,得到呈黃色固體狀的4'-溴-2-硝基-1,1'-聯苯(49.16g,88.4%產率)。
H.合成2-溴-9H-咔唑:
經5分鐘添加三苯基膦(156.3g,596mmol,2.5當量)到4'-溴-2-硝基-1,1'-聯苯(66.25g,238mmol,1.0當量)于1,2-二氯苯(460mL)中的溶液中。向反應物充氮氣5分鐘,然后使其回流過夜。將反應物冷卻到室溫,并且真空蒸餾以去除大部分1,2-二氯苯(450mL)。將此暗色殘余物溶解于乙酸乙酯(1.5L)中,并且在50℃下用脫色碳(50g)處理30分鐘。在冷卻之后,將混合物通過硅藻土(200g)過濾,然后用乙酸乙酯洗液(2×650mL)洗滌。將經合并的濾液在減壓下濃縮到約500mL體積。將溶液冷卻到室溫,并且在1.5小時之后,將所得淺茶色固體(三苯基氧化膦)通過過濾移出并且舍棄。在減壓下濃縮濾液。將殘余物溶解于甲醇(600mL)中,并且在室溫下儲存過夜。將所得茶色固體過濾,用甲醇(2×100mL)洗滌,并且在真空下在40℃下干燥,得到呈淺茶色固體狀的2-溴-9H-咔唑(33.5g,57.2%產率)。
I.合成2-溴-9-(4-異丙基吡啶-2-基)-9H-咔唑:
向2-溴-9H-咔唑(13.9g,56.5mmol,1當量)、4-異丙基-2-氯吡啶(15.86g,101.7mmol,1.8當量)、L-脯氨酸(1.3g,11.3mmol,0.2當量)、碘化銅(1)(0.95g,5.65mmol,0.1當量)、碳酸鉀(19.48g,141.25mmol,2.5當量)和DMSO(80mL)的懸浮液充氮氣5分鐘。將混合物在95℃下加熱過夜。添加額外4-異丙基-2-氯吡啶(1.58g,10.12mmol,0.18當量),將反應混合物在155℃下再加熱24小時。將反應混合物冷卻到室溫,用乙酸乙酯(750mL)稀釋,并且通過硅藻土(70g)真空過濾。用乙酸乙酯洗液(2×100mL)洗滌硅藻土墊。將經合并的濾液用飽和鹽水(3×500mL)洗滌,經硫酸鈉干燥,過濾,并且在減壓下濃縮。通過柱色譜法純化此殘余物,得到1.8g呈褐色油狀的產物(8.6%產率)。
J.合成6-異丙基-10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將6-異丙基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇(1.5g,4.93mmol,1當量)、2-溴-9-(4-異丙基吡啶-2-基)-9H-咔唑(1.8g,4.93mmol,1當量)、磷酸鉀(5.68g,24.65mmol,5當量)、碘化銅(I)(0.47g,2.47mmol,0.5當量)、吡啶甲酸(1.52g,12.33mmol,2.5當量)和DMSO(150mL)的混合物在150℃下加熱4.5小時。在冷卻到室溫之后,將反應混合物傾入水(700mL)中,并且用乙酸乙酯(4×150mL)萃取。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到呈茶色固體狀的產物,1.25g(43%產率)。
K.合成6-異丙基-10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的鉑(II)絡合物:
將6-異丙基-10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(400mg,0.68mmol,1當量)溶解于60ml冰乙酸中,并且充氮氣30分鐘。然后添加K2PtCl4(283mg,0.68mmol,1當量),并且使反應混合物回流40小時。在冷卻到室溫之后,將橙色沉淀物過濾,并且依序用水(3×15mL)和庚烷(10ml×2次)洗滌。將粗產物(340mg)溶解于10ml二氯甲烷中,并且通過硅膠塞過濾以去除殘余K2PtCl4,用額外二氯甲烷(10mL)洗脫。將濾液減少到其一半體積并且用庚烷(10mL)稀釋。將產物過濾,并且用10%二氯甲烷于庚烷中的溶液(10mL)濕磨,得到呈淡黃色固體狀的產物(140mg,26%產率)。從乙酸和二氯甲烷/庚烷濾液分離額外產物。
實例4:合成(3-苯基-1H-吡唑)2Ir(MeOH)2(OTf)
流程4
A.合成(3-苯基-1H-吡唑)2IrCl2二聚體
將水合氯化銥(6.00g,17.02mmol)和1-苯基-1H-吡唑(5.89g,40.9mmol)組合于2-乙氧基乙醇(120ml)和水(40ml)中。在氮氣下將反應混合物加熱到回流后持續過夜。將所得固體過濾出,并且用甲醇洗滌,并且干燥,得到8.3g銥二聚體。
將實例4A的銥二聚體(8.3g,8.07mmol)溶解于100mL DCM中,并且添加三氟甲磺酸銀(4.36g,16.96mmol)于20mL甲醇中的溶液。將反應混合物在室溫下在氮氣下攪拌1小時。通過硅藻土過濾混合物,并且用DCM洗滌濾餅。蒸發濾液,得到10.85g(3-苯基-1H-吡唑)2Ir(MeOH)2(OTf)(97%)。
實例5:根據流程5制備例示性化合物35。
流程5
A.合成咪唑并[1,2-f]菲啶
向2-苯基-1H-咪唑(10.0g,69.3mmol,1當量)、1,2-二溴苯(19.63g,83.2mmol,1.2當量)、碳酸銫(67.79g,208.0mmol,3當量)、Xantphos(4.01g,6.9mmol,0.1當量)和四(三苯基膦)鈀(8.01g,6.9mmol,0.1當量)于DMF(550mL)中的混合物充氮氣流15分鐘。將混合物在140℃下加熱24小時,然后在減壓下濃縮。將殘余物通過柱色譜法純化為呈淺黃色固體狀的咪唑并[1,2-f]菲啶(10g,67%產率)。
B.合成3-溴咪唑并[1,2-f]菲啶
在0℃下添加N-溴琥珀酰亞胺(1.62g,9.1mmol,1當量)到15(1.99g,9.1mmol,1當量)于DMF(32mL)中的溶液中。在室溫下攪拌18小時之后,將反應物用水(300mL)稀釋,并且依序用含10%二氯甲烷的甲基叔丁基醚(3×500mL)、乙酸乙酯(2×300mL)和二氯甲烷(400mL)萃取。將經合并的有機層經硫酸鈉干燥,過濾,并且在減壓下濃縮。通過柱色譜法純化殘余物,得到呈灰白色固體狀的3-溴咪唑并[1,2-f]菲啶(1.66g,65%產率)。
C.合成2-(咪唑并[1,2-f]菲啶-3-基)乙酸叔丁酯
添加二-μ-溴雙(三-叔丁基膦)二鈀(I)(2.01g,2.5mmol,0.05當量)到16(15.4g,51.8mmol,1當量)于無水四氫呋喃(220mL)中的溶液中,并且向溶液充氮氣流15分鐘。在氮氣下添加含0.5M于乙醚中的2-叔丁氧基-2-氧代乙基溴化鋅(155mL,77.7mmol,1.5當量)。將反應物在60℃下攪拌16小時。添加額外0.5M 2-叔丁氧基-2-氧代乙基氯化鋅溶液(155mL,77.7mmol,1.5當量)和二-μ-溴雙(三-叔丁基膦)-二鈀(I)(2.01g,2.5mmol,0.05當量),并且將反應物在60℃下攪拌,直到LC/MS分析指示其完成。在減壓下濃縮反應混合物。將殘余物溶解于二氯甲烷(1L)中,并且通過硅藻土墊過濾。在減壓下濃縮濾液。通過柱色譜法純化殘余物,得到呈橙色固體狀的2-(咪唑并[1,2-f]菲啶-3-基)乙酸叔丁酯(5g,30%產率)。
D.合成2-(咪唑并[1,2-f]菲啶-3-基)乙酸甲酯鹽酸鹽
將17(2.8g,8.4mmol,1當量)于1.25M HCl(55mL,68.7mmol,6.5當量)中于甲醇中的溶液在60℃下攪拌過夜。在減壓下濃縮反應混合物。將殘余物用乙醚洗滌,并且在40℃下在真空下干燥過夜,得到呈灰白色固體狀的2-(咪唑并[1,2-f]菲啶-3-基)乙酸甲酯鹽酸鹽(2.5g,100%產率)。
E.合成2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酸甲酯
在5℃下依序添加氫化鈉于礦物油中的60%分散液(2.45g,61.2mmol,5當量)和碘甲烷(2mL,32.1mmol,2.6當量)到2-(咪唑并[1,2-f]菲啶-3-基)乙酸甲酯鹽酸鹽(4.0g,12.24mmol,1當量)于無水DMF(45mL)中的溶液中。將混合物在冷卻浴中攪拌30分鐘,升溫到室溫,并且攪拌6小時。添加額外碘甲烷(1.2mL,19.2mmol,1.6當量)。將反應物在室溫下攪拌過周末,用甲醇(32mL)淬滅,并且在減壓下濃縮。將殘余油用二氯甲烷(350mL)稀釋,并且用水(100mL)洗滌。用二氯甲烷(2×100mL)萃取水層。將經合并的有機層用飽和氯化銨(100mL)洗滌,經硫酸鈉干燥,過濾,并且在減壓下濃縮。通過柱色譜法純化殘余物,得到呈灰白色固體狀的2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酸甲酯(1.6g,41%產率)。
F.合成2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酸
將2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酸甲酯(1.6g,5.0mmol,1當量)于甲醇(100mL)中的溶液用1N氫氧化鈉水溶液(30mL,30mmol,6當量)處理,并且進一步用水(100mL)稀釋。在回流5天之后,將反應物在減壓下濃縮。將殘余物溶解于水(100mL)中,并且用濃HCl酸化到pH 5-6。將所得白色懸浮液用異丙醇與二氯甲烷的1比2混合物(4×200mL)萃取。將經合并的有機層經硫酸鈉干燥,過濾,在減壓下濃縮。將殘余物在高真空下在40℃下干燥過夜,得到呈白色固體狀的2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酸(1.3g,82%產率)。
G.合成2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酰氯
添加亞硫酰氯(1mL,13.7mmol,2當量)和無水DMF(0.05mL,0.6mmol,0.11當量)到2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酸(1.3g,4.2mmol,1當量)于無水二氯甲烷(100mL)中的懸浮液中。在室溫下攪拌過夜之后,將混合物在減壓下濃縮,得到呈灰白色固體狀的2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酰氯(1.37g,100%產率)。
H.合成3,3-二甲基二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4(3H)-酮
將2-(咪唑并[1,2-f]菲啶-3-基)-2-甲基丙酰氯(1.37g,4.2mmol,1當量)和無水氯化鋁(6.0g,44.9mmol,10當量)于無水二氯甲烷(60mL)中的混合物在室溫下攪拌6小時。將反應物用冰水浴冷卻,用冰淬滅,用飽和碳酸氫鈉(300mL)稀釋,并且用二氯甲烷(4×400mL)萃取。將經合并的有機層經硫酸鈉干燥,過濾,并且在減壓下濃縮。使用柱色譜法純化殘余物,得到呈白色固體狀的3,3-二甲基二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4(3H)-酮(1g,81%產率)。
I.合成3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-醇
在5℃下以一份方式添加硼氫化鈉(0.24g,6.3mmol,2當量)到3,3-二甲基二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4(3H)-酮(0.9g,3.1mmol,1當量)于乙醇(70mL)中的溶液中。將反應物在室溫下攪拌1.5小時,并且然后用丙酮(2mL)淬滅。在減壓下濃縮反應混合物。將殘余物溶解于甲基叔丁基醚(300mL)中,用飽和碳酸氫鈉(2×60mL)和飽和鹽水(60mL)洗滌。將有機層經硫酸鈉干燥,過濾,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到呈白色固體狀的3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-醇(0.9g,100%產率)。
J.二硫代碳酸鄰(3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-酯)S-甲酯
在0℃下添加氫化鈉(0.48g,20.2mmol,5當量)于礦物油中的60%分散液到3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-醇(0.71g,2.46mmol,1當量)于無水THF(70mL)中的溶液中。在5℃下攪拌30分鐘之后,添加咪唑(0.0168g,0.24mmol,0.1當量)于無水四氫呋喃(3.2mL)中的溶液,接著逐滴添加二硫化碳(0.89mL,14.8mmol,6當量)。經30分鐘使反應物緩慢升溫到12℃。逐滴添加(放熱)碘甲烷(0.92mL,14.7mmol,6當量),并且將反應物在室溫下攪拌1小時。將反應混合物冷卻到5℃,用飽和鹽水(140mL)稀釋,并且用二氯甲烷(5×100mL)萃取。將經合并的有機層經硫酸鈉干燥,過濾,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到呈白色固體狀的二硫代碳酸鄰(3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-酯)S-甲酯(0.86g,93%產率)。
K.合成3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪
將二硫代碳酸鄰(3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-酯)S-甲酯(0.98g,2.6mmol,1當量)、2,2'-氮雜雙(2-甲基丙腈)(0.098g,0.6mmol,0.2當量)和三丁基氫化錫(1.81mL,6.7mmol,2.6當量)于無水甲苯(70mL)中的溶液在80℃下攪拌3.5小時。在冷卻到室溫之后,將反應混合物在減壓下在35℃下濃縮,并且吸收到硅膠(10g)上。通過柱色譜法純化粗物質,得到呈白色固體狀的3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.53g,72%產率)。
L.合成(3-氯丙基)(甲基)硫烷
將甲硫醇鈉(6.14g,88mmol)溶解于150mL EtOH中,在冰浴中冷卻,然后添加1-溴-3-氯丙烷(8.6ml,87mmol)。使溶液升溫到室溫,并且攪拌2小時。過濾沉淀的固體,并且使濾液在真空下冷凝。在真空下蒸餾殘余物,得到呈無色油狀的產物,36%。
M.合成三-[(3-甲硫基)丙基]銥(III)
通過將由(3-氯丙基)(甲基)硫烷和鎂屑制成的格林納(Grignard)與IrCl3(THT)3一起于THF中攪拌,接著進行柱色譜法,合成(3-氯丙基)(甲基)硫烷,得到白色固體,32%。
N.合成化合物35
將來自實例5M的三-[(3-甲硫基)丙基]銥(III)(0.020g,0.044mmol)和來自實例5K的3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.036g,0.131mmol)組合于乙二醇(0.5ml)中,通過抽真空/回填循環脫氣,并且在回流下攪拌,變黃然后變黑。將冷卻的殘余物分配于水與DCM之間,將有機物干燥并且涂布于硅藻土上。通過柱色譜法純化,得到4mg呈米色固體狀的化合物35(9%)。
實例6:如流程6中那樣進行化合物48的合成。
流程6
將來自實例4的(3-苯基-1H-吡唑)2Ir(MeOH)2(OTf)(0.031g,0.045mmol)和來自實例5K的3,3-二甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.024g,0.090mmol)組合于2-乙氧基乙醇(0.5ml)中,進行快速抽真空/回填三次,然后在回流下在氮氣下加熱2小時。將反應混合物溶解于DCM中,涂布于硅藻土上,并且通過柱色譜法純化,得到呈近似無色殘余物形式的化合物35,6mg(18%)。
實例7:根據以下流程7進行化合物49的合成。
流程7
A.合成1-甲基菲啶-6-胺:
向2-溴-3-甲基苯胺(38.8g,208mmol,1當量)、(氯(2-二環己基膦-2',6′-二甲氧基-1,1′-聯苯)[2-(2'-氨基-1,1′-聯苯)]鈀(II)(2.99g,4.16mmol,0.02當量)、2-二環己基-膦-2',6′-二甲氧基聯苯(1.71g,4.16mmol,0.02當量)于THF(832mL)中的混合物充氮氣15分鐘。添加(2-氰基苯基)溴化鋅溶液(500mL,0.5M于THF中,250mmol,1.2當量)到混合物中,并且使反應物回流過夜。在冷卻到室溫之后,將反應物用飽和鹽水(10mL)稀釋,并且在減壓下濃縮。將固體溶解于含10%甲醇的二氯甲烷(500mL)和24重量%氫氧化鈉水溶液(500mL)中。分離各層,并且用二氯甲烷(3×500mL)萃取水溶液。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。將褐色固體依序用含25%MTBE的庚烷(1.5L)和二氯甲烷(5×25mL)濕磨,得到呈淺黃色固體狀的26(10.7g,25%產率,>95%純度)。
B.合成8-甲基咪唑并[1,2-f]菲啶:
使1-甲基菲啶-6-胺(10.7g,51mmol,1當量)、50重量%氯乙醛水溶液(16mL,102mmol,2當量)、碳酸鈉(13.5g,128mmol,2.5當量)于異丙醇(340mL)中的混合物回流2小時。將反應物冷卻到4℃,并且用二氯甲烷(250mL)和飽和碳酸氫鈉(500mL)稀釋。分離各層,并且用二氯甲烷(3×250mL)萃取水層。將經合并的有機物層經硫酸鈉干燥,并且在減壓下濃縮,得到呈褐色固體狀的粗8-甲基咪唑并[1,2-f]菲啶(23.8g),其隨后使用。
C.合成3-溴-8-甲基咪唑并[1,2-f]菲啶:
將粗8-甲基咪唑并[1,2-f]菲啶(23.8g)、N-溴琥珀酰亞胺(9.1g,51mmol,1當量)于二氯甲烷(306mL)中的混合物在室溫下攪拌2小時。添加水(500mL),并且分離各層。用二氯甲烷(3×500mL)萃取水溶液。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。將固體預吸收到硅膠上,并且通過柱色譜法純化,得到呈淡褐色固體狀的3-溴-8-甲基咪唑并[1,2-f]菲啶(12g,98%純度)。
D.合成8-甲基-3-(2-甲基丙-1-烯-1-基)咪唑并[1,2-f]菲啶:
向3-溴-8-甲基咪唑并[1,2-f]菲啶(12g,38.5mmol,1當量)、4,4,5,5-四甲基-2-(2-甲基丙-1-烯-1-基)-1,3,2-二氧雜硼雜環戊烷(10.5g,58mmol,1.5當量)和碳酸鉀(16g,115.5mmol,3當量)于1,4-二噁烷與水的5比1混合物(185mL)中的混合物充氮氣15分鐘。添加(氯(2-二環己基膦-2',6′-二甲氧基-1,1′-聯苯)[2-(2'-氨基-1,1′-聯苯)]鈀(II)(4.16g,5.78mmol,0.15當量)和2-二環己基膦-2′,6′-二甲氧基聯苯(2.38g,5.78mmol,0.15當量),并且使反應物回流36小時。在冷卻到室溫之后,將反應物用水(200mL)稀釋。分離各層,并且用乙酸乙酯(3×200mL)萃取水溶液。將經合并的有機物層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗固體,得到呈淡褐色固體狀的8-甲基-3-(2-甲基丙-1-烯-1-基)咪唑并[1,2-f]菲啶(8.5g,70%產率,90%純度)。
E.合成4,4,7-三甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將8-甲基-3-(2-甲基丙-1-烯-1-基)咪唑并[1,2-f]菲啶(1.6g,5.69mmol,1當量)和無水氯化鋁(3.8g,28.4mmol,5當量)于二氯甲烷(57mL)中的混合物在室溫下攪拌過夜。將反應物在冰浴中冷卻,并且逐滴添加水(10mL)。分離各層,并且用二氯甲烷(3×50mL)萃取水層。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗固體,得到呈淡黃色固體狀的4,4,7-三甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(1.43g,88%產率,98%純度)。
F.合成2-溴-4,4,7-三甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將4,4,7-三甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(500mg,1.75mmol,1當量)和N-溴琥珀酰亞胺(311mg,1.75mmol,1當量)于二氯甲烷(11mL)中的混合物在室溫下攪拌2小時。將反應物用水(20mL)和二氯甲烷(10mL)稀釋。分離各層,并且用二氯甲烷(3×20mL)萃取水溶液。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化殘余物,得到呈淡褐色固體狀的2-溴-4,4,7-三甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(575mg,90%產率,97%純度)。
G.合成2,4,4,7-四甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
向2-溴-4,4,7-三甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(265mg,0.73mmol,1當量)、三甲基硼氧雜環己烷(0.6mL,4.4mmol,6當量)和碳酸鉀(608mg,4.4mmol,6當量)于1,4-二噁烷與水的10比1混合物(7mL)中的混合物充氮氣15分鐘。添加(氯(2二環己基膦-2′,6′-二甲氧基-1,1′-聯苯)[2-(2′-氨基-1,1′-聯苯)]鈀(II)(108mg,0.15mmol,0.2當量)和2-二環己基膦-2′,6′-二甲氧基聯苯(62mg,0.15mmol,0.2當量),并且使反應物回流過夜。在冷卻到室溫之后,將反應物用水(10mL)和乙酸乙酯(10mL)稀釋。分離各層,并且用乙酸乙酯(3×20mL)萃取水溶液。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化殘余物,得到呈淺黃色固體狀的2,4,4,7-四甲基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(100mg,46%產率,95%純度)。
H.合成化合物49:
以與化合物35類似的方法合成化合物49,得到13mg黃色粉末(15%)。
實例8:根據以下流程8進行化合物50的合成。
流程8
A.合成1-氯菲啶-6-胺:
將3-氯-2-碘苯胺(8.77g,34.6mmol)、CyJohnPhos(0.462g,1.319mmol)和Pd(CH3CN)2Cl2(0.171g,0.659mmol)的混合物溶解于二噁烷(80ml)中。借助注射器依序添加三乙胺(13.78ml,99mmol)和4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷(10.04ml,69.2mmol)到溶液中。使反應物回流4小時。將反應物冷卻到室溫,并且添加2-溴苯甲腈(6g,33.0mmol)、S-Phos Pd G2(0.475g,0.659mmol)、S-Phos(0.271g,0.659mmol)和碳酸鉀(9.11g,65.9mmol)的固體混合物到反應混合物中,接著添加二噁烷(20ml)和水(20ml),并且將反應物加熱到85℃后持續過夜。將粗產物用DCM萃取,并且降低真空度,得到橙色油。將其溶解于THF(80mL)中,并且在0℃下添加氫化鈉(1.978g,49.4mmol),并且攪拌20分鐘。將反應物用鹽水淬滅,并且用DCM萃取。蒸發反應混合物,接著用乙醚濕磨,得到呈灰白色固體狀的1-氯菲啶-6-胺(52%產率)。
B.合成8-氯咪唑并[1,2-f]菲啶:
將1-氯菲啶-6-胺(864mg,3.78mmol)、2-氯乙醛(50重量%水溶液,1.02mL,7.56mmol)和碳酸氫鈉(635mg,7.56mmol)組合于iPrOH中,并且回流1小時。將混合物冷卻到室溫,并且傾入水中,并且過濾(99%產率)。
C.合成8-苯基咪唑并[1,2-f]菲啶:
將8-氯咪唑并[1,2-f]菲啶(955mg,3.78mmol)、苯基硼酸(829mg,6.80mmol)、S-Phos Pd G2(109mg,0.151mmol)、S-Phos(62.1mg,0.151mmol)和碳酸鉀(522mg,3.78mmol)的混合物抽真空并且用氮氣回填數次。添加二噁烷(20ml)和水(4ml),并且使其回流1小時。將粗產物用DCM和鹽水萃取,并且通過柱色譜法純化,得到產物(99%產率)。
D.合成3-溴-8-苯基咪唑并[1,2-f]菲啶:
將8-苯基咪唑并[1,2-f]菲啶(1.15mg,3.91mmol)和NBS(0.765g,4.30mmol)組合于DMF中,并且在室溫下攪拌30分鐘,接著用水淬滅。將所得固體過濾并且在真空中干燥,得到75%產率的3-溴-8-苯基咪唑并[1,2-f]菲啶。
E.合成3-(2-甲基丙-1-烯-1-基)-8-苯基咪唑并[1,2-f]菲啶:
將3-溴-8-苯基咪唑并[1,2-f]菲啶(980mg,2.63mmol)、SPhos Pd G2(76mg,0.105mmol)、SPhos(43.1mg,0.105mmol)和碳酸鉀(363mg,2.63mmol)的混合物抽真空并且用氮氣回填數次。添加甲苯(15ml)、水(3ml)和4,4,5,5-四甲基-2-(2-甲基丙-1-烯-1-基)-1,3,2-二氧雜硼雜環戊烷(1.077ml,5.25mmol),并且在回流下加熱過夜。將產物用DCM和鹽水萃取,并且通過柱色譜法純化,得到20%產率的3-(2-甲基丙-1-烯-1-基)-8-苯基咪唑并[1,2-f]菲啶。
F.合成4,4-二甲基-7-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將3-(2-甲基丙-1-烯-1-基)-8-苯基咪唑并[1,2-f]菲啶(160mg,0.459mmol)溶解于DCM(10ml)中,并且添加三氯化鋁(184mg,1.378mmol)。將反應物在室溫下攪拌40分鐘。將混合物用KOH(aq)/鹽水淬滅,并且用DCM萃取數次。通過柱色譜法純化產物,得到63%產率的4,4-二甲基-7-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪。
G.合成化合物50:
將來自實例4的(3-苯基-1H-吡唑)2Ir(MeOH)2(OTf)(0.03g,0.043mmol)和4,4-二甲基-7-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.030g,0.087mmol)組合于2-乙氧基乙醇(0.5ml)中,快速抽真空/用氮氣回填三次,然后在回流下在氮氣下加熱2小時。通過柱色譜法純化產物,得到56%產率的化合物50。
實例9:根據以下流程9進行化合物108的合成。
流程9
A.合成(4-((三異丙基硅烷基)氧基)苯基)氨基甲酸叔丁酯:
依序添加三異丙基氯硅烷(32mL,0.15mol,1.2當量)和三乙胺(21mL,0.15mol,1.2當量)到(4-羥苯基)氨基甲酸叔丁酯(26.1g,0.125mol,1當量)于THF(200mL)中的溶液中。將反應混合物在室溫下攪拌16小時。過濾反應物,并且用THF(2×30mL)洗滌固體。在減壓下濃縮經合并的濾液。通過柱色譜法純化粗產物,得到呈黃色油狀的(4-((三異丙基硅烷基)氧基)苯基)氨基甲酸叔丁酯(39.66g,87%產率)。
B.合成4-((三異丙基硅烷基)氧基)苯胺:
在室溫下添加三氟乙酸(41.51mL,0.54mol,5當量)到(4-((三異丙基硅烷基)氧基)苯基)氨基甲酸叔丁酯(39.66g,0.1085mol,1當量)于二氯甲烷(400mL)中的溶液中。在攪拌16小時之后,在減壓下去除溶劑。使殘余物與甲苯(3×50mL)共沸。經硅膠純化粗產物,得到4-((三異丙基硅烷基)氧基)苯胺(25g,87%產率)。
C.合成2,6-二溴-4-((三異丙基硅烷基)氧基)苯胺:
在0℃下逐滴添加溴(8.2mL,0.16mol,2.5當量)到4-((三異丙基硅烷基)氧基)苯胺(17g,64.4mmol,1當量)于二氯甲烷和甲醇的1:1混合物(60mL)中的溶液中。使反應混合物升溫達到室溫,并且攪拌16小時。將反應混合物用二氯甲烷(200mL)稀釋,并且依序用1M NaOH(2×100mL)和飽和鹽水(2×100mL)洗滌。將有機層經硫酸鈉干燥并且在減壓下濃縮,得到呈褐色油狀的2,6-二溴-4-((三異丙基硅烷基)氧基)苯胺(26.37g,97%產率),其隨后使用。
D.合成4-溴-8-甲氧基-2-((三異丙基硅烷基)氧基)菲啶-6-胺:
向5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲腈(16.14g,62.3mmol,1當量)、51(26.37g,62.3mmol,1當量)和磷酸鉀(43.04g,0.187mol,3當量)于甲苯和水的4比1混合物(500mL)中的混合物充氮氣1小時。添加反式Pd(PPh3)2Cl2(2.8g,3.11mmol,0.05當量),并且使反應混合物回流20小時。添加額外5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲腈(2.2g,8.5mmol,0.14當量)和反式Pd(PPh3)2Cl2(0.3g,0.43mmol,0.0069當量),并且使反應混合物再回流4小時。分離各層,并且用熱水(2×200mL)洗滌有機層。將有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化殘余物,得到20%產率的4-溴-8-甲氧基-2-((三異丙基硅烷基)氧基)菲啶-6-胺。
E.合成5-溴-3-(2-氯乙基)-11-甲氧基-7-((三異丙基硅烷基)氧基)咪唑并[1,2-f]菲啶:
將4-溴-8-甲氧基-2-((三異丙基硅烷基)氧基)菲啶-6-胺(5.95g,12.53mmol,1當量)、單水合對甲苯磺酸(175mg)和新鮮制備的2(6.67g,62.63mmol,5當量)于異丙醇(500mL)中的懸浮液在室溫下攪拌2小時。添加碳酸鈉(3.25g,37.6mmol,3當量)和去離子水(12ml),并且使反應混合物回流過夜。在冷卻到室溫之后,將反應混合物體積在減壓下減少到約60ml。將混合物用乙酸乙酯(300mL)稀釋,并且用飽和鹽水(200mL)洗滌。將有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到5-溴-3-(2-氯乙基)-11-甲氧基-7-((三異丙基硅烷基)氧基)咪唑并[1,2-f]菲啶(5.53g,79%產率)。
F.合成10-甲氧基-6-((三異丙基硅烷基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
向5-溴-3-(2-氯乙基)-11-甲氧基-7-((三異丙基硅烷基)氧基)咪唑并[1,2-f]菲啶(5.53g,9.84mmol,1.0當量)于無水THF(300mL)中的溶液充氮氣30分鐘。在冷卻到0℃之后,借助注射器逐滴添加2M于THF中的異丙基氯化鎂(7.4mL,14.76mmol,1.5當量)。使反應混合物升溫到室溫,并且攪拌過夜。用水(10mL)淬滅反應物,并且在減壓下去除THF。用二氯甲烷(500mL)萃取殘余物。將有機層用水(2×200mL)洗滌,經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到10-甲氧基-6-((三異丙基硅烷基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(3g,68%產率)。
G.合成10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-醇:
逐滴添加含三水合四丁基氟化銨的THF(30mL)到10-甲氧基-6-((三異丙基硅烷基)氧基)-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(3g,6.72mmol,1當量)于THF(100mL)中的溶液中。在室溫下攪拌16小時之后,在減壓下去除溶劑,并且用二氯甲烷(80mL)萃取殘余物。用飽和鹽水(2×100mL)洗滌有機層。在用飽和鹽水洗滌后,大量沉淀物開始在有機層中形成。將沉淀物過濾并且用庚烷(2×10mL)洗滌,得到純10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-醇(1.83g,94%產率)。
H.合成三氟甲磺酸10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-酯:
在0℃下依序添加三氟乙酸酐(1.14mL,6.77mmol,1.1當量)和吡啶(0.744mL,9.24mmol,1.5當量)到10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-醇(1.79g,6.16mmol,1當量)于二氯甲烷(100mL)中的混合物中。在攪拌15分鐘之后,使反應物升溫到室溫,并且攪拌6小時。將反應混合物用二氯甲烷(200mL)稀釋并且用水(3×100mL)洗滌。經硫酸鈉干燥有機層,并且在減壓下去除溶劑。將殘余物用庚烷和二氯甲烷的10比1混合物(10mL)濕磨,得到三氟甲磺酸10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-酯(2.17g,83%產率)。
I.合成10-甲氧基-6-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
向三氟甲磺酸10-甲氧基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-酯(0.65g,1.54mmol,1當量)、苯基硼酸(0.188g,1.54mmol,1當量)和磷酸鉀(1.06g,4.62mmol,3當量)于甲苯:1,4-二噁烷:水的3:1:1混合物(500mL)中的混合物充氮氣1小時。添加反式Pd(PPh3)2Cl2(54mg,0.077mmol,0.05當量),并且使反應混合物回流16小時。將反應混合物用二氯甲烷(200mL)稀釋。將有機層用溫水(2×100mL)洗滌,經硫酸鈉干燥,并且在減壓下濃縮,得到10-甲氧基-6-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.527g,97%產率)。
J.合成6-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇:
在-78℃下逐滴添加1M于二氯甲烷中的三溴化硼(7.5mL,7.5mmol,5當量)到10-甲氧基-6-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.527g,1.5mmol,1當量)于二氯甲烷(100mL)中的溶液中。使反應物升溫到室溫,并且攪拌過夜。將反應混合物小心地傾入冰水(150mL)中,并且將所得固體過濾并且依序用水(30ml)和庚烷(10mL)洗滌,得到6-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇(0.47g,93%產率)。
K.合成10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-6-苯基-3,4-二氫-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
將2-溴-9-(4-異丙基吡啶-2-基)-9H-咔唑(0.528g,1.446mmol,1當量)、6-苯基-3,4-二氫二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇(0.486g,1.446mmol,1當量)、磷酸鉀(1.67g,7.23mmol,5當量)、碘化銅(I)(0.138g,0.723mmol,0.5當量)和吡啶甲酸(0.445g,3.62mmol,2.5當量)于DMSO(50mL)中的混合物在150℃下加熱4.5小時。在冷卻到室溫之后,將反應混合物傾入水(300mL)中,并且用乙酸乙酯(4×100mL)萃取。將經合并的有機層經硫酸鈉干燥,并且在減壓下濃縮。通過柱色譜法純化粗產物,得到呈茶色固體狀的10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-6-苯基-3,4-二氫-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.55g,61%產率)。
L.合成化合物108:
向10-((9-(4-異丙基吡啶-2-基)-9H-咔唑-2-基)氧基)-6-苯基-3,4-二氫-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(350mg,0.564mmol,1當量)于冰乙酸(60mL)中的溶液充氬氣40分鐘。添加K2PtCl4(234mg,0.564mmol,1當量),并且使反應混合物回流16小時。在冷卻到室溫之后,將黃綠色沉淀物過濾,并且依序用水(4×15mL)和庚烷(2×10mL)洗滌,并且在真空下在20℃下干燥18小時。將粗產物溶解于二氯甲烷(500mL)中,并且使其通過硅膠塞(10g)以去除殘余K2PtCl4。在減壓下去除溶劑。將殘余物用二氯甲烷和庚烷的1比1混合物(20mL)濕磨,過濾,并且用二氯甲烷(2×3mL)洗滌,得到化合物108(40mg,產率8.7%產率,83.2%)。
討論:以下展示金屬配位的咪唑并菲啶配位體的一個實施例的通式結構。計算研究中所關注的鍵是四種碳-氮(C-N)單鍵。其標記為針對具有三種C-N單鍵的氮的C-N1、C-N2、C-Nph和針對配位到金屬的氮的C-Nm。
在高斯(Gaussian)09軟件包中使用混合B3LYP泛函與CEP-31g有效核勢基組對所有絡合物和配位體執行幾何優化。除非另外陳述,否則在結果和討論中所有結果都使用此方法。
通過使一鍵斷裂以形成雙自由基物質來計算咪唑并菲啶配位體上的鍵強度。斷鍵的雙自由基物質經計算為三重態,因為其能量通常比雙自由基單重態低,并且因此產物更可能在斷鍵事件中形成。在B3LYP/6-31g(d)水平下執行計算,并且針對基態單重態→斷鍵的三重態和最低能量三重態(激發態)→斷鍵的三重態進行熱力學報道。
最低三重態激發態(T1)的計算TD-DFT值還在B3LYP/CEP-31g理論水平下執行,但包括使用THF作為溶劑的CPCM連續溶劑場,其已經顯示更好地匹配實驗結果。
對以下化合物執行鍵強度計算:
計算的鍵強度展示于表1中。
表1:
表1展示了一系列比較實例和本發明化合物1的計算的鍵強度。在兩個數值見于同一單元格中時,上面的數值表示激發態三重態→斷鍵的三重態之間的熱力學差異。下面的數值表示基態單重態→斷鍵的三重態。如果單元格中僅存在一個數值,那么其表示三重態→三重態鍵強度(T→T)。對于所有比較化合物1-4,C-N1鍵都顯示為最弱鍵。發現鍵強度在激發三重態下與基態單重態相比更弱。這是由于具有激發態的能量的絡合物可用作起始點,到通常更高能量的斷鍵的狀態。在一些情況下,如關于比較化合物2和3所展示,斷鍵的狀態能量比起始三重態低。因此,斷鍵事件可以視為熱力學上有利的或放熱的。發現當芳基取代基添加于C-N1鍵碳原子時,鍵強度降低,如將比較化合物1與比較化合物2和3比較所見。此影響可能是由于斷鍵位點處自由基物質的共振穩定化,所述自由基物質通過芳基取代而穩定化。
弱C-N1鍵的穩定化可以通過鍵聯取代來實現,所述鍵聯取代使C-N1碳鍵聯到相鄰稠合芳基環上的碳,如式(1a)中的“A”所描繪。此鍵聯基團優選由如下元素組成,其提供恰當結構幾何構型以形成跨菲啶環系統的兩個碳的橋,提供必需剛度以使C-N1鍵穩定化,同時不會降低所得配位體和絡合物的三重態能量。
穩定化鍵聯基團的作用關于本發明化合物1展示于表1中。此處,三重態C-N1鍵強度已經從類似比較化合物1的11.81kcal/mol大大提高到本發明化合物的35.38kcal/mol,熱力學鍵強度有>20kcal/mol的增加。兩個碳鍵聯取代基阻止配位體獲得CN1斷鍵的狀態的適當松弛的幾何構型。重要地,三重態能量并不受此取代影響,因為本發明化合物1和比較化合物1兩者都具有468nm的計算相同三重態能量。
比較實例1的最小化非斷鍵和斷鍵幾何構型展示于圖3a和3b中。可以看出,斷鍵的幾何構型使咪唑并菲啶配位體的稠合環系統的環應力松弛。如關于本發明化合物1所展示,系栓取代抑制松弛的斷鍵的幾何構型,因此增加C-N1鍵的熱力學鍵強度。
C-N1鍵的薄弱的其它實驗證據由基質輔助激光解吸電離質譜分析(MALDI-MS)展示。MALDI-MS可以用以探測分子的激發態下的鍵的薄弱性。據相信,作為光化學穩定性的量度,MALDI-MS可以模擬存在充電和激發態兩者的OLED裝置內所見的一些條件。圖3展示了比較化合物3的以負模式獲取的MALDI-MS。母體離子的峰值鑒別為1529amu下。然而,最高強度峰值見于1275amu下。此質量對應于比較化合物3的片段,其中咪唑環已經失去兩個碳的質量和聯三苯取代。所提出的片段的結構展示于圖3中。同位素模式證實此片段含有銥并且與所提出的片段的化學式一致。如圖4中所示,關于1083amu下的配位體損失和1020amu下兩種配位體的咪唑環分解,鑒別其它片段。數據表明,主要片段的形成需要C-N1鍵斷裂,所述鍵通過計算經預測為弱鍵。
本發明化合物的光物理性質
本發明化合物的所測量的光物理性質報道于下表2中。在77K下和在室溫下在2-甲基四氫呋喃溶劑中在高稀釋濃度下測量絡合物。使用配備有氙氣燈、積分球和C10027型號光子多通道分析儀的濱松(Hamamatsu)C9920系統,以1重量%于聚甲基丙烯酸甲酯(PMMA)固態基質或0.4重量%聚苯乙烯(PS)固態基質中測量光致發光量子產率(PLQY,ΦPL)。通過時間相關單光子計數法,使用與IBH數據站中心集成的堀場喬賓伊馮(Horiba Jobin Yvon)Fluorolog-3,使用335nm納米LED作為激發源,進行PL瞬態測量(τ)。
表2:
化合物35經測量具有深藍色發射,在77K下的最高能量峰值是451nm,然而,絡合物的PLQY是僅5%。化合物49展現對配位體的改性可以如何用以提高PLQY。咪唑環上的甲基取代已經發現可提高非乙基橋連菲啶咪唑類似物的PLQY。另外,外部苯環上的甲基取代通過計算顯示可影響配位體咬角,這是由于相鄰芳基環上的甲基取代基和質子的空間影響。此空間影響使得菲啶咪唑多環系統幾何構型更接近非橋連配位體的幾何構型,其中配位位點可以更緊密連接到金屬。配位體的幾何構型的此細微變化使得金屬與中性配位的氮之間的相互作用更強,提高金屬-氮鍵強度。據相信,更強金屬-氮鍵強度可以通過減小金屬-氮斷鍵非-輻射衰變而改進絡合物的發射性。因此,兩個甲基取代基都可能引起與化合物35相比提高化合物49的PLQY。化合物49經測量為在PMMA基質中具有62%的PLQY,其極接近非橋連類似物比較化合物6的PLQY值,所述比較化合物經測量為具有68%的PLQY。另外,與化合物35的5.1微秒的激發態壽命相比,化合物49經測量在77K下具有2.9微秒的短得多的激發態壽命。這進一步表明,甲基取代基改進化合物49的輻射性質。
具有苯基吡唑配位體(ppz)的雜配實例化合物48和化合物50經測量具有深藍色發射,但具有低PLQY。然而,非橋連參考化合物比較化合物8也測量為具有14%的低PLQY。據相信,低效率可能是由于吡唑配位體的弱金屬-氮鍵。為了進一步支持此假設,三Ir(ppz)3已經在文獻中顯示為在室溫溶液中是非發射的,但在77K下是高度發射的。室溫下的非發射性歸因于弱金屬氮鍵。
具有橋連菲啶咪唑配位體的鉑絡合物也被發現以深藍色高度發射。化合物105和比較化合物7兩者都測量為在光學惰性聚苯乙烯基質中具有分別為85%和87%的高PLQY值。鉑絡合物可能不需要如關于銥類似物化合物49所描述進行配位體改性來提高PLQY,這是由于與銥相比相對更強的鉑-氮鍵強度。
本領域的技術人員應了解,可以在不脫離上文所展示并且描述的例示性實施例的廣泛發明構思情況下改變所述例示性實施例。因此,應理解,本發明不限于所展示并且描述的例示性實施例,但希望涵蓋在如由權利要求書所界定的本發明的精神和范圍內的修改。舉例來說,例示性實施例的特定特征可以是或可以不是所要求的發明的一部分并且可以將所公開的實施例的特征組合。本文中除非特定闡述,否則術語“一個(a/an)”和“所述”不限于一個要素,而是應理解為意指“至少一個”。
應理解,已經將本發明的圖式和描述中的至少一些簡化以集中于與本發明的清楚理解相關的要素,同時為清楚起見,排除本領域普通技術人員將了解也可以構成本發明的一部分的其它要素。然而,因為此類要素在本領域中熟知并且因為它們不必促進更好地理解本發明,所以本文中未提供此類要素的描述。
此外,本發明的任何方法不依賴于本文中闡述的特定步驟次序到一定程度以便,特定步驟次序不應理解為對權利要求的限制。針對此類方法的權利要求不應限于以所寫次序執行其步驟,并且本領域技術人員可以容易了解,步驟可以變化并且仍保持在本發明的精神和范圍內。
本文所引用的所有參考文獻,包括公開案、專利申請和專利特此以引用的方式并入,其引用程度就如同每一參考文獻單獨地并且特定地指示為以引用的方式并入并且全文闡述于本文中一般。
- 還沒有人留言評論。精彩留言會獲得點贊!