含硫酸鹽的具有被氧化的表面的可充電電池陰極的制作方法
本發明涉及用于可充電鋰離子電池的改進陰極材料。該陰極材料含有Ni、Mn和Co,進行了表面處理并且具有改性的組合物,該組合物在全電池中在長期循環過程中,尤其在高溫下表現出改進的循環穩定性。當在高壓下循環時,該改性材料也表現出改進的穩定性。此外,可溶堿的含量低。
背景技術:
鋰可充電電池的陰極通常是一種能夠可逆地嵌入鋰和脫嵌鋰的粉末狀材料。將該粉末作為電極膜沉積到充當集電體的金屬箔上。該電極膜經常含有大于95%的陰極材料以及少量的粘合劑和導電添加劑。將如此制備的正電極與隔膜和負電極膜(陽極)堆疊或卷繞起來。通常,該負電極膜含有碳。最后,將該堆疊或卷繞的陰極-隔膜-陽極-卷插入殼體中,加入電解質并且密封該殼體,從而產生全電池。
以往,LiCoO2是用于可充電鋰電池的主要陰極材料。最近,所謂的NMC陰極材料在很多應用中代替了LiCoO2。“NMC”是鎳-錳-鈷的縮寫并且用于基于鋰過渡金屬的氧化物,其中該過渡金屬是主要地Ni、Mn和Co的混合物并且具有大致化學計量的LiMO2,其中M=NixMnyCoz。附加摻雜是可能的,典型的摻雜元素為Al、Mg、Zr等。晶體結構是有序的巖鹽型結構,其中陽離子排列成2維Li和M層。空間群是R-3M。可能存在很多不同組合物,它們經常按照它們的鎳錳和鈷含量分類和命名。典型的NMC基材料是“111”,其中M=Ni1/3Mn1/3Co1/3,“442”,其中M=Ni0.4Mn0.4Co0.2,“532”,其中M=Ni0.5Mn0.3Co0.2,“622”,其中M=Ni0.6Mn0.2Co0.2等。
NMC的組成通常表征為(1)Li:M摩爾比,(2)鈷含量Co/M,以及(3)所謂的鎳過量(Ni-Mn)/M,如下:
(1):總體上接近Li與M的化學計量比,但是經常不恰好是一。如果Li:M增加,則在M層位點上Li代替M并且結構可以-簡化-書寫為Li1[M1-xLix]O2或Li1+xM1-xO2,其中Li:M=(1+x)/(1-x)。對于“111”和“442”,典型的Li:M接近于1.10;并且對于“622”,接近于1.02。增加該Li:M化學計量比的一個效果是改變了陽離子混合。陽離子混合是指以下事實:實際的晶體結構不恰好是分層的LiMO2或Li1[M1-xLix]O2,而是{Li1-x’Mx’}[M1-yLiy]O2,其中x’代表位于Li層位點的M原子,這導致了所謂的“陽離子混合”。在NMC中,我們通常觀察到某種程度的陽離子混合。據信陽離子混合阻礙了非常快的Li擴散,因此限制了NMC陰極材料的倍率性能和功率。
(2):鈷含量對于穩定良好分層的結構是重要的。如果該鈷含量Co/M小于約10-20mol%,則經常觀察到增加的陽離子混合。另一方面,鈷比Ni和Mn更貴,并且因此很多NMC陰極材料具有15-33mol%的鈷含量作為優化值。
(3):鎳過量是重要的化學計量參數。隨著(Ni-Mn)/M增加,可逆容量增加,但是同時該陰極材料變得越來越難以制備。其中Ni過量=0的“111”是穩固的材料,該材料可以容易地通過在高流通量的空氣流中燒結例如混合的NMC氫氧化物(例如從Ni-、Mn-和Co硫酸鹽的水溶液沉淀的)連同廉價的Li2CO3(作為鋰源)制備。高Ni陰極–如“811”-經常要求在純氧中在較低的流通量下燒結,并且更貴且更難以處理的LiOH*H2O必須代替Li2CO3用作鋰源。隨著增加Ni過量,越來越難以控制可溶堿的含量。高Ni材料傾向于具有非常高的堿含量,這對于很多應用來說是嚴重的問題。
可溶堿含量的背景:當將陰極材料LiMO2插入水中時,于是該水pH增加。該pH增加是由以下項導致的:
(a)表面雜質如Li2CO3和LiOH*H2O的溶解,
(b)表面分子/表面基團與水的反應,以及
(c)離子交換反應,其中存在于該材料本體的頂層的鋰按照以下反應交換質子:Li++H2O→H++LiOH。在稱為“pH滴定”的技術中,該pH增加被用于確定可溶堿含量。在一個典型的pH滴定實驗中,將一定量的陰極粉末(例如2.5g)加入一定量的水(例如100ml)中,在固定時間(例如10分鐘)期間攪拌該懸浮液,之后過濾。pH滴定本身表現出隨著加入的酸(例如0.1M HCl)的量而變的pH特征曲線。在許多情況下,該pH特征曲線可以基于碳酸鹽(Li2CO3)和氫氧化物(LiOH)的混合物的存在容易地解釋。通過某些操作,獲得LiOH堿、Li2CO3堿、BT(總堿)等的含量,如在例如WO 2012/107313(通過引用方式并入本文)中解釋的。
pH滴定是研究陰極材料的表面特性的敏感工具。由于陰極材料的電池性能取決于其表面特性-因為寄生反應(parasitary reaction)在電解質/顆粒接口發生-可以預期的-并且經驗已經證明-pH滴定是設計陰極材料的強大的工具。例如,在WO 2012/107313中示出了pH滴定結果很好地與很多全電池特性和電池制造特性相關聯。例如高的堿含量與以下項相關聯:
-增加的全電池膨脹(內部的氣體析出),其中典型試驗包括測量完全充電電池的厚度增加,以及
-具有不同粘合劑的電極漿料穩定性問題:在基于水的電極涂層以及基于NMP(N-甲基-2-吡咯啶酮)的電極涂層兩者中,高的堿含量導致多個問題如鋁箔腐蝕(對于基于水的涂層)或漿料粘度變化(對于基于NMP的涂層)。
對于便攜式應用,NMC尚未進入高端便攜式裝置,例如在用于智能手機的聚合物電池中。主要原因是或者體積能量密度太低(如果Ni過量遠低于20%)或者-如果容量是足夠的(如對于(遠)高于20%的Ni過量)-則高可溶堿含量導致膨脹,這是不能允許的。在低端便攜式應用中,NMC正在代替LiCoO2。
典型的示例是用于筆記本電腦的圓柱形或棱柱型電池。硬殼允許一些內部氣體析出,所有可以應用具有≥20%Ni過量的NMC。典型的電極試驗程序包括連續完全充電-放電循環,其中典型目標是在500次循環后超過80%的初始可逆容量。在其中使用高級高壓LiCoO2的一些應用中,充電電壓已經增加至4.35V或甚至4.4V。在全電池中NMC僅可以挑戰LiCoO2,如果該NMC可以穩定的方式在4.35V或甚至4.4V下循環。總結:用于便攜式應用的NMC陰極材料的重要特性包括在可接受的循環穩定性情況下的高容量和低膨脹。
對于汽車應用,此類電池比便攜式電池大并且因此更貴。因此,非常普遍地,與便攜式應用相比,對于陰極價格、循環穩定性和使用壽命的要求要苛刻的多得多。另外,電池可能在更高溫度下運行,因此對于高T循環穩定性的要求是更嚴格的。LiCoO2,由于其成本和有限的使用壽命,比NMC更不考慮作為汽車應用的陰極材料。典型試驗程序包括連續的完全充電-放電循環,其中在4.2V的充電電壓情況下,當在25℃下循環時以及在45℃下循環時兩種情況下,典型目標都是在2000次循環后超過80%的初始可逆容量。由于耐久的電池壽命要求,應用過程中的典型充電電壓甚至低于4.2V。以穩定方式在更高電壓下循環的NMC可能在其使用過程中對增加充電電壓有意義。汽車電池含有很多單元電池,此類單元電池由電池管理系統控制。為了降低系統成本,更簡單的電池管理系統是所希望的。成本的一個貢獻是確保此類單元電池在適當的溫度下運行的加熱/冷卻系統。在低溫下,該電池具有不足的功率,而在高溫下,循環穩定性成為問題。顯然,如果汽車陰極材料不僅支持25℃下的穩定循環而且支持在更高溫度下的穩定循環,該系統成本可以降低。
一些汽車應用(例如混合電動車輛或HEV)要求非常高的功率。這是因為再生制動和加速過程中的高充電/放電率。高功率輸出要求(1)高電子導電電極,(2)薄的電極以及(3)支持高充電/放電率的陰極材料。具有高Ni過量的NMC尤其適用于本專利申請,因為(1)電子導電性隨著Ni過量增加,(2)由于容量隨著Ni過量增加,電極可以制得更薄以及(3)功率(對于固定的Co化學計量)經常隨著Ni過量增加。總結:用于汽車應用的NMC陰極材料的重要特性包括在常溫(25℃)以及在高溫兩種情況下的高容量和良好的循環穩定性。
技術實現要素:
本發明的目的是提供具有Ni過量的NMC陰極材料,此類NMC陰極材料表現出高端便攜式應用和汽車應用所要求的改進特性。
概述
從第一方面來看,本發明可以提供用于可充電鋰電池的正電極材料,該正電極材料包括Li金屬(M)氧化物電活性材料以及0.15wt%和5wt%之間的LiNaSO4次級相。在一個實施方案中,M=Ni1-x-yM’xCoy,其中M’=Mn1-zAlz,0≤z≤1,0.1≤y≤0.4并且x+y≤0.5。在另一個實施方案中,1-y-2x>0.2。
根據本發明的一個實施方案,該Li金屬氧化物具有通式Li1+a’M1-aO2,其中a’<a并且0.9≤(1+a’)/(1-a)≤1.15,并且優選的是1≤(1+a’)/(1-a)≤1.10。根據另一個實施方案,該LiNaSO4次級相的質量分數在0.2wt%和2wt%之間,或甚至在0.3wt%和2wt%之間。
根據本發明的正電極材料可以由包括該Li金屬(M)氧化物的核和包括該LiNaSO4次級相的涂層組成。該正電極材料可以具有次級相,該次級相進一步包括高達1wt%的以下項中的任一種或多種:Al2O3、LiAlO2、LiF、Li3PO4、MgO和Li2TiO3。在一個實施方案中,該LiNaSO4涂層由包括Al2O3、LiAlO2、LiF和MgO中的任一種或多種的第二涂層覆蓋,并且其中該第二涂層代表高達1wt%的該材料。
在其他實施方案中,該Li金屬(M)氧化物摻雜有高達2mol%的以下項中的任一種或多種:Al、Ti、Mg和Zr;或該Li金屬(M)氧化物摻雜有高達0.2mol%的以下項中的任一種或多種:Ca、Sr、Si、F、P和K。清楚的是根據本發明的產品可以具有不同產品實施方案所涵蓋的特征。
從第二方面來看,本發明可以提供用于制備用于可充電鋰電池的正電極材料的方法,該方法包括以下步驟:
-提供Li金屬(M)氧化物電活性材料,
-提供無機的氧化化合物,
-提供化學品,該化學品為Li受體,
-將該Li金屬(M)氧化物、該氧化物和該Li受體混合,以及
-在含氧的氣氛(如空氣)中在300℃和800℃之間的溫度下加熱該混合物。如果在低于300℃的溫度下使氧化劑與該Li金屬(M)氧化物接觸,則沒有氧化反應發生,因為表面不足以對該氧作用做出反應。在約300℃下,該氧化劑-表面接口變成足夠反應性的,這樣使得實際上該氧化劑改變了表面特性。誘導的表面化學變化很可能是由表面氧化導致的,并且導致優異的電化學性能。
在一個實施方案中,該Li金屬氧化物具有通式Li1+a’M1-aO2,其中a’<a并且0.9≤(1+a’)/(1-a)≤1.15,并且M=Ni1-x-yM’xCoy,其中M’=Mn1-zAlz,0≤z≤1,0.1≤y≤0.4并且x+y≤0.5。在另一個實施方案中,該無機的氧化化合物為NaHSO5,或者以下項中的任一種:鉀、鈉、鋰、鎂、和鈣中的任一種的氯化物、氯酸鹽、高氯酸鹽以及次氯酸鹽。在還另一個實施方案中,該Li受體化學品為AlPO4、Li3AlF6和AlF3中的任一種。在一個具體的實施方案中,該無機的氧化化合物和該Li受體化學品兩者為相同的化合物,為Li2S2O8、H2S2O8和Na2S2O8中的任一種。在該正電極材料中,該Li金屬(M)氧化物在該混合物中的質量分數可以是在95wt%和99.8wt%之間。在根據本發明的方法中,可以干法過程將該Na2S2O8與該Li金屬(M)氧化物混合。納米級Al2O3粉末可以作為另外的Li受體化學品提供。在一個方法實施方案中,加熱溫度在300℃和600℃之間。優選的是,該加熱溫度在350℃和450℃之間。熱處理耗費至少1小時并且應該不耗費大于12小時。清楚的是,根據本發明的方法可以具有不同方法實施方案所涵蓋的特征。
本發明公開了用于陰極材料的處理-與未經處理的陰極材料相比-該處理允許改進循環穩定性和減少膨脹,意味著對于具有中等的(≥20%)至高的(≤80%)Ni過量的NMC陰極材料,將達到這種效果而不惡化容量。該處理對于在高溫(45℃)下和在更高的電壓(4.35V)下獲得良好的循環穩定性是特別有效的。
在此應該提及Zheng,Jun等人在CN 102208607A和“過硫酸鹽處理對Li[Li0.2Mn0.54Ni0.13Co0.13]O2陰極材料的電化學特性的影響(The effects of persulfate treatment on the electrochemical properties of Li[Li0.2Mn0.54Ni0.13Co0.13]O2cathode material)”(電源(Power Sources)221(2013)108-113)兩者中建議使用過硫酸鈉熱處理陰極材料,之后是清洗步驟以去除鹽產物。該處理的意圖是降低富鋰陰極材料的大的第一次循環的不可逆容量。在此處的這種方法不同于本發明中公開的方法。
首先,CN’607A公開了使用大量Na2S2O8,這樣使得提取足夠的Li。該專利要求加入至少5wt%的Na2S2O8,并且實施例加入了高達60wt%。然而,在本申請中,加入了小于3wt%,因為不建議提取顯著量的Li,此處目的是有效地氧化陰極表面。大量Li的提取將導致不希望的較低的容量。
第二,CN’607A集中于富Li陰極上。此類陰極(例如Li[Li0.2Mn0.54Ni0.13Co0.13]O2)與本專利申請的富Ni NMC相比,具有非常不同的特性。富Li陰極總體上具有相對高的Mn和相對低的Ni含量,導致小的、零或甚至負的Ni過量。本申請集中于具有過量Ni并且Li/M比接近于1的NMC。
第三,在CN’607A的方法中,以溶解態加入Na2S2O8,而本申請應用不同的方法。這導致非常不同的表面特性。Ni過量陰極的表面遭受到水處理(如在CN’607A中使用的)的損壞。例如,諸位作者觀察到Ni過量材料總體上在水暴露之后表現出差的循環穩定性,如果該暴露之后沒有高T(高于500℃)溫度處理以“修復”該表面。然而,此類溫度如此高以至于表面平衡,這樣使得Na2S2O8處理的氧化作用失去。
最后,CN’607A的方法包括陰極材料的洗滌步驟以去除Na2S2O8的反應產物,然而,在本專利申請中不考慮洗滌步驟的應用。此外,LiNaSO4次級相在該最終陰極中的存在為本發明的組成部分,該相在背景技術中沒有形成。
涉及過硫酸鈉的其他背景技術包括美國專利申請US2006/057466,其中K2S2O8溶液用于將M(OH)2前體氧化成MOOH。US’466公開了一種先進的沉淀方法,其中通過金屬(Co、Ni、Mn…)與氧化劑在LiOH存在下的反應使LiMO2直接沉淀。
另外背景技術:
-EP 2463942提供了具有組成LixMyO2的鋰混合的過渡金屬氧化物,其中鋰離子嵌入混合的過渡金屬氧化物層(“MO層”)和從其中脫嵌并且一些MO層衍生的Ni離子嵌入鋰離子的嵌入/脫嵌層(“可逆的鋰層”),由此導致MO層之間的互連。該鋰混合的過渡金屬氧化物基本上不含可溶于水的堿,并且由此可以提供優異貯存穩定性,減少的氣體析出以及因此優越的高溫穩定性。
-US 2012/070725提供了正電極材料,該正電極材料包括涂覆有無機涂覆組合物的鋰金屬氧化物,其中該涂覆組合物包括金屬氯化物、金屬溴化物、金屬碘化物、或其組合。
-US 2006/071198提供了粉狀的鋰過渡金屬氧化物,該氧化物包括鋰過渡金屬氧化物顆粒、在該顆粒的表面附近形成的陽離子摻雜的接口層、以及熱動力地和機械地穩定的外層。該摻雜的界面層為(i)該鋰過渡金屬氧化物和(ii)提供該陽離子的強鋰受體化合物的反應產物。
-US 2003/044684提供了非水性電解二次電池,該電池通過使用正活性材料,具有優異的循環壽命特性和高速率放電特性以及過充電時的安全性而不降低放電容量,該正活性材料是從含有Na和S的起始材料通過生產步驟例如合成后的水洗處理而得到的,并含有低于0.1重量百分數的硫酸根(SO42-),低于0.024重量百分數的Na和/或低于0.13重量百分數的硫酸鈉鋰(LiNaSO4)。
-在材料化學期刊(J.Mater.Chem.),2009,19,4965-4972中,Wang等人描述了分層的Li[Li0.2Mn0.54Ni0.13Co0.13]O2,它為分層的Li[Li1/3Mn2/3]O2與Li[Ni1/3Mn1/3Co1/3]O2之間的固溶體,通過具有2-5wt.%AlPO4、CoPO4和Al2O3的單層涂層和具有2wt.%AlPO4或2wt.%CoPO4內層和2-3.5wt.%Al2O3外層的雙層涂層進行表面改性。
-在電源期刊(Journal of Power Sources)2011,196,16期,6847-6855中,Song等人描述了如何使用基于Li3PO4的涂覆材料改性商業的Li[Ni0.4Co0.3Mn0.3]O2陰極的表面。
-在材料化學期刊A,2014,2,7555-7562中,Fu等人描述了涂覆有離子導體Li3VO4的Li1.18Co0.15Ni0.15Mn0.52O2表面的電化學性能和熱穩定性。
附圖說明
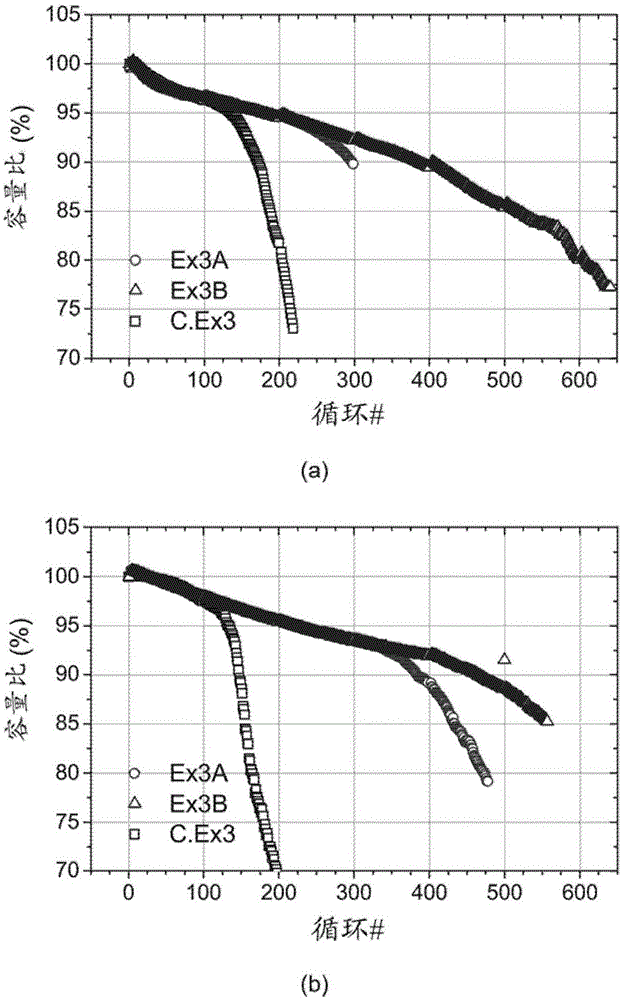
圖1:氧化的NMC(622)和正常的NMC(622)在(a)25℃和(b)45℃下的全電池循環壽命試驗結果。試驗電壓在4.2V和2.7V之間。
圖2:氧化的NMC(622)和正常的NMC(622)在(a)25℃和(b)45℃下的全電池循環壽命試驗結果。試驗電壓在4.35V和3.0V之間。
圖3:氧化的NMC(622)的XRD Rietveld精修。
圖4:氧化的NMC(622)的XRD測量:20-35°放大圖。
具體實施方式
在一個實施方案中,本發明集中于具有中等Ni過量的NMC。Ni過量是指Ni與錳含量之間的差異。典型的組合物包括NMC“532”和“622”,其中Ni過量分別是20mol%和40mol%。將陰極與過硫酸鈉Na2S2O8混合,過硫酸鈉Na2S2O8為“馬歇爾酸(Marshall’s acid)”(這還稱為過二硫酸,具有化學式H2S2O8的硫含氧酸)的鈉鹽并且是以大規模可供使用的化學品。Na2S2O8被稱為強氧化劑,與強陽離子接受特性有關。下面的實施例7證明根據以下反應方案,過硫酸鈉分解Li2CO3以形成LiNaSO4,由此釋放活性氧:
Na2S2O8+Li2CO3→2LiNaSO4+CO2+0.5O2 (1)
反應(1)可以解釋為Na2S2O8為鋰受體,它強到足以分解碳酸鋰。
如通常所說的,鋰過渡金屬陰極材料中的可溶堿原理可以理解為是由于水的Li接受特性-在簡化的圖像中-在用強鋰受體處理該陰極材料之后,所預期的是該可溶堿(如通過pH滴定測量的)減少,簡單地由于較少的成堿鋰將是可供使用的。
如以下將討論的,諸位作者相信對于制備改進的陰極材料,兩種特性-氧化和鋰接受特性-是強烈地希望的。在應用Na2S2O8之后,以下示意反應的一些為預期的:
1)根據反應(1)分解存在于陰極表面上的形成可溶堿的Li2CO3表面雜質
2)根據反應(2)和(3)分解存在于陰極表面上的形成可溶堿的LiOH或Li2O表面雜質
Na2S2O8+2LiOH→2LiNaSO4+H2O+0.5O2 (2)
Na2S2O8+Li2O→2LiNaSO4+0.5O2 (3)
3)通過源于反應(1)、(2)和(3)的活性氧氧化可還原的表面基團(例如羥基(hydroxile group)等)。非常簡化的反應:
2(MO-OH)+1/2O2→MO2+H2O (4)
4)從表面附近的晶體結構中部分提取Li,由此氧化過渡金屬M:示意地
y Na2S2O8+LiMO2→2y LiNaSO4+Li1-2yMO2 (5)
在陰極材料中,Li在室溫下已經是可移動的。在高于約300℃的溫度下,如果強氧化劑和鋰受體像Na2S2O8存在,則根據反應(1)-(5),該陰極材料表面將與高氧分壓平衡。然而,如果溫度太高(即>800℃),則本體將與氣相的氧分壓平衡,表面堿將朝向平衡值重新產生,并且表面氧電位將朝向此溫度下的在氮氣中的20%氧氣的電位平衡。在300℃和800℃之間存在范圍,其中反應(1)-(5)中形成的活性氧激烈地氧化該陰極的表面。這導致可溶堿的還原和全電池中的循環穩定性的改進。
多種方法可以用于Na2S2O8處理,獨自地或與涂覆相結合,如以下將描述的。此類方法包括:干涂(將亞微米或納米級粉末涂覆到NMC顆粒的表面上)、使用含有涂料前體以及Na2S2O8的溶液的噴涂、使用氧化物或磷酸鹽溶膠的噴涂、與溶液混合之后蒸發等。重要的是施用該涂覆之后的熱處理溫度為足夠高的以便分解可溶堿。同時,該溫度應該不是太高的以防止通過平衡氧分壓再產生該堿。典型的溫度超過300℃但是低于800℃,更優選的是它們低于600℃,最優選的是高于350℃但低于450℃。在此范圍內,反應以可接受的速率進行,由此不需要在更高的溫度下加熱該材料。
重要的方面是Na2S2O8的低熔點。在180℃下,該鹽熔化。該液體鹽的反應性比該固體的反應性大得多。所預期的是-隨著溫度升高-在該氧化和Li接受熔體與該陰極表面之間的起始反應導致該熔體對該表面的優異的潤濕。以此方式,將獲得良好涂層,即使在該Na2S2O8涂層本身不是完美地覆蓋該表面的干涂層而是混合情況下。
以上的反應(1)-(5)提出-在用Na2S2O8處理NMC陰極之后,最終的陰極材料與LiNaSO4共存。事實上,LiNaSO4在XRD衍射圖中被認定為少量的相。該少量的相可以容易地通過在水中的洗滌去除。然而,諸位作者已經發現:這種鈉雜質不需要去除;并且發現:這種少量相在最終電池中的存在似乎有助于進一步改進循環穩定性。
實施例1-3將示出在此范圍內處理的樣品在全電池內具有改進的高壓循環穩定性。改進循環穩定性的其他嘗試-如在具有低氧分壓氣體(例如空氣+N2混合物)中的處理、通過涂層(傾向于減少表面)(聚合物、碳等)的處理、從高溫淬火(這將導致較少的氧化表面)失敗了,并且事實上性能惡化。在沒有給出清楚證據下,諸位作者相信表面完全氧化對于全電池中的循環穩定性是有益的,尤其在高溫下以及在高壓下。
可溶表面堿的分解可以通過將使用Na2S2O8的處理與其他涂覆技術相結合進一步增強。例如-可以使Na2S2O8處理與AlF3(或Li3AlF6)、AlPO4、Al(OH)2或Al2O3處理相結合。氟化物、磷酸鹽、氧化物以及氫氧化物都是鋰受體,它們可以根據以下反應說明分解可溶堿并且同時產生氧化物Al2O3或LiAlO2表面膜:
2AlF3+3Li2CO3→6LiF+Al2O3+3CO2
2AlPO4+4Li2CO3→2Li3PO4+Al2O3+Li2CO3+3CO2
Al2O3+Li2CO3→2LiAlO2
2Al(OH)3+Li2CO3→2LiAlO2+3H2O+CO2
涂覆技術不限于鋁。其他可能的涂覆技術包括但不限于鎂、鈦、氟等。
如之前所報導,諸位作者相信以下項的組合作用是改進的電化學性能的原因:(a)根據反應(1)-(2)的可溶堿的分解以及(b)根據反應(3)-(5)的氧化。此類機理原則上可以通過使用類似的處理但用不同化學品實現。顯然的候選物為馬歇爾酸的Li鹽,Li2S2O8。然而,Na2S2O8為商業材料,Li2S2O8似乎不是可供使用的。然而,它可以容易地制備,例如通過用Li2CO3或LiOH中和馬歇爾酸,或通過應用其他適合的方法。諸位作者相信處理過的陰極材料的反應機理和性能是非常類似的,其中一個例外是–最終的陰極不含有該LiNaSO4少量相而是代替該LiNaSO4少量相,將存在顯著量的Li2SO4。
存在很多其他的潛在氧化化學品,并且重要的是選用的化學品為-或選用的化學品的混合物包括-(a)鋰受體和(b)氧化劑。所以任何氧化劑(優選的是選自無機化合物)與任何Li受體(也優選的是無機化合物)的混合物可以可能地實現類似的性能改進。適合的無機氧化劑的示例包括鉀、鈉、鋰、鎂、鈣等的氯化物、氯酸鹽、高氯酸鹽或次氯酸鹽;或過氧單硫酸鹽像例如NaHSO5。Li受體的示例包括例如AlPO4、Li3AlF6、AlF3等。
在以下實施例中對本發明進行進一步說明:在此類實施例中,使用以下分析技術:
a)通過pH滴定測量可溶堿含量:進行兩個步驟:(a)制備溶液,和(b)pH滴定。每個步驟的詳細說明如下:
步驟(a):制備溶液:在密封的玻璃燒瓶中將粉末浸入去離子水中并且攪拌10分鐘。使用2.5g的粉末和100ml的去離子水。攪拌后,溶解該堿,過濾粉末在水中的懸浮液以便獲得澄清的溶液。
步驟(b):pH滴定:使用90ml在步驟(a)中制備的澄清溶液用于通過使用0.1M HCl的pH滴定。流速為0.5ml/min并且每3秒記錄pH值。pH滴定特征曲線(隨著添加的HCl變化的pH值)示出兩個清楚的等當點(或拐點)。在約pH 8.4處的第一個等當點(對應于EP1的HCl量值)產生于OH-和CO32-與H+的反應。在約pH 4.7處的第二個等當點(對應于EP2的HCl量值)產生于HCO3-與H+的反應。假設溶解在去離子水中的堿是LiOH(具有2*EP1-EP2的量)或Li2CO3(具有2*(EP2-EP1)的量)。對于LiOH和Li2CO3,獲得的值為表面與去離子水的反應的結果。
以下定義用于數據分析:
LiOH(wt%)為LiOH的量相對于樣品的量的重量百分比。
Li2CO3(wt%)為Li2CO3的量相對于樣品的量的重量百分比。
總堿(μmol/g)為LiOH和Li2CO3相對于1克的樣品的量,即,中和1g陰極材料的堿所需要的以微摩爾表示的HCl的量。
b)XRD粉末衍射:用日本理學(Rigaku)X射線衍射儀(D/MAX-2200/PC)收集衍射圖。掃描速率設定為以1度/分進行的連續掃描。步長為0.02度。在15與85度之間進行掃描。為了獲得準確的晶格常數,掃描在17和144度之間,但是排除了沒有峰的范圍以節省測量時間。使用半自動TOPAS軟件通過Rietveld精修分析XRD圖。該TOPAS軟件給予準確的晶格常數。為了防止波動,自始至終將室溫保持在接近于24℃。
c)電化學試驗(鈕扣電池):通過以下步驟制備并且測試鋰離子二次鈕扣電池型電池:(a)制備正電極(b)鈕扣電池組件,以及(c)鈕扣電池測試。每個步驟的詳細說明如下:
步驟(a):制備正電極:通過均質化方法來制備含有該電化學活性材料、導體、粘合劑和溶劑的漿料。包括該電化學活性材料、導體和粘合劑的配方為90:5:5。導電炭黑(Super P,由特密高公司(Timcal)生產的)、PVDF聚合物(KF#9305,由吳羽公司(Kureha)生產的)、1-甲基-2-吡咯啶酮(NMP,由西格瑪奧德里奇公司(Sigma-Aldrich)生產的)分別用作導體、粘合劑的溶液、和溶劑。將此類材料通過使用均化器(HF-93,由傳動技術公司(SMT)生產的)在金屬杯中均勻化45分鐘。使用刮刀涂覆器將該均勻化的漿料鋪展在鋁箔的一側上。將它在120℃下在烘箱中干燥,使用壓延工具進行壓制,并且在真空烘箱中再次干燥以完全去除溶劑。
步驟(a)因此可以表述如下:用于制備用于可充電鋰電池的正電極的方法,該方法包括以下步驟:
-提供Li金屬(M)氧化物電活性材料,
-提供無機的氧化化合物,
-提供化學品,該化學品為Li受體,
-將該Li金屬(M)氧化物、該氧化物和該Li受體混合,以及
在含氧的氣氛中在300℃和800℃之間的溫度下加熱該混合物,由此獲得正電極材料,該正電極材料包括Li金屬(M)氧化物電活性材料以及0.15wt%和5wt%之間的LiNaSO4次級相,
-制備漿料,該漿料包括該正電極材料、導體、粘合劑和溶劑,
-將該漿料鋪展在鋁箔的一側上,
-在烘箱中干燥該箔片,
-使用壓延工具壓制該干燥的箔片,
-在真空烘箱中干燥該壓制的箔片,由此去除溶劑。
步驟(b):鈕扣電池組裝:在手套箱中組裝鈕扣電池,該手套箱填充有惰性氣體(氬氣)。將隔膜(SK創新公司(SK Innovation))定位在該正電極與用作負電極的一片鋰箔之間。EC/DMC(1:2)中的1M LiPF6用作電解質,在隔膜與電極之間滴下。
步驟(c):鈕扣電池測試:本發明中鈕扣電池試驗遵循表1中示出的程序。C-倍率可以定義為用于充電或放電160mAh/g的小時的倒數。例如,5C是指800mA/g的電流并且此電流將在1/5小時內使該電池完全充電或放電。“E-電流(E-Curr)”和“V”分別代表終止電流和截止電壓。在第一循環中,測定了DQ1(第一循環的放電容量)和IRRQ(不可逆容量)。該倍率性能可以從第二至第六循環來計算。將第七循環重復五十次以獲得關于循環壽命的信息。以下定義用于數據分析:
-CQ1(充電容量)和DQ1(放電容量)為第一次循環過程中的容量。
-IRRQ(不可逆容量)為第一次循環過程中不可逆容量相對于充電容量的比率。
-每100次循環的衰減速率為在100次循環后的衰減的放電容量的比率。這個值為來自25次循環后的衰減速率的內插值。
表1.鈕扣電池試驗的循環一覽表
實施例1:氧化分層的NMC(622)材料
在本實施例中使用商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司(Umicore))作為裸材料。氧化處理由干混-用Na2S2O8(過硫酸鈉)涂覆陰極材料,接著熱處理組成。在本實施例中,使用3D管式混合器在小的具有ZrO2球的塑料瓶中將1.8wt%的Na2S2O8與NMC(622)材料共混(50g規模)。
比較例1(C.Ex1):分層的NMC(622)材料
在本實施例中使用相同的商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司)作為裸材料。以與實施例1中相同方式進行試驗,除了不加入Na2S2O8并且不使其與該裸材料共混之外。比較例1進一步給出用于實施例1的熱處理參考樣品。
表2示出了實施例1和比較例1中的樣品的pH滴定和紐扣型電池試驗(如之前所述)結果。Ex1為加熱之前C.Ex1和Na2S2O8的混合物。Ex1A和Ex1B分別是在200℃和400℃下加熱Ex1 5小時之后的材料。為了比較,將C.Ex1也在200℃和400℃下加熱5小時,分別產生C.Ex1A和C.Ex1B。與C.Ex1相比,Ex1具有更低的放電容量和類似堿含量值。然而,此堿含量顯著降低并且容量通過400℃下的熱處理恢復。另外,循環壽命改進很多。Ex1B事實上示出最佳的整體結果。Ex1B與C.Ex1B之間的比較示出此類改進的特性不是僅熱處理的作用,而是它是與Na2S2O8共混的結果。
表2.實施例1和比較例1的pH滴定和紐扣型電池試驗的結果
實施例2:氧化分層的NMC(532)材料
在本實施例中使用商業Li1.01(Ni0.5Mn0.3Co0.2)0.99O2(Cellcore TX10,優美科公司)作為裸材料。氧化處理由用Na2S2O8(過硫酸鈉)干涂覆陰極材料,接著熱處理組成。在本實施例中,使用5L的亨舍爾(Henschel)型混合器將1.8wt%的Na2S2O8與分層的NMC(532)材料共混(4kg規模)。共混后,將該混合物在375℃下加熱5小時。為了比較,C.Ex2為一種商業Li1.01(Ni0.5Mn0.3Co0.2)0.99O2(Cellcore TX10,優美科公司)的裸材料。表3示出了實施例2和比較例2中的樣品的pH滴定和紐扣型電池試驗結果。與實施例1中類似,在氧化處理(與Na2S2O8共混和熱處理)后觀察到降低的堿含量和改進的電化學特性。
表3.實施例2和比較例2的pH滴定和紐扣型電池試驗的結果
實施例3:鋁涂覆的和氧化分層的NMC(622)材料
將氧化處理施加到2種樣品上:
1)在本實施例中使用商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G3-HX12,優美科公司)作為裸材料。
2)一定量的商業G3-HX12,它通過與Al2O3共混而干涂覆(每kg陰極1000ppm)。
氧化處理由用Na2S2O8(過硫酸鈉)干涂覆陰極材料,接著熱處理組成。在本實施例中,使1.8wt%的Na2S2O8分別與該裸材料或Al2O3干涂覆材料共混。在與Na2S2O8共混后,將2kg混合物在375℃下加熱5小時。表4示出了實施例3和比較例3中的樣品的pH滴定和紐扣型電池試驗結果。C.Ex3為一種商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G3-HX12,優美科公司)的裸材料。Ex3A為氧化的NMC(622)材料并且Ex3B為鋁涂覆的且氧化的NMC(622)材料。與C.Ex3相比,Ex3A和Ex3B兩者均具有顯著降低的堿含量和改進的循環壽命。此外,與鋁共混導致甚至更改進的循環壽命,而沒有顯著容量損失。
表4.實施例3和比較例3的pH滴定和紐扣型電池試驗的結果
實施例4:氧化的NCA材料
在本實施例中使用商業的1.5mol%Al摻雜的Li(Ni0.85Co0.15)O2,稱為“NCA”(Cellcore QX,優美科公司)作為裸材料。氧化處理由用Na2S2O8(過硫酸鈉)干涂覆陰極材料,接著熱處理組成。在本實施例中,使用3D管式混合器在小的具有ZrO2球的塑料瓶中將不同量的Na2S2O8與NCA材料共混(50g規模)。共混后,在含氧的氣氛中將該混合物在375℃下加熱5小時。
表5示出了實施例4和比較例4中的樣品的pH滴定和紐扣型電池試驗結果。C.Ex4為商業的Al摻雜的Li(Ni0.85Co0.15)O2(Cellcore QX,優美科公司)的裸材料。使C.Ex4與0.3wt%、0.7wt%、1.2wt%、和1.8wt%的Na2S2O8共混并且加熱,分別產生Ex4A、Ex4B、Ex4C和Ex4D。Na2S2O8的引入總是導致降低的堿含量,并且該降低隨著Na2S2O8的量增加而增加。NCA材料的紐扣型電池循環穩定性試驗在4.3V-3.0V下進行。對于不同量的Na2S2O8添加,放電容量和循環穩定性的趨勢是不同的。當Na2S2O8的量增加時,放電容量降低并且循環穩定性改進。取決于應用,可以優化Na2S2O8的量以找到容量與循環穩定性能之間的平衡。
表5.實施例4和比較例4的pH滴定和紐扣型電池試驗的結果
實施例5:全電池試驗
使用實施例3的樣品,制備全電池。石墨型陽極用作對電極。此類全電池的典型容量為640mAh并且此值用于確定每個C-倍率下的電流。陰極材料和陽極材料的負載量分別是12.8mg/cm2和7.8mg/cm2。該實施例示出(a)膨脹試驗和(b)循環壽命試驗的結果。
詳細的程序如下:
(a)膨脹試驗:將完全充電的電池存儲在90℃下的烘箱中持續4小時。活性材料與電解質之間的反應在全電池中產生了氣體,導致電池厚度的增加(膨脹)。在存儲在該烘箱中前后測量此類全電池的厚度。報告值為增加的全電池厚度相對于初始厚度的比率(以%增加表示)。
(b)循環壽命試驗:使此類全電池在4.2V和2.7V之間或在4.35V至3.0V之間循環數百次以測量循環過程中的容量衰減。使用32mA的截止電流以1C倍率以恒電流/恒電壓(CC/CV)模式進行充電,并且以1C倍率以CC模式進行放電。在室溫(25℃)下并且在高溫(45℃)下進行循環壽命試驗。
表6示出了Ex3A、Ex3B和C.Ex3的膨脹試驗結果。通常,膨脹率與堿含量有關。氧化處理導致顯著地降低的堿含量,相應地導致降低的膨脹率。
表6.實施例3和比較例3的膨脹試驗結果。
圖1和表7a示出了Ex3A、Ex3B和C.Ex3在25℃(圖1(a))和45℃(圖1(b)-注意Ex 3A和B的結果重疊)下、在第200、400、800和1200循環之后的額定電壓(4.2V-2.7V)循環壽命試驗結果(此類圖甚至更進一步)。45℃下的循環壽命試驗是加速試驗以研究在真實的工作條件下的特性。在此類試驗中在25℃和45℃兩者下通過氧化處理改進了循環壽命。在該NMC(622)材料上具有Na2S2O8的Al2O3涂覆導致室溫下的更改進的循環壽命。在圖1(a)和(b)中,頂線是對于Ex3B的,與中間對于Ex3A的部分地重疊,底線是對于C.Ex3的。
表7a.實施例3和比較例3的在每200次循環(在4.2V與2.7V之間循環)時的全電池試驗的容量比
圖2和表7b示出了Ex3A、Ex3B和C.Ex3在25℃(圖2(a))和45℃(圖2(b))下、在第100、200、300和400循環之后的高壓(4.35V-3.0V)循環壽命試驗結果(此類圖甚至示出更多)。在此類試驗中在25℃和45℃兩者下通過氧化處理還改進了高壓試驗時的循環壽命。在該NMC(622)材料上具有Na2S2O8的Al2O3涂覆導致室溫下的更改進的循環壽命。在氧化的NMC(622)的情況下,甚至高溫(45℃)下的循環穩定性也比室溫(25℃)下的更好。在圖2(a)中,頂線是對于Ex3B的,中間的是對于Ex3A的,底線是對于C.Ex3的。在圖2(b)中,頂線是Ex3B和Ex3A的兩條線的重疊,底線是對于C.Ex3的。
表7b.實施例3和比較例3的在每200次循環(在4.35V與3.0V之間循環)時的全電池試驗的容量比
實施例6:浮動電流試驗
使用實施例3的樣品,制備全電池。石墨型陽極用作對電極。該實施例示出浮動電流(floating current)試驗的結果。
詳細的程序如下:
(a)浮動電流試驗:在50℃下通過CC/CV模式(恒電流和恒電壓)使一個全電池充電直到4.6V并且將該電壓保持6天(144小時)。可以將隨著時間變化的電流值轉換成容量值,稱為“總容量”。
(b)陽極ICP:在該浮動試驗之后,拆卸該全電池。陽極側中的金屬的量通過ICP(電感耦合電漿)方法測量。
表8示出了實施例3和比較例3的浮動電流試驗和陽極ICP的結果。Ex3A和Ex3B具有比C.Ex3低的總容量。高的總容量意味著在完全充電存儲過程中在活性材料與電解質之間存在不必要的反應。清楚地,氧化處理防止了全電池中的不必要的反應。另外,Ex3A和Ex3B在拆卸的陽極中具有比C.Ex3低的Ni含量。通常,該“總容量”與陰極材料的金屬溶解很好地關聯。該金屬溶解可能引起安全問題和差的開路電壓。通過氧化處理,有效地降低了該金屬溶解。
表8.浮動電流試驗的相對總容量和拆卸的陽極中的Ni含量
該相對總容量以相對于比較例的%表示,這意味著對于Ex3A和3B,分別需要僅57.5%或46.6%的容量來保持在4.6V下的充電電池的高電壓。
實施例7:氧化的NMC(622)的XRD分析:
在Ex3A(氧化的Li1.01(Ni0.6Mn0.2Co0.2)0.99O2)上進行XRD測量(如之前所述)。對于Rietveld精修,LiNaSO4的晶體結構通過遵循文獻(例如,在Morosin等人,“硫酸鈉鋰的晶體結構(The Crystal Structure of Lithium Sodium Sulfate)”,晶體學報(Acta Crystallographica)22(1967)906-910中)確定。在此,LiNaSO4的空間群為P31c并且晶格常數a和c分別是和圖3示出了Rietveld精修的結果。該精修結果清楚地示出了除了正常分層的NMC域之外的LiNaSO4的存在。LiNaSO4的精修的晶格常數a和c為和這示出了與以上文獻的良好一致。圖4示出了具有線性量值標度具有從20°至35°放大視圖的衍射圖,該圖也清楚地示出了LiNaSO4的存在。
實施例8:氧化處理過程
對于共混Na2S2O8和陰極材料,兩種過程是可能的:干法過程和濕法過程。該干法過程是指使用共混裝置,將干燥的Na2S2O8-優選的是亞微米級-顆粒與陰極材料共混,如Ex.1-3中所說明的。濕法過程是指將Na2S2O8溶液與陰極材料共混。在本實施例中,對于干法過程,使用3D管式混合器在一個小的具有ZrO2球的塑料瓶中將1.8wt%的Na2S2O8粉末與Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司)共混(50g規模)。共混后,將該混合物在400℃下加熱5小時。對于濕法過程,使用頂置式攪拌器在圓形容器中將1.8wt%的Na2S2O8溶液與Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司)共混(1kg規模)。
將40wt%的H2O加入該G2-HX12中用于制造該混合物的漿料。在共混后,將該漿料在120℃下在常規爐中干燥12小時并且將該干燥的材料在400℃下加熱5小時。
表9示出了實施例8和比較例8中的樣品的pH滴定結果,后者為商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司)的裸材料。Ex8A使用干法過程并且Ex8B是使用濕法過程的材料。與C.Ex8相比,Ex8A和Ex8B具有降低的堿含量。示出的是對于降低Li2CO3含量,干法過程比濕法過程更有效。LiNaSO4的衍射峰在XRD衍射圖中檢測到。
表9.實施例8和比較例8的pH滴定結果
實施例9:高溫處理
在這個實施例中使用商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司)作為裸材料。氧化處理由用Na2S2O8(過硫酸鈉)干涂覆陰極材料,接著熱處理組成。在本實施例中,使用3D管式混合器在小的具有ZrO2球的塑料瓶中將1.8wt%的Na2S2O8與NMC(622)材料共混(50g規模)。在共混后,將該混合物在400℃或者800℃下加熱5小時以便確定適當的氧化處理的溫度范圍。
表10示出了實施例9和比較例9中樣品的pH滴定和紐扣試驗的結果,后者為商業Li1.01(Ni0.6Mn0.2Co0.2)0.99O2(Cellcore G2-HX12,優美科公司)的裸材料。Ex9A和Ex9B是共混后在400℃和800℃下加熱的材料。與Ex9A相比,Ex9B示出了高的堿含量和低的放電容量。此類數據示出如果在過高溫度下進行熱處理,則不是所有的氧化處理的有益效果都被獲得(衰減速率是良好的)。
表10.實施例9和比較例9的pH滴定和紐扣型電池試驗的結果。
- 還沒有人留言評論。精彩留言會獲得點贊!