電解液和電池的制作方法
本發明屬于電化學儲能領域,具體涉及一種電解液以及利用該電解液的電池。
背景技術:
鉛酸電池,其出現已超百年,擁有著成熟的電池技術,占據著汽車啟動電瓶、電動自行車、UPS等儲能領域的絕對市場份額。鉛酸電池雖然循環使用壽命較低,能量密度也相對較低,但卻擁有價格非常低廉,性價比非常高的優點。因此,近些年來,鎳氫電池、鋰離子電池、鈉硫電池、液流電池等,均無法在儲能領域取代鉛酸電池。
近幾年來出現一種新型水系二次電池。該二次電池的負極能夠基于第一金屬離子進行可逆的還原沉積-氧化溶解反應,正極能夠基于第二金屬離子進行可逆的脫出-嵌入反應,電解液含有參與負極沉積-溶解反應的第一金屬離子和參與正極脫出-嵌入反應的第二金屬離子。該類型電池的電解液為水溶液,不存在類似鋰離子電池中有機電解液的安全隱患,且對環境友好,成本較低,能量密度高。因此,該類型電池非常有希望成為替代鉛酸電池的下一代儲能電池,具有極大的應用價值。
但是,目前該電池在充放電過程中,副反應較多,導致電池的自放電、浮充、倍率等性能下降。
技術實現要素:
本發明所要解決的技術問題是提供一種電解液,能夠減少正極和負極的副反應,從而改善電池性能。
為解決上述技術問題,本發明所采用的技術方案如下:一種電解液,所述電解液的溶劑為水,所述電解液包括能在負極可逆氧化溶解和還原沉積的第一金屬離子,所述電解液還包括添加劑胍鹽,所述胍鹽可以在所述電解液中電離產生胍陽離子。
優選地,所述胍陽離子在所述電解液中的質量百分比在0.01%-0.5%范圍內。
優選地,所述添加劑胍鹽為鹽酸胍、硝酸胍或者硫酸胍。
優選地,所述第一金屬離子包括鋅離子、鐵離子、錳離子、鉻離子、銅離子和鎳離子中的一種。
優選地,所述電解液還包括第二金屬離子,所述第二金屬離子在充放電過程中在正極能夠可逆脫出-嵌入。
優選地,所述第二金屬離子包括鋰離子、鈉離子或鎂離子中的一種。
優選地,所述電解液的pH值范圍為3-7。
優選地,所述電解液還包括硫酸根離子、氯離子、溴離子、醋酸根離子、硝酸根離子、碳酸根、甲酸根離子和烷基磺酸根離子中的一種或幾種。
本發明所要解決的另一個技術問題在于提供一種電池,提高電池的循環壽命,以使其更好的適用于能源設備上。
為實現上述目的,本發明所采用的技術方案如下:一種電池,包括正極、負極和電解液,所述電解液為上述的電解液。
優選地,所述正極包括能夠可逆脫出-嵌入金屬離子的正極活性物質。
與現有技術相比,本發明的有益效果是:具有該電解液的電池能夠減少正極和負極的副反應,從而能使浮充電流降低,克容量提高,倍率性能提升,發揮出更好的電池性能。
附圖說明
圖1為實施例1及對比例1提供的電池在室溫下分別依次以0.2C、0.5C、1C、2C、4C、0.2C倍率進行恒流充放電5次后的倍率性能;
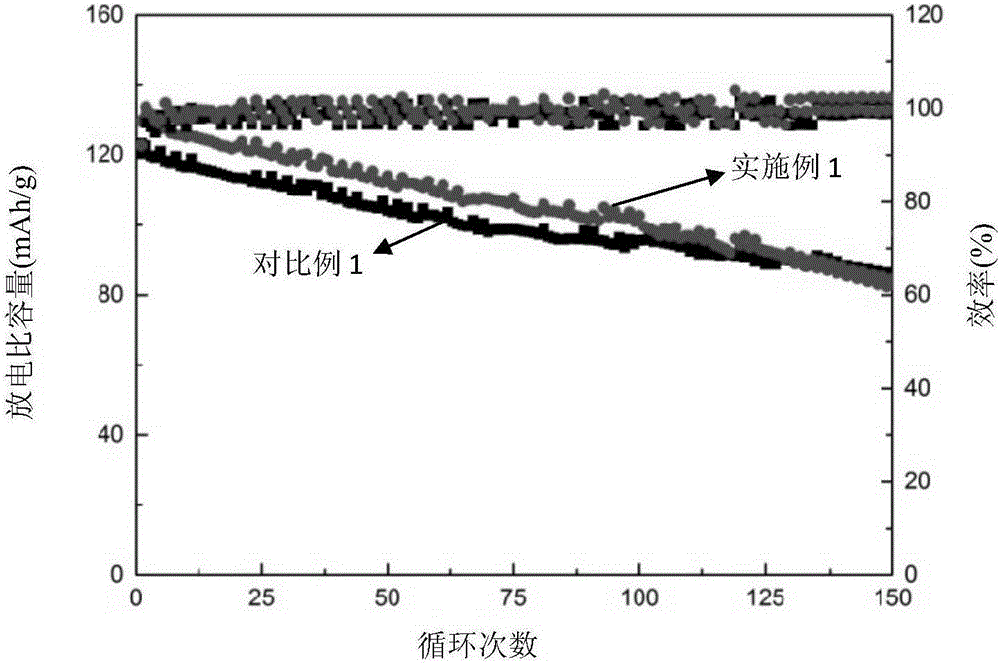
圖2為實施例1及對比例1提供的電池在1C倍率下放電容量、電池效率與循環次數關系圖;
圖3為實施例1及對比例1提供的電池在2.1V下浮充24h的浮充電流密度;
圖4為實施例1及對比例1提供的電池放置24h的開路電壓;
圖5為實施例2及對比例2提供的電池在4C倍率下放電容量、電池效率與循環次數關系圖;
具體實施方式
為了使本發明所解決的技術問題、技術方案及有益效果更加清楚明白,以下結合實施例,對本發明進行進一步詳細說明。應當理解,此處所描述的具體實施例僅僅用以解釋本發明,并不用于限定本發明。
一種電解液,包括第一金屬離子。該第一金屬離子在充電過程中在負極還原沉積為第一金屬,在放電過程中可逆氧化溶解為第一金屬離子。電解液還包括添加劑胍鹽。
電解液包括電解質以及溶劑。其中,電解液中溶劑的目的是溶解電解質,并使電解質在溶劑中電離,最終在電解液中生成可自由移動的陽離子和陰離子。本發明中溶劑優選為水溶液。
電解液中的第一金屬離子,在充電過程中在負極能夠還原沉積為第一金屬,在放電過程中第一金屬可逆氧化溶解為第一金屬離子。即在電池充電時,電解液中的第一金屬離子還原成第一金屬,沉積在負極上;在電池放電時,第一金屬又重新氧化成為第一金屬離子并從負極上溶出,進入電解液。優選的,第一金屬離子包括鋅離子、鐵離子、錳離子、鉻離子、銅離子或鎳離子中的一種。更優選的,第一金屬離子為鋅離子。
在一優選實施方式中,電解液還包括在充放電過程中在正極能夠可逆脫出-嵌入的第二金屬離子。即在電池充電時,第二金屬離子從正極活性物質中脫出,進入電解液;在電池放電時,電解液中的第二金屬離子嵌入正極活性物質中。優選的,第二金屬離子選自鋰離子、鈉離子或鎂離子。更優選的,第二金屬離子為鋰離子。
在一優選實施方式中,電解液中包括鋰離子和鋅離子。在充放電過程中,鋰離子在正極發生嵌入-脫出,鋅離子在負極發生沉積-溶解。
在一優選實施方式中,電解液中還包括一種在電池正極發生氧化還原反應的離子。在電池充電時,電解液中的該離子被氧化;電池放電時,充電時被氧化的活性物質又被還原。優選的,該離子選自溴離子、釩離子中的至少一種。
在一優選實施方式中,電解液中包括溴離子和鋅離子。在充放電 過程中,溴離子在正極發生氧化-還原反應,鋅離子在負極發生沉積-溶解。
電解液中還包括添加劑胍鹽。胍鹽可以在電解液中電離出胍陽離子。優選地,胍陽離子具有以下通式:
胍陽離子還包括上述通式的衍生物。本發明通過胍陽離子減少正負極的副反應,從而提高電池的性能。
電解液中加入添加劑胍鹽,胍鹽在電解液中電離產生胍陽離子,胍陽離子會一方面吸附在負極表面,減少金屬負極的腐蝕、枝晶和產氣,另一方面也可以吸附到正極表面,起到機械隔離作用,減緩了電解液對導電劑的腐蝕。通過加入胍陽離子,還抑制了電解液中水的分解,減少了氣體的產生,提高了電池的安全性能。因此,電池的浮充性能、倍率性能、克容量等電化學性能得到提高。
優選地,胍鹽在所述電解液中的質量百分比在0.01%-0.5%范圍內。
在一優選實施例中,電解液添加劑胍鹽為鹽酸胍。優選地,鹽酸胍的加入量占電解液總量的質量分數為0.2%。
在一優選實施例中,電解液添加劑胍鹽為硝酸胍或者硫酸胍。當然,其它如碳酸胍、甲酸胍、溴化胍等能在電解液電離出胍陽離子的化合物也是本發明的優選添加劑。
添加劑加入電解液中的方式不限,可以是與電解質一起加入溶劑;可以是在電解質之前加入溶劑;也可以是在電解質之后加入溶劑。
電解液中的陰離子,可以是任何基本不影響正負極反應、以及電解質在溶劑中溶解的陰離子。例如可以是硫酸根離子、氯離子、醋酸根離子、硝酸根離子、磷酸根離子、甲酸根離子、烷基磺酸根離子及其混合等。
電解液中各離子的濃度,可以根據不同電解質、溶劑、以及電池的應用領域等不同情況而進行改變調配。
優選的,在電解液中,第一金屬離子的濃度為0.1~10mol/L。
優選的,在電解液中,第二金屬離子的濃度為0.5~15mol/L。
優選的,在電解液中,陰離子的濃度為0.5~12mol/L。
為了使電池性能更加優化,電解液的pH值范圍為3~7。pH的范圍可以通過緩沖劑來調劑。電解液的pH過高,可能會影響電解液中鋅離子的濃度,電解液的pH過低,則會加劇電極材料的腐蝕。而將電解液的pH范圍保持在3~7,既可以有效保證電解液中金屬離子的濃度,還可以避免電極腐蝕。
本發明還提供了一種電池,包括正極、負極和水系電解液,其中電解液為上述的電解液。在本發明優選實施方式下,所述第一金屬離子在負極上能夠發生可逆的還原沉積-氧化溶解反應;所述正極包括能夠可逆脫出-嵌入第二金屬離子的正極活性物質;所述電解液包括第一金屬離子和第二金屬離子,充放電過程中,所述第一金屬離子在負極能夠還原沉積為第一金屬且第一金屬能可逆氧化溶解為第一金屬離子,所述第二金屬離子能夠在正極可逆脫出-嵌入。
電池的充放電原理為:充電時,正極活性物質脫出第二金屬離子,同時伴隨正極活性物質被氧化,并放出電子;電子經由外電路到達電池負極,同時電解液中的第一金屬離子在負極上得到電子被還原,并沉積在負極上。放電時,沉積在負極上的第一金屬被氧化,失去電子轉變為第一金屬離子進入電解液中;電子經外電路到達正極,正極活性物質接受電子被還原,同時第二金屬離子嵌入正極活性物質中。
電池的負極能夠發生可逆的還原沉積-氧化溶解反應。充電時,電解液中的第一金屬離子能夠在負極側被還原為第一金屬,并沉積在負極上,放電時,沉積在負極上的第一金屬被重新氧化成第一金屬離子進入電解液中。優選的,第一金屬離子為鋅離子。此時,電池的負極材料根據結構以及作用的不同,又可以分為以下三種不同的形式:
在第一優選實施方式中,負極僅包括負極集流體,并且負極集流體僅作為電子傳導和收集的載體,不參與電化學反應。
負極集流體的材料選自金屬Ni、Cu、Ag、Pb、Mn、Sn、Fe、Al或經過鈍化處理的上述金屬中的至少一種,或者單質硅,或者碳基材料;其中,碳基材料包括石墨材料,比如商業化的石墨壓制的箔,其中石墨所占的重量比例范圍為90~100%。負極集流體的材料還可以選自不銹鋼或經鈍化處理的不銹鋼。不銹鋼包括但不僅限于不銹鋼網和 不銹鋼箔,同樣的,不銹鋼的型號可以是300系列的不銹鋼,如不銹鋼304或者不銹鋼316或者不銹鋼316L。另外,負極集流體還可以選自含有析氫電位高的鍍/涂層的金屬,從而降低負極副反應的發生。鍍/涂層選自含有C、Sn、In、Ag、Pb、Co的單質,合金,或者氧化物中至少一種。鍍/涂層的厚度范圍為1~1000nm。例如:在銅箔或石墨箔的負極集流體表面鍍上錫,鉛或銀。
在第二優選實施方式中,負極除了負極集流體,還包括負載在負極集流體上的負極活性物質金屬。
優選的,負極活性物質為金屬鋅。
其中,負極集流體可以參考第一優選實施方式,在此不再贅述。
負極活性物質以片狀或者粉末狀存在。
當采用片狀的負極活性物質時,金屬片與負極集流體形成復合層。
當采用粉末狀的負極活性物質時,將金屬粉末制成漿料,然后將漿料涂覆在負極集流體上制成負極。具體的實施方式中,制備負極時,除了負極活性物質金屬粉末之外,根據實際情況,還根據需要添加負極導電劑和負極粘結劑來提升負極的性能。
在第三優選實施方式中,直接采用金屬片作為負極,金屬片既作為負極集流體,同時也為負極活性物質。
在一優選實施方式中,正極包括能夠可逆脫出-嵌入第二金屬離子的正極活性物質,優選的,第二金屬離子選自鋰離子、鈉離子或鎂離子。更優選的,第二金屬離子為鋰離子。
優選的,正極活性物質具有尖晶石結構、層狀結構或橄欖石結構。
正極活性物質可以是符合通式Li1+xMnyMzOk的能夠可逆脫出-嵌入鋰離子的尖晶石結構的化合物,其中,-1≤x≤0.5,1≤y≤2.5,0≤z≤0.5,3≤k≤6,M選自Na、Li、Co、Mg、Ti、Cr、V、Zn、Zr、Si、Al中的至少一種。優選的,正極活性物質含有LiMn2O4。更優選的,正極活性物質含有經過摻雜或包覆改性的LiMn2O4。
正極活性物質可以是符合通式Li1+xMyM′zM″cO2+n的能夠可逆脫出-嵌入鋰離子的層狀結構的化合物,其中,-1<x≤0.5,0≤y≤1,0≤z≤1,0≤c≤1,-0.2≤n≤0.2,M,M′,M″分別選自Ni、Mn、Co、Mg、Ti、Cr、V、Zn、Zr、Si或Al的中至少一種。優選的,正極活性物質 含有LiCoO2。
正極活性物質還可以是符合通式LixM1-yM′y(XO4)n的能夠可逆脫出-嵌入鋰離子的橄欖石結構的化合物,其中,0<x≤2,0≤y≤0.6,1≤n≤1.5,M選自Fe、Mn、V或Co,M′選自Mg、Ti、Cr、V或Al的中至少一種,X選自S、P或Si中的至少一種。優選的,正極活性物質含有LiFePO4。
目前電池工業中,幾乎所有正極活性物質都會經過摻雜、包覆等改性處理。但摻雜,包覆改性等手段造成材料的化學通式表達復雜,如LiMn2O4已經不能夠代表目前廣泛使用的“錳酸鋰”的通式,而應該以通式Li1+xMnyMzOk為準,廣泛地包括經過各種改性的LiMn2O4正極活性物質。同樣的,LiFePO4以及LiCoO2也應該廣泛地理解為包括經過各種摻雜、包覆等改性的,通式分別符合LixM1-yM′y(XO4)n和Li1+xMyM′zM″cO2+n的正極活性物質。
正極活性物質為能可逆脫出-嵌入鋰離子的物質時,優選可以選用如LiMn2O4、LiFePO4、LiCoO2、LiMxPO4、LiMxSiOy(其中M為一種變價金屬)等化合物。
此外,可脫出-嵌入鈉離子的化合物NaVPO4F,可脫出-嵌入鎂離子的化合物MgMxOy(其中M為一種金屬,0.5<x<3,2<y<6)以及具有類似功能,能夠脫出-嵌入離子或官能團的化合物都可以作為本發明電池的正極活性物質,因此,本發明并不局限于鋰離子電池。
在具體的實施方式中,制備正極材料時,除了正極活性物質之外,通常還會添加正極導電劑和正極粘結劑來提升正極的性能。在正極材料中使用導電劑的目的是降低整體正極的電阻,同時加強正極材料顆粒之間的導電通路。正極導電劑選自導電聚合物、活性碳、石墨烯、碳黑、石墨、碳纖維中的一種或幾種。粘結劑有利于使正極活性物質和導電劑均勻的粘結在一起,從而加工形成正極。正極粘結劑可以選自聚乙烯氧化物、聚丙烯氧化物,聚丙烯腈、聚酰亞胺、聚酯、聚醚、氟化聚合物、聚二乙烯基聚乙二醇、聚乙二醇二丙烯酸酯、聚乙二醇二甲基丙烯酸中的一種、或上述聚合物的混合物及衍生物。更優選的,正極粘結劑選自聚四氟乙烯(PTFE)、聚偏氟乙烯(PVDF)或丁苯橡膠(SBR)。
具體的,正極還包括負載正極活性物質的正極集流體,正極集流體僅作為電子傳導和收集的載體,不參與電化學反應,即在電池工作電壓范圍內,正極集流體能夠穩定的存在于電解液中而基本不發生副反應,從而保證電池具有穩定的循環性能。
正極集流體的材料選自碳基材料、金屬或合金中的一種。
碳基材料選自玻璃碳、石墨箔、石墨片、泡沫碳、碳氈、碳布、碳纖維中的一種。
金屬包括Ni、Al、Fe、Cu、Pb、Ti、Cr、Mo、Co、Ag或經過鈍化處理的上述金屬中的一種。
合金包括不銹鋼、碳鋼、Al合金、Ni合金、Ti合金、Cu合金、Co合金、Ti-Pt合金、Pt-Rh合金或經過鈍化處理的上述金屬中的一種。
不銹鋼包括不銹鋼網、不銹鋼箔,不銹鋼的型號包括但不僅限于不銹鋼304或者不銹鋼316或者不銹鋼316L中的一種。
優選的,對正極集流體進行鈍化處理,其主要目的是,使正極集流體的表面形成一層鈍化的氧化膜,從而在電池充放電過程中,能起到穩定的收集和傳導電子的作用,而不會參與電池反應,保證電池性能穩定。正極集流體鈍化處理方法包括化學鈍化處理或電化學鈍化處理。
化學鈍化處理包括通過氧化劑氧化正極集流體,使正極集流體表面形成鈍化膜。氧化劑選擇的原則為氧化劑能使正極集流體表面形成一層鈍化膜而不會溶解正極集流體。氧化劑選自但不僅限于濃硝酸或硫酸高鈰(Ce(SO4)2)。
電化學鈍化處理包括對正極集流體進行電化學氧化或對含有正極集流體的電池進行充放電處理,使正極集流體表面形成鈍化膜。
更加優選的,正極還包括負載正極活性物質的復合集流體,復合集流體包括正極集流體和包覆在正極集流體上的導電膜。
導電膜滿足在水系電解液中可以穩定存在、不溶于電解液、不發生溶脹、高電壓不能被氧化、易于加工成致密、不透水并且導電的要求。一方面,導電膜對正極集流體可以起到保護作用,避免水系電解 液對正極集流體的腐蝕。另一方面,有利于降低正極片與正極集流體之間的接觸內阻,提高電池的能量。
優選的,導電膜的厚度為10μm~2mm。
正極集流體具有相對設置的第一面和第二面,優選的,正極集流體的第一面和第二面均包覆有導電膜。
導電膜包含作為必要組分的聚合物,聚合物占導電膜的重量比重為50~95%,優選的,聚合物選自熱塑性聚合物。為了使導電膜能夠導電,有兩種可行的形式:(1)聚合物為導電聚合物;(2)除了聚合物之外,導電膜還包含導電填料。
導電聚合物選材要求為具有導電能力但電化學惰性,即不會作為電荷轉移介質的離子導電。具體的,導電聚合物包括但不僅限于聚乙炔、聚吡咯、聚噻吩、聚苯硫醚、聚苯胺、聚丙烯腈、聚喹啉、聚對苯撐(polyparaphenylene)及其任意混合物。導電聚合物本身就具有導電性,但還可以對導電聚合物進行摻雜或改性以進一步提高其導電能力。從導電性能和電池中的穩定使用考量,導電聚合物優選聚苯胺、聚吡咯、聚噻吩和聚乙炔。
同樣的,導電填料的選材要求為表面積小、難于氧化、結晶度高、具有導電性但電化學惰性,即不會作為電荷轉移介質的離子導電。
導電填料的材料包括但不僅限于導電聚合物、碳基材料或金屬氧化物。導電填料在導電膜中的質量百分比范圍為5~50%。導電填料的平均粒徑并沒有特別限定,通常范圍在100nm~100μm。
當導電膜中包含導電填料時,導電膜中的聚合物優選包含起到結合導電填料作用的非導電聚合物,非導電聚合物增強了導電填料的結合,改善了電池的可靠性。優選的,非導電聚合物為熱塑性聚合物。
具體的,熱塑性聚合物包括但不僅限于聚烯烴如聚乙烯、聚丙烯,聚丁烯,聚氯乙烯,聚苯乙烯,聚酰胺,聚碳酸酯,聚甲基丙烯酸甲酯,聚甲醛,聚苯醚,聚砜,聚醚砜、丁苯橡膠或聚偏氟乙烯中的一種或多種。其中,優選為聚烯烴、聚酰胺和聚偏氟乙烯。這些聚合物容易通過熱而熔化,因此容易與正極集流體復合在一起。此外,這些聚合物具有大電位窗口,從而使正極穩定并為電池輸出密度節省重量。 優選的,導電膜通過熱壓復合、抽真空或噴涂的方式結合到正極集流體上。
為了提供更好的安全性能,優選在電解液中位于正極與負極之間還設有隔膜。隔膜可以避免其他意外因素造成的正負極相連而造成的短路。
隔膜沒有特殊要求,只要是允許電解液通過且電子絕緣的隔膜即可。有機系鋰離子電池采用的各種隔膜,均可以適用于本發明。隔膜還可以是微孔陶瓷隔板等其他材料。
下面通過實施例對本發明進一步說明。
實施例1
按將質量比86:7:7將錳酸鋰LMO、石墨導電劑KS-6、粘結劑PVDF在NMP中混合,形成均勻的正極漿料。將正極漿料涂覆在正極集流體石墨箔上形成活性物質層,隨后將其進行壓片,剪裁成直徑為12mm大小的圓片,制成正極片,正極片中LMO的負載量為5mg/cm2。負極采用厚度為0.2mm的鋅片作為負極集流體。隔膜為AGM玻璃纖維隔膜。隔膜和負極尺寸與正極相當。
稱取一定量的硫酸鋅、硫酸鋰溶于去離子水中,再向其中加入鹽酸胍,攪拌,配置成硫酸鋅濃度為2mol/L、硫酸鋰濃度為1mol/L、鹽酸胍在電解液中的質量分數為0.2%的電解液,即所述電解液中胍陽離子在電解液中的質量分數為0.126%。
將正極片、負極片以及隔膜層疊組裝成電芯,裝入殼體內,然后注入電解液,封口,組裝成電池。
實施例2
與實施例1所不同的是,硫酸鋅濃度為1mol/L、硫酸鋰濃度為2mol/L,其他部分同實施例1,組裝成電池。
實施例3
與實施例1所不同的是,硫酸鋅濃度為1mol/L、硫酸鋰濃度為2mol/L,電解液中鹽酸胍的質量分數為0.1%,即所述電解液中胍陽離子在電解液中的質量分數為0.063%。其他部分同實施例1,組裝成電池。
實施例4
與實施例1所不同的是,硫酸鋅濃度為1mol/L、硫酸鋰濃度為2mol/L,電解液中鹽酸胍的質量分數為0.5%,即所述電解液中胍陽離子在電解液中的質量分數為0.315%。其他部分同實施例1,組裝成電池。
對比例1
與實施例1所不同的是,電解液中沒有添加鹽酸胍,其他部分同實施例1,組裝成電池。
對比例2
與對比例1所不同的是,硫酸鋅濃度為1mol/L、硫酸鋰濃度為2mol/L,其他部分同對比例1,組裝成電池。
電化學性能測試
分別對實施例1-4及對比例1-2的電池進行電化學性能檢測,在室溫下分別依次以0.2C、0.5C、1C、2C、4C、0.2C倍率進行恒流循環充放電5次,電壓范圍為1.4-2.1V,然后將電池在2.1V下浮充24h,再將電池在1C倍率下循環充放電,再開路放置24h,再進行放電。
圖1為實施例1及對比例1提供的電池在室溫下分別依次以0.2C、0.5C、1C、2C、4C、0.2C倍率進行恒流循環充放電5次的倍率性能圖。從圖中可知,電解液添加0.2%wt的鹽酸胍后,電池的倍率性能得到提高。
圖2為實施例1及對比例1提供的電池在1C倍率下放電容量、電池效率與循環次數關系圖。由圖可知,電解液添加鹽酸胍的電池初始容量132mAh/g,電解液不添加鹽酸胍的電池初始容量122mAh/g。以上說明,電解液添加0.2%wt的鹽酸胍,電池的初始容量得到提高。
圖3為實施例1及對比例1提供的電池在2.1V下浮充24h的浮充電流密度。從圖中也可看出,電解液添加0.2%wt的鹽酸胍后,電池的浮充電流得到下降。
圖4為實施例1及對比例1提供的電池放置24h的開路電壓。從圖中也可看出,電解液添加0.2%wt的鹽酸胍后,電池的開路電壓得到上升。
將實施例2-4及對比例2提供的電池在室溫下分別依次以0.2C、0.5C、1C、2C、4C、0.2C倍率進行恒流循環充放電5次的倍率性能圖。測試結果顯示,電解液添加0.5%wt的鹽酸胍后,電池的倍率性能得到提高。
將實施例2-4及對比例2提供的電池在2.1V下浮充24h的浮充電流密度。測試結果顯示,電解液添加0.1%wt或者0.2%wt的鹽酸胍后,電池的浮充電流得到下降。
將實施例2-4及對比例2提供的電池放置24h測試開路電壓。測試結果顯示,電解液添加鹽酸胍后,電池的開路電壓得到上升。
圖5為實施例2及對比例2提供的電池在4C倍率下放電容量、電池效率與循環次數關系圖。由圖可知,實施例2的電池初始容量約為113mAh/g,在循環100、200、500、700、1000圈時的容量保持率分別為89.2%、83.2%、71.1%、65.9%、57.1%;對比例2的電池初始容量約為114mAh/g,在循環100、200、500、700、1000圈時的容量保持率分別為89.3%、86.5%、73.3%、63.4%、53.9%。以上說明,電解液添加0.2%wt的鹽酸胍,從長期走勢觀察電池的容量保持率得到提升。
盡管發明人已經對本發明的技術方案做了較詳細的闡述和列舉,應當理解,對于本領域技術人員來說,對上述實施例作出修改和/或變通或者采用等同的替代方案是顯然的,都不能脫離本發明精神的實質,本發明中出現的術語用于對本發明技術方案的闡述和理解,并不能構成對本發明的限制。
- 還沒有人留言評論。精彩留言會獲得點贊!