一種鋰二次電池正極材料LiMnO2的制備方法與流程
本發明涉及鋰離子電池領域,更具體涉及鋰離子二次電池正極材料合成技術領域,尤其是涉及一種鋰離子二次電池正極材料LiMnO2的制備方法,還涉及LiMnO2電極材料的摻雜改性提高其電化學儲鋰容量和充放電循環穩定性。
背景技術:
LiMnO2在鋰離子電池正極材料中理論容量高達285mAhg-1而受到越來越多的研究和應用。LiMnO2是目前主流鋰離子二次電池正極材料尖晶石LiMn2O4的理論容量的兩倍,是一種可在實際應用中比較有潛力的材料。目前,主要有高溫煅燒法、水熱法、溶膠凝膠法和離子交換法等方法合成LiMnO2。高溫煅燒法中,Liu等在800℃的空氣中煅燒二氧化錳10h得到前驅體Mn2O3,然后與過量的LiOH混合,在乙醇溶液中球磨12h充分混合,在氮氣氛圍下煅燒24h,冷卻至室溫即可得到o-LiMnO2,其中加入過量的LiOH是因為在加熱過程中會有Li的揮發損失(見參考文獻:LiuC,NanJM,ZuoXX,etal.SynthesisandelectrochemicalcharacteristicsofanorthorhombicLiMnO2cathodematerialmodifiedwithpoly(Vinyl-Pyrrolidone)forlithiumionbatteries,IntJElectrochemSci,2012,7,7152-7164)。此類合成方法合成步驟多,需要前驅體,高溫煅燒,條件控制嚴格(見參考文獻:GuYJ,ChenYB,WuHK,etal.StructurechangeoforthorhombicLiMnO2cathodesduringelectrochemicalcycleforrechargeablelithiumbattery,EnergyMaterials,2009,4,40-43;JangY,HuangBY,WangHF,etal.Electrochemicalcycling-inducedspinelformationinhigh-charge-capacityorthorhombicLiMnO2,J.Electrochem.Soc.,1999,146,3217-3223;JiHM,YangG,MiaoXW,etal.EfficientmicrowavehydrothermalsynthesisofnanocrystallineorthorhombicLiMnO2catthodesforlithiumbatteries,Electrochim.Acta,2010,55,3392-3397)。水熱合成法,Xiao等通過MnSO4、LiOH、H2O2在200℃條件下水熱8h合成出了正交o-LiMnO2納米顆粒,但是其中含有Li2MnO3雜相。以KMnO4和CTAB在180℃水熱12h合成了MnOOH納米線。將前驅體MnOOH和LiOH在200℃條件下水熱8h合成出了單一相的正交o-LiMnO2納米線(見參考文獻:XiaoXL,WangL,WangDS,HeXM,etal.HydrothermalsynthesisoforthorhombicLiMnO2nano-particlesandLiMnO2nanorodsandcomparisonoftheirelectrochemicalperformances,NanoRes,2009,2,923-930)。此類合成方法需要前驅體,易出現雜質(見參考文獻:HuangXK,ZhangQS,ChangHT,etal.HydrothermalsynthesisofnanosizedLiMnO2-Li2MnO3compoundsandtheirelectrochemicalperformances,J.Electrochem.Soc.,2009,156,A162-A168;LiuQ,LiYX,HuZL,etal.One-stephydrothermalroutineforpure-phasedorthorhombicLiMnO2forLiionbatteryapplication,Electrochim.Acta,2008,53,7298-7302;XuH,SunJ,GaoL,etal.HydrothermalsynthesisofLiMnO2microcubesforlithiumionbatteryapplication,Ionics,2013,19,63-69)。溶膠凝膠法,Guo等將Mn(CH3COO)2·4H2O和Li(CH3COO)·2H2O在乙醇中按陽離子摩爾比1:1混合,在攪拌過程中加入檸檬酸,80℃下攪拌2h,形成凝膠。在真空干燥箱中110℃烘4h。然后將凝膠在800℃流動的氬氣中烘12h制備得到o-LiMnO2(見參考文獻:GuoZP,KonstantinovK,WangGX,etal.PreparationoforthorhombicLiMnO2materialviasol-gelprocess,J.PowerSources,2003,119,221-225)。此類合成方法合成步驟多,需要前驅體,高溫煅燒,流動的氬氣,合成條件相對較為苛刻(見參考文獻:ZhaoSX,LiuHX,LiQ,etal.SynthesisandstructuretransformationoforthorhombicLiMnO2cathodematerialsbysol-gelmethod,JMaterSciTechnol,2004,20,46-48)。離子交換法,Wu等通過將Na2CO3和Mn(CH3COO)2混合,在120℃條件下水熱3h,然后在空氣中250℃煅燒4h,然后在710℃煅燒2h得到NaMnO2。然后在正己烷中,和過量的LiBr交換,將得到的產物過濾洗滌,即可合成層狀的單斜m-LiMnO2(見參考文獻:WuXM,LiRX,ChenS,etal.ComparativestudyofCo,CrandAl-dopedLiMnO2preparedbyionexchange.BullMaterSci,2008,31,109-113.)。此類合成方法合成步驟多,需要前驅體,高溫煅燒,條件苛刻。上述方法都需要先合成前驅體,再通過水熱或者固相高溫反應來制備目標產物。這些方法都具有較多的反應步驟,而且高溫煅燒也會消耗很多能量,不利于清潔生產。而且,目前以水熱法合成的LiMnO2都需要較高的LiOH濃度,Li/Mn一般不會低于13(見參考文獻:HeY,FengQ,ZhangSQ,etal.StrategyforloweringLisourcedosagewhilekeepinghighreactivityinsolvothermalsynthesisofLiMnO2nanocyrstals,SustainableChemistry&Engineering,2013,Doi:10.1021/sc400056w),也就是說,在合成LiMnO2的過程中需要消耗較多量的Li。現有技術反應步驟多、高能耗和高成本。
技術實現要素:
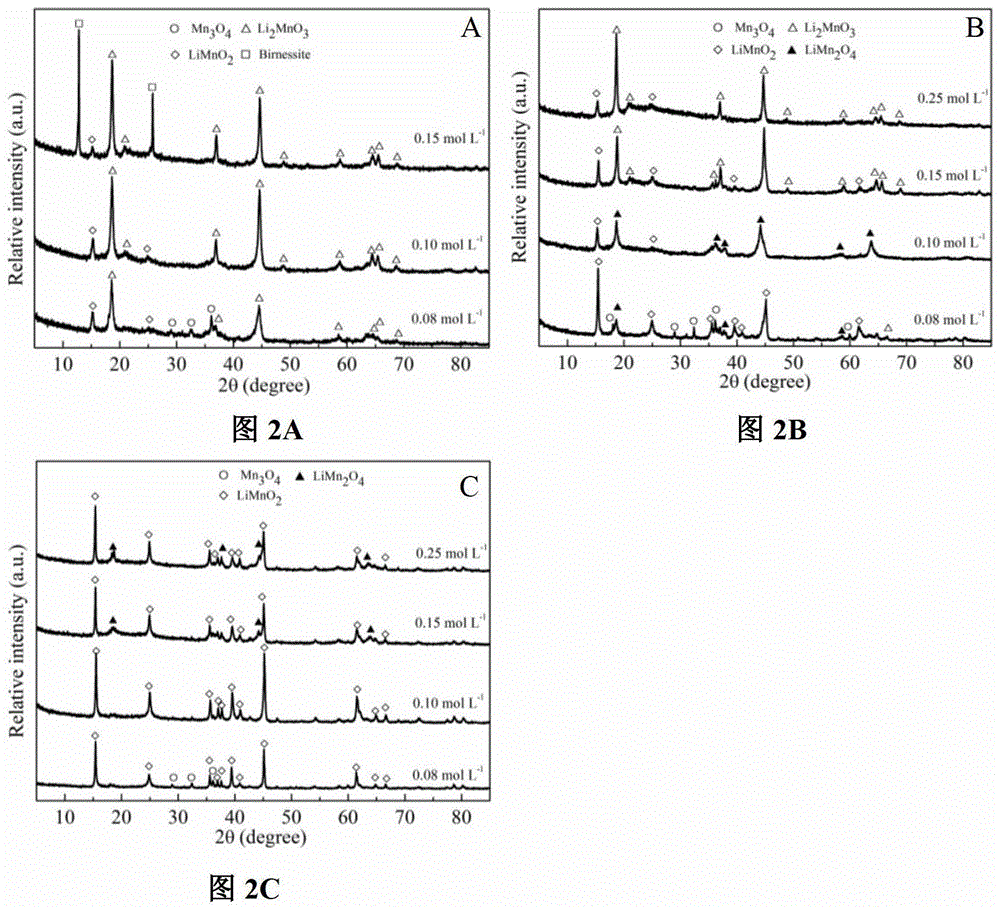
本發明的主要目的在于克服現有LiMnO2在合成過程中,反應步驟多、時間長和需要較高能量以及需要消耗大量Li的缺陷,本發明的目的是在于提供了一種鋰二次電池正極材料LiMnO2的制備方法,方法易行,操作簡便,能減少反應步驟、降低能耗,有利于清潔的生產,有利于形貌的控制,有效的節約了Li資源并能夠改善LiMnO2的儲鋰性能。為了實用上述的目的,本發明采用以下技術措施:一種鋰二次電池正極材料LiMnO2的制備方法,其步驟是:第一步:將二價錳鹽和乙二胺四乙酸四鈉(EDTA-4Na)加入水中,攪拌溶解,倒入高壓釜(河南鞏義予華設備有限公司,100mL)中,其中,所述二價錳鹽和EDTA-4Na的摩爾比在0.5~1之間;在水中還需要加入氯化鋁,所述的氯化鋁和二價錳鹽的摩爾比在0.05~0.2之間;在水中還需要加入碳納米管(中國科學院成都有機有限公司、管徑10nm~50nm);所述的碳納米管為多壁碳納米管(CNT)(中國科學院成都有機有限公司、管徑10nm~50nm)、羧基化碳納米管(CNT-C或CNT-C-C)(中國科學院成都有機有限公司、管徑10nm~50nm;另外在已購多壁碳納米管基礎上可自己制備羧基化碳納米管(見參考文獻:GaoC.,DuanVoC.,JinYZetal.Multihydroxypolymer-functionalizedcarbonnanotubes:synthesis,derivatization,andmetalloading,Macromolecules,2005,38,8634-8648))。第二步:將氫氧化鋰和氧化劑混合,倒入高壓釜中,其中,氫氧化鋰與二價錳鹽的摩爾比在6~8之間;所述的二價錳鹽設為MnCl2、MnSO4、Mn(CH3COO)2或Mn(NO3)2;所述的氧化劑設為NaClO或H2O2。第三步:將上述溶液在高壓釜中水熱反應12~24h,水熱反應溫度為120℃~180℃;第四步:將第三步反應所得的反應產物冷卻至室溫(20-40℃),離心后取沉淀物;第五步:將上述沉淀物用洗滌后烘干,將沉淀物使用水或乙醇至少一次洗滌,直至上清液的電導為≤30μS/cm。進一步地,所述的最后一次洗滌使用酒精洗滌;進一步地第一步至第三步:所述的水為二次水;所述的乙醇為無水乙醇。所述的第五步中的烘干條件為:溫度60~110℃,時間12~24h。借由上述技術方案,本發明合成LiMnO2的方法至少具有下列優點:1、本發明的優選的實施方式,能夠減少反應步驟。2、本發明的優選的實施方式,更節約能源。3、本發明的優選的實施方式,有利于清潔生產。4、本發明的優選的實施方式,有利于形貌的控制。5、本發明的優選的實施方式,能夠有效的節約了Li資源。6、本發明的優選的實施方式,能夠影響電池性能。上述說明僅是本發明技術方案的概述,為了能夠更清楚了解本發明的技術手段,并可依照說明書的內容予以實施,以下以本發明的較佳實施例詳細給出。在水熱氧化Mn2+生成正交LiMnO2(o-LiMnO2)過程中,有Li2MnO3等雜質生成。目前主要合成多為先合成前驅體,然后在惰性氛圍中高溫煅燒,或著前驅體與高濃度的LiOH通過水熱反應制備。本發明減少了反應步驟,水熱法也比高溫煅燒更能降低能耗和對設備材質的要求,且能有效控制目標產物的形貌。進一步通過水熱法成功的合成了摻雜Al和碳納米管改性的o-LiMnO2,其循環穩定性得以顯著提高。其中Al摻雜改性的o-LiMnO2可高達158mAhg-1,100周期后還能維持為155mAhg-1,而碳納米管負載的o-LiMnO2容量可高達181mAhg-1。上述案例具有很高的工業實際生產應用價值。附圖說明圖1a為一種不同濃度的LiOH,其反應產物的XRD圖;圖1b為一種EDTA-4Na對反應產物影響的XRD圖;圖2a為一種在180℃條件下,不同濃度的NaClO,其反應產物的XRD圖;圖2b為一種在150℃條件下,不同濃度的NaClO,其反應產物的XRD圖;圖2c為一種在120℃條件下,不同濃度的NaClO,其反應產物的XRD圖;圖3為一種實施例1中反應產物的SEM圖;圖4為一種實施例1鋰離子二次電池正極材料循環性能圖;圖5a為一種摻雜不同量的AlCl3,在180℃條件下,其反應產物的XRD圖;圖5b為一種摻雜AlCl3為20%,不同LiOH和NaClO的量,在180℃條件下,其反應產物的XRD圖;圖5c為NaClO和LiOH量調節后的反應產物的XRD圖;圖6為一種實施例2中反應產物的SEM圖;圖7為一種實施例2,反應中Al的濃度和摻雜的量的比例;圖8為一種實施例2的反應產物的鋰離子二次電池正極材料循環性能圖;圖9為一種實施例3的反應產物的XRD圖;圖10為一種實施例3中反應產物的SEM圖;圖11為一種實施例3中反應產物的鋰離子二次電池正極材料循環性能圖。具體實施方式為更進一步闡述本發明為達成預定發明目的所采取的技術手段及功效,以下結合附圖及較佳實施例,對依據本發明提出的合成LiMnO2的方法具體實施方式、結構、特征及其功效,詳細說明如后。實施例1一種鋰二次電池正極材料LiMnO2的制備方法,包括以下步驟:第一步:稱取0.989gMnCl2·4H2O,2.262gEDTA-4Na,加入45mL的二次水中,攪拌溶解,倒入高壓釜的內襯中;第二步:稱取1.253g的LiOH和6.71g的NaClO溶液,將兩者迅速混合,倒入內襯中,溶液約50mL,上述混合溶液立即出現黑色;第三步:放入高壓釜中在180℃條件下水熱24h;第四步:室溫(20-40℃,以下相同)下冷卻后,取出內襯,將所得的溶液冷卻至室溫,離心;第五步:溶液上部無色透明,底部是灰色的沉淀,將上述沉淀倒入離心管中,離心后固液分離,再用無水乙醇超聲分散,離心,直至上清液電導為30μS/cm左右;將洗滌后所得沉淀物在烘箱中烘干24h,其中,控制烘干溫度為60℃。本發明的離子反應方程式為:2Mn2++ClO-+6LiOH→2LiMnO2+3H2O+Cl-+4Li+本發明所公開的LiMnO2的合成方法能夠減少反應步驟,且水熱法也比高溫煅燒更節約能源,有利于清潔生產,而且水熱法也非常有利于形貌的控制。且在本發明的水熱法中成功的控制到Li/Mn的比例為6,有效的節約了Li資源。本反應中,MnCl2的濃度為0.1mol/L,EDTA-4Na的濃度為0.1mol/L,LiOH的濃度為0.6mol/L,NaClO的濃度為0.1mol/L。其中,在第二步中,1.253g的LiOH相當于0.6mol/L,即與所述二價錳鹽的摩爾比為6:1,NaClO(有效氯≥5.2%)是一種溶劑,所以6.71g=0.1mol/L。在上述反應中,加入NaClO的體積為5mL,加入水的量為45mL,進行反應的溶液的體積為50mL。本發明中,所用試劑規格如下:不同的溫度、NaClO的量、LiOH的量和EDTA-4Na都對LiMnO2的形成有重要的作用,這正是由于LiMnO2是一個亞穩定相,所以對反應的條件要求很苛刻。在水熱氧化Mn2+合成過程中易生成Li2MnO3等雜質。為了得到單一的LiMnO2,就必須控制好氧化反應的速率。所以本發明采用EDTA-4Na來螯合Mn2+離子,并用稀濃度氧化劑NaClO來氧化可以有效的減小反應速率而得到單一相的LiMnO2。從圖1a中可知,當LiOH濃度為0.1mol/L和0.2mol/L時,產物為Mn3O4的純相,當LiOH濃度提升至0.4mol/L時,反應產物是LiMnO2和Mn3O4的混合相,當LiOH濃度繼續提升至0.6mol/L和0.8mol/L時,就能夠得到LiMnO2的純相。這說明LiOH的量對反應產生了重要的影響。圖1b為在LiOH濃度為0.6mol/L中,EDTA-4Na的添加對反應產物影響XRD圖。在沒有加入EDTA-4Na時,NaClO氧化Mn2+的反應是一個劇烈的過程,生成了Li2MnO3,還有Mn3O4等雜相。而當加入0.1mol/L的EDTA-4Na時則生成了純相的LiMnO2。這是因為反應中EDTA-4Na在初始絡合了Mn2+,使得Mn2+被NaClO氧化速率減緩,所以在反應過程中,使得其向緩慢的向亞穩定相LiMnO2轉變。這說明在反應中,LiOH的量和EDTA-4Na都會影響亞穩定相LiMnO2的生成。圖2a、2b和2c分別示出了在不同溫度120℃、150℃和180℃條件下,不同濃度的NaClO水熱產物XRD圖譜,此時在LiOH的濃度為0.6mol/L。在0.08mol/LNaClO時,由于氧化劑的量不足,三個水熱溫度下都有低價態的Mn3O4生成。在180℃溫度下時,隨著NaClO的量增加,產物中逐漸含有高價態的LiMn2O4和Li2MnO3,在150℃和120℃中都出現了相似的現象。這說明在相同溫度下,隨著NaClO的量增加產物中Mn的價態也都升高了。在120℃時,0.15mol/LNaClO時生成了MnO2。當加入相同量的NaClO時,溫度對反應起到了重要的作用:溫度越低,越易生成高價態的錳如Li2MnO3和MnO2。溫度、NaClO的量、LiOH的量和EDTA-4Na都對LiMnO2的形成有重要的作用,這正是由于LiMnO2是一個亞穩定相,所以對反應的條件要求很苛刻。所述MnCl2·4H2O可以為由MnCl2、MnSO4、Mn(CH3COO)2或Mn(NO3)2等能夠提供Mn2+的化合物所替代,只要能保證Mn2+和EDTA-4Na的摩爾比在0.5~1之間即能實現本發明。所述LiOH與Mn2+的摩爾比可以為6~8之間的任意值;本實施例中的氧化劑為NaClO,所述的NaClO也可以由H2O2替代(氧化劑與二價錳離子的摩爾比為1.2~1.5)。可選擇地,在對所述沉淀物進行清洗的過程中,可以只在最后一步采用無水乙醇進行清洗,前幾步采用水進行清洗。可選擇地,洗滌后所得沉淀物在烘箱中控制烘干溫度為60~110℃之間的任意溫度,烘干12~24h之間的任意時間,以確保能將沉淀物烘干即可。在150℃,在取6.71g(0.1mol/L)NaClO時,得到的質量比LiMnO2:LiMn2O4=70.9%:29.1%,產物命名Mm。在180℃,在取6.71g(0.1mol/L)NaClO時,合成的LiMnO2產物命名為M0。圖3中a和b分別為混合相Mm和純相M0的掃描電鏡(SEM)照片。Mm的顆粒較小,結晶度較弱;M0的顆粒相對較大,結晶度也較高。圖4為實施方案一,不同溫度和NaClO量的反應產物,純相的M0的初始容量最低76mAh·g-1,且在初始周期有一個活化的過程,到20周期后達到最大,但是隨后又發生緩慢的衰減,在100周期后還有124mAh·g-1。混合相樣品Mm的初始容量最高139mAh·g-1,隨后活化,容量緩慢升高,在15周期時達到最高176mAh·g-1,然后容量緩慢衰減,在100周期后為143mAh·g-1。整體性能看,混合相Mm表現出最好的電化學活性和穩定性。實施例2:其與實施例1的區別在于,在第一步中,加入NaClO的量為7.67g(0.12mol/L),在水中還需要加入0.241gAlCl3·6H2O(Al/Mn=20%),在第二步中,LiOH的濃度為0.6mol/L,然后在180℃條件下,水熱反應24h得到產物的XRD圖譜如圖5a和5b所示。可選擇地,所述AlCl3和二價錳鹽的摩爾比在0.05~0.2之間的任意值。在上述反應中生成了LiMn2O4雜質,且其量是隨著加入AlCl3的量逐漸減小的,加入0.241gAlCl3·6H2O時出現了Mn3O4,這說明加入的AlCl3會影響原來反應溶液的環境。在加入0.241gAlCl3·6H2O時,分別加入過量的NaClO或LiOH,發現加入過量的NaClO時,還是有Mn3O4生成,說明氧化劑的不足并不是導致生成的Mn3O4的原因;當加入足量的LiOH時則生成了純相。對比圖5a和5b可知,LiMn2O4的峰強逐漸降低是因為加入的AlCl3,其中的Cl-會使得ClO-的氧化降低,Cl-+ClO-+2H+→Cl2+H2O,Cl2的氧化性是低于ClO-;同時加入的Al3+會消耗OH-的量,當AlCl3·6H2O的摻雜量超過0.241g時,會導致LiOH的量不足而生成了Mn3O4。所以要合成Al摻雜的純相LiMnO2,NaClO和LiOH的量都要進行調控。不同濃度的AlCl3、NaClO、和LiOH對反應產物的影響,如下表所示:從上表可以看出,通過調控NaClO和LiOH的量,合成了純相的Al摻雜LiMnO2。圖5上述反應產物的XRD圖,其中圖5a和5b為NaClO和LiOH量調節前的反應產物的XRD圖,圖5c為NaClO和LiOH量調節后的反應產物的XRD圖(其中,圖中M0、M5、M10、M15和M20分別代表AlCl3的摻雜量為0M、0.005M、0.01M、0.015M和0.020M的反應產物。如圖6所示,圖a、b、c和d分別為樣品M5、M10、M15和M20的SEM照片,Al摻雜對形貌影響很大,由原來小塊狀顯著的改變為片狀,且顆粒粒徑有減小的趨勢。通過對不同Al摻雜量進行合成LiMnO2,對反應產物進行結構精修擬合,和BET測試,結果如下:隨著Al的摻雜量越多,其晶胞體積是逐漸減小的。這是因為Al3+同晶替代了LiMnO2中的Mn3+晶胞體積減小。a軸逐漸減小(錳氧八面體上下兩個Mn-O鍵相關)b軸逐漸增大(錳氧八面體上平面四個Mn-O鍵相關),而c軸無規律變化,晶胞體積逐漸減小。根據XRD精修計算晶體顆粒也是逐漸減小的,BET測量比表面積也是逐漸減小的,但是整體差異不顯著。采用ICP-OES法測量晶體中Al的含量。根據Al含量值,進行線性擬合,其線性擬合結果如圖7,可知摻雜量是與濃度呈線性關系的。而摻雜產物Al/Mn為溶液中Al3+/Mn2+量的6.02%。圖8中,在摻雜產物系列中,電化學性能最好的是M10。在初始周期時為82mAh·g-1,然后有一個活化的過程,到20周期時趨于穩定158mAh·g-1,在充放電到100周期后也沒有發生明顯的衰減,為155mAh·g-1。而M5、M15、M20電池性能在初始周期與M10沒有較大的差異,但是在循環80周期后,容量都有一個緩慢衰減的過程。Al摻雜的LiMnO2的晶胞參數發生了明顯的變化,繼而影響了電池性能。本發明所提供的水熱法合成Al摻雜LiMnO2,可以顯著的改善LiMnO2在充放電過程中結構的穩定性。實施例3:其與實施例1的區別在于:在第一步前,還包括羧基化碳納米管CNT-C-C的制備步驟:稱取購買的羧基化碳納米管(CNT-C,羧基化比例3%)0.5g至于聚四氟乙烯的內襯中,加入35mL水和15mL的濃硝酸(30%)。密封,置于高壓釜中,在180℃下水熱48h。冷卻,離心洗滌至固液不能分離。將黑色的混合液置于燒杯中,在電爐上烘干,制備得到出羧基化比例增加的碳納米管,命名為CNT-C-C。在第一步中,稱取0.98gMnCl2·4H2O,2.26gEDTA-4Na,0.1gCNT(CNT-C、CNT-C-C)加入一定量的二次水中,攪拌溶解,倒入聚四氟乙烯內襯中。經過羧基化處理的CNT會更好與Mn2+絡合,可能會使得LiMnO2更穩定,從而表現出更好的電化學性能。不同的NaClO的量對水熱合成CNT摻雜LiMnO2有很大影響,圖9中示出了添加不同的NaClO量的反應產物的XRD圖。從上表中可以看出,在反應過程中,碳納米管會消耗部分NaClO。而且根據圖9曲線b和c的反應條件認為,碳納米管上-COOH會消耗更多的NaClO。根據圖9曲線e和f的反應條件可推斷,碳納米管上-COOH也會消耗部分的OH-。當不加入EDTA-4Na時,生成的還是混合相,碳納米管上的-COOH并沒有取代掉EDTA-4Na中-COO-的作用,這可能是碳納米管上-COOH量不足的原因。要想合成純相CNT負載的LiMnO2,需要調節LiOH和NaClO的量。將上述三類碳納米管負載的純相LiMnO2樣品分別命名為MCNT、MCNT-C、MCNT-C-C。由圖10可知,M0、MCNT、MCNT-C和MCNT-C-C四種樣品都是無規則的小顆粒塊狀,這說明碳納米管不會對LiMnO2的形貌產生影響。但是MCNT(b)和MCNT-C(c)中出現了明顯的碳納米管團聚,而MCNT-C-C(d)卻沒有明顯的碳納米管團聚。這是因為經過硝酸處理得到的CNT-C-C發生了明顯的斷裂,使得碳納米管的長度變短,在反應過程中碳納米管沒有發生明顯的團聚。這將會直接影響LiMnO2的儲鋰性能(見圖11)。以上所述,僅是本發明的較佳實施例而已,并非對本發明作任何形式上的限制,依據本發明的技術實質對以上實施例所作的任何簡單修改、等同變化與修飾,均仍屬于本發明技術方案的范圍內。
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1