一種用于茶葉中多種農藥殘留檢測的前處理方法與流程
本發明屬于分析化學領域,提出了一種用于茶葉中多種農藥殘留檢測的前處理方法。
背景技術:
:
茶葉的農藥殘留問題一直受到重視,各種檢測殘留的技術也層出不窮。有相當一部分實驗室具備了檢測多達數百種農藥殘留的能力,但在實際操作中,由于茶葉基質復雜,所含有機化學成分達450多種,無機礦物元素40多種,用次生代謝產物多,基質效應明顯,易對農藥殘留檢測造成干擾。在進行多殘留檢測時往往需要繁瑣的樣品提取與凈化步驟以去除干擾,使得前處理步驟繁瑣、檢測成本高、勞動強度大。因此,開發新型新處理技術,實現真正意義上的快速篩查,具有十分重要的意義。
黃雪等(改進的石墨烯分散固相萃取-液相色譜-串聯質譜法測定茶葉中15種氨基甲酸酯類農藥的殘留量[j],食品安全質量檢測學報,2017年第5期)中公開了以石墨烯為吸附劑,建立分散固相萃取-液相色譜-串聯質譜法測定茶葉中多種氨基甲酸酯類農藥殘留量,其對茶葉樣品前處理是:準確稱取茶葉樣品1g(精確至0.01g)于50ml塑料離心管中,加入約5ml超純水,浸泡30rain后,準確加入10ml乙腈和約4g氯化鈉,渦旋3min,離心,取上層乙腈約1ml,加入20mg石墨烯,渦旋1min,高速離心,取上層溶液過膜,供液相色譜-質譜/質譜儀測定。
專利cn106124674a公開了一種快速測定茶葉中農藥殘留的前處理方法及其定量分析方法,步驟如下:1)提取:將茶葉浸泡于水中,加入乙腈提取農藥殘留,然后加入醋酸鈉進行鹽析使有機相和水相進行相分離,所得乙腈層即為茶葉提取液;2)凈化:將步驟1)所得茶葉提取液中加入活性炭、n-丙基乙二胺和硫酸鎂進行凈化,所得上清液即為快速測定茶葉中農藥殘留的待測液;3)采用標準曲線法經氣相色譜-串聯質譜進行定量分析。
而本發明的樣品前處理與前二者有很大的同,首先是本發明中乙腈提取后,經氮吹揮干乙腈后,轉換乙酸乙酯溶解殘渣,換相過程也是凈化過程,可有效去除部分雜質;其次本發明采用無水氯化鈣+gcb+磁性石墨烯(或psa),無水氯化鈣可與茶葉中主要基質成分多酚類、黃酮類、色素、部分生物堿等形成螯合物沉淀,有效去除相當一部分雜質,提高凈化效率,結合gcb+磁性石墨烯(或psa)進一步凈化,相較其它凈化方式更為高效。
技術實現要素:
:
本發明提出一種用于茶葉中多種農藥殘留檢測的高效前處理方法,結合氣相色譜/電噴霧四極桿飛行時間質譜,在1小時內完成茶葉中百余種農藥殘留的檢測,簡單快速、準確可靠。
為實現上述目的,本發明采用如下技術方案:
一種用于茶葉中多種農藥殘留檢測的前處理方法,具體步驟為:
(1)提取:稱取茶葉樣品,加入飽和氯化鈉溶液,渦旋30s混勻后,浸潤5min,以乙腈高速均質提取1min,4000rpm離心3min,殘渣再以乙腈渦動提取,合并上清液;向上清液加入無水氯化鈣,渦旋30s,4000rpm離心3min,取上清液以氮氣吹至近干;
(2)凈化:然后向步驟(1)得到的液體加入2ml乙酸乙酯,再加入rgo@fe3o4,再加入gcb或psa,渦旋30s;
(3)將步驟(2)得到的液體用磁鐵將固體物吸附至離心管底部與側壁或采用4000rpm離心3min;取1ml分離后的液體過0.22μm濾膜,得到用于測定茶葉中農藥殘留的待測液。
其中步驟(1)中茶葉與飽和氯化鈉溶液的料液比為2:2~5,單位g/ml。
其中步驟(1)中茶葉與乙腈的料液比為2:5~10,單位g/ml;提取時間為3min。
其中步驟(1)中茶葉與無水氯化鈣的質量比為2:1~5。
其中茶葉與rgo@fe3o4的質量比為2:0.04~0.09。
其中茶葉與gcb的質量比為2:0.1~0.2。
其中茶葉與psa的質量比為2:0.1~0.2。
本發明的顯著優點在于:
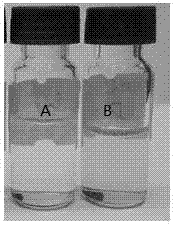
(1)本發明相對于傳統quechers方法及其它茶葉檢測中常用的方法相比,在提取過程中的優勢在于:a、提取與凈化效果更好。經采用陽性樣品比較,本法比傳統的quechers方法提取回收率高25~40%,且凈化效果更好(如圖2所示);b、高效普適。本發明在不超過20min內即可滿足166種農藥的前處理要求(進一步驗證后還可擴大化合物種類),操作簡便,對試劑消耗少。
(2)本發明前處理方法結合氣相色譜-串聯質譜(gc-ms/ms)對農藥進行分離檢測,操作簡單,快速有效,結果可靠,對于基質復雜的茶葉樣品,凈化效果良好,準確度和精密度均滿足要求。
(3)本發明采用的無水氯化鈣+gcb+磁性石墨烯(或psa)相較其它凈化方式更為高效。如圖3所示,由圖可見,無水氯化鈣+gcb+磁性石墨烯(或psa)可起到很好的凈化效果。這是因為鈣離子可與茶葉中主要基質成分多酚類、黃酮類、色素、部分生物堿等形成螯合物沉淀,有效去除相當一部分雜質。而單純使用gcb、psa、石墨烯、gcb+psa或gcb+石墨烯效果均不如無水氯化鈣+gcb+磁性石墨烯(或psa)理想。在色譜分離領域,活性炭因活性位點多、作用力復雜,導致回收率低且不穩定,而gcb相比優勢明顯。化合物在gcb上吸附和洗脫規律較容易掌握,且gcb對色素吸附力很強,只要樣品經過gcb處理后肉眼仍可辨別出顏色,就不會對樣品中農藥殘留回收率有影響。
附圖說明
圖1為農藥數據庫檢索流程圖。
圖2不同方法凈化效果比較圖:圖a為本發明方法,圖b為傳統quechers方法。
圖3為不同凈化方式的效果對比:其中各個編號具體樣品信息如下:
圖3中的a圖中:a-1為提取液氮吹干后加入2ml乙酸乙酯(其中未添加無水氯化鈣);b-1為a-1中加入gcb;c-1為a-1中加入psa;d-1為a-1中加入rgo@fe3o4;e-1為a-1中加入gcb+psa;f-1為a-1中加入gcb+rgo@fe3o4;
圖3中b圖中:a-2為a-1處理中添加無水氯化鈣;b-2為a-2中加入gcb;c-2為a-2中加入psa;d-2為a-2中加入rgo@fe3o4;e-2為a-2中加入gcb+psa;f-2為a-2中加入gcb+rgo@fe3o4。
圖4為不同無水氯化鈣添加順序的前處理方法得到的凈化結果:
圖4中a表示的是均質提取前添加無水氯化鈣,b表示的是均質提取后添加無水氯化鈣,c表示的是凈化后離心分離后添加無水氯化鈣。
圖5為不同無水氯化鈣添加順序的前處理方法得到的檢測結果:
圖5中a表示的是均質提取前添加無水氯化鈣,b表示的是均質提取后添加無水氯化鈣;
圖6添加無水氯化鈣與無水硫酸鎂的凈化結果對比圖:
其中a表示為提取液中加入140mggcb,離心后取上清液;b表示為a中添加2g無水mgso4;c表示為a中添加2g無水cacl2。
具體實施方式
為進一步公開而不是限制本發明,以下結合實例對本發明作進一步的詳細說明。
實施例1
1實驗部分
1.1試劑與材料
乙腈、乙酸乙酯、氯化鈉、無水無水氯化鈣、磁性石墨烯(rgo@fe3o4)、石墨化炭黑(gcb)、n-丙基乙二胺固相吸附劑(psa)。
農藥殘留標準品,純度≥97%,購自dr.ehrenstorfergmbh公司。
實驗儀器
agilent7890a/7200gc-qtof/ms氣相色譜/電噴霧四極桿飛行時間質譜儀,配7693自動進樣器、agilentmasshunter工作站。
樣品前處理
(1)稱取2g茶葉樣品,加入2~5ml飽和氯化鈉溶液,渦旋30s混勻后,浸潤5min,以5~10ml乙腈渦旋提取3min,4000rpm離心3min,殘渣再以乙腈渦動提取,合并上清液;向上清液加入1~5g無水氯化鈣,渦旋30s,4000rpm離心3min,取上清液以氮氣吹至近干;
(2)然后向步驟(1)得到的液體加入2ml乙酸乙酯,再加入40~90mgrgo@fe3o4,再加入100~200mggcb或100~200mgpsa,渦旋30s;,用磁鐵將固體物吸附至離心管底部與側壁或4000rpm離心3min;
(3)取1ml步驟(2)得到的有機相過0.22μm濾膜,得到用于測定茶葉中農藥殘留的待測液。
定量分析
(1)樣品前處理;
(2)以乙酸乙酯配制濃度依次為5、10、20、50、100μg/l的混合標準溶液,在選定的色譜條件和質譜參數下測,以目標化合物定量離子峰面積為縱坐標、濃度為橫坐標建立線性標準曲線;
(3)將步驟(1)所得快速測定茶葉中農藥殘留的待測液用氣相色譜-串聯質譜進行分析,分別根據出峰時間和定性定量離子對確定農藥種類,并將其峰面積分別代入對應農藥的標準曲線,從而得到待測液中各種農藥的含量。
氣相色譜條件
色譜柱:vf-1701ms柱(30m×0.25mm,0.25μm);色譜柱升溫程序:40℃保持1min,然后以30℃/min的升溫速率升至130℃,再以5℃/min升溫至250℃,而后以10℃/min升溫至300℃,保持5min;載氣為高純氦氣,流速為1.2ml/min;進樣口溫度:290℃;進樣量:1μl,不分流進樣。
質譜條件
離子源:ei源;離子化能量:70ev;離子源溫度:250℃;氣相色譜與質譜接口溫度:280℃;溶劑延遲:5min;掃描方式:全掃描與ms/ms掃描;一級質量掃描范圍:50~600amu,采集速率2spectra/s;二級質量掃描范圍:50~400,采集速率200ms/spectra;m/z分辨率為13500(fwhm);環氧七氯校正保留時間。
數據庫建立與檢索
采用全掃描模式針對農藥標準品建立一級精確質量數據庫,包括每種農藥的保留時間、特征分子離子式與相應的精確質量數,每種農藥包含3~5個特征分子離子。
對每種農藥采集最佳cid(誘導碰撞解離)下的二級質譜圖,每種農藥選擇1個豐度最高(當豐度最高的離子質量數較低時,為獲取準確的二級質譜信息,采用豐度次高但質量數較大的特征離子作為母離子)的特征離子作為母離子進行二級質譜采集。
農藥檢索流程見圖1。
結果分析
2.1凈化方法的比較
本發明對所使用的各種凈化材料無水氯化鈣、gcb、磁性石墨烯及psa的凈化效果及不同材料的組合效果進行了探討。結果見圖3。由圖中可見,單獨的一種材料或常見的gcb+psa凈化均不能起到良好的凈化效果,本發明提出的無水氯化鈣+gcb+磁性石墨烯(或psa)效果最為理想。
本發明還對添加無水氯化鈣的操作節點進行了探討。分別選擇均質前(本發明方案中步驟(1)提取之前加入)、均質后(本發明方案)以及離心分離后(本發明方案中步驟(3)離心分離后添加)等3個節點添加無水氯化鈣。從圖4凈化結果來看,在均質前、后添加的效果基本相當,而離心后添加凈化效果相對較差。但是對均質前和均質后兩種添加無水cacl2方式的結果進行上機對比檢測結果,圖5為其中23種代表性農藥殘留的檢測效果圖。從圖5中可以看出,均質后添加無水cacl2的提取效率要比較高,而且凈化效果也比較好,故選擇在均質后添加無水cacl2。
有多種金屬離子可以與多酚類等化合物螯合甚至生成不溶絡合物,經典的quechers方法中,通常采用無水硫酸鎂作為吸水劑。本發明也比較了無水氯化鈣與無水硫酸鎂的效果。在提取液中加入gcb后,分別加入無水氯化鈣與無水硫酸鎂,從圖6中可以看出,使用無水氯化鈣的效果比無水硫酸鎂更好。
基質效應考察
農藥分析的基質效應是指樣品中除分析物之外其它基質成分對待測物測定值的影響。在氣相色譜分析中,由于基質成分的存在減少了色譜系統中活性位點與待測物分子作用的機會,通常會表現為基質增強效應。茶葉基質復雜,含有大量多酚類、脂質、植物堿、糖類等。需要開發有效的凈化方法以去除基質干擾。
本發明對開發的高效凈化方法對166種農藥殘留的基質效應進行了評價。采集未施藥的茶青制成成品,經檢測未檢出含有農藥殘留。以此樣品作為空白樣品,按1.3步驟進行樣品前處理,獲得待測液,以此配制濃度為20μg/l的基質標準溶液,與同濃度的純溶劑標準溶液進行比較,基質效應按以下公式計算:基質效應me(%)=|(a2-a1)|/a1×100%,其中a1為乙酸乙酯溶液中農藥的響應值,a2為茶葉空白樣品溶液中農藥的響應值。
表1基質效應考察
基質效應處于0~20%為弱基質效應,20~50%為中等基質效應,大于50%為強基質效應,由表1可見,本發明開發的前處理方法能有效去除茶葉樣品的基質干擾。
回收率和精密度
按1.3步驟所述的樣品前處理方法,對空白茶葉樣品進行添加回收實驗。加標量為20μg/kg,以3次重復測定結果的平均值作為回收率數據,以其相對標準偏差(rsd)值作為精密度數據,結果見表2。
表2方法的回收率和精密度
- 還沒有人留言評論。精彩留言會獲得點贊!