測定大鼠血漿生物樣品中的DTPA?Zn的方法與流程
本發明屬于生物醫藥
技術領域:
,涉及一種可靠的方法用以測定生物體例如人、大鼠給予上述dtpa-金屬螯合劑后生物樣品例如血、尿等中的上述金屬螯合劑的含量,以評估這些金屬螯合劑的治療效果或其在體內的行為。特別地,本發明涉及一種測定大鼠血漿生物樣品中的dtpa-zn的方法。
背景技術:
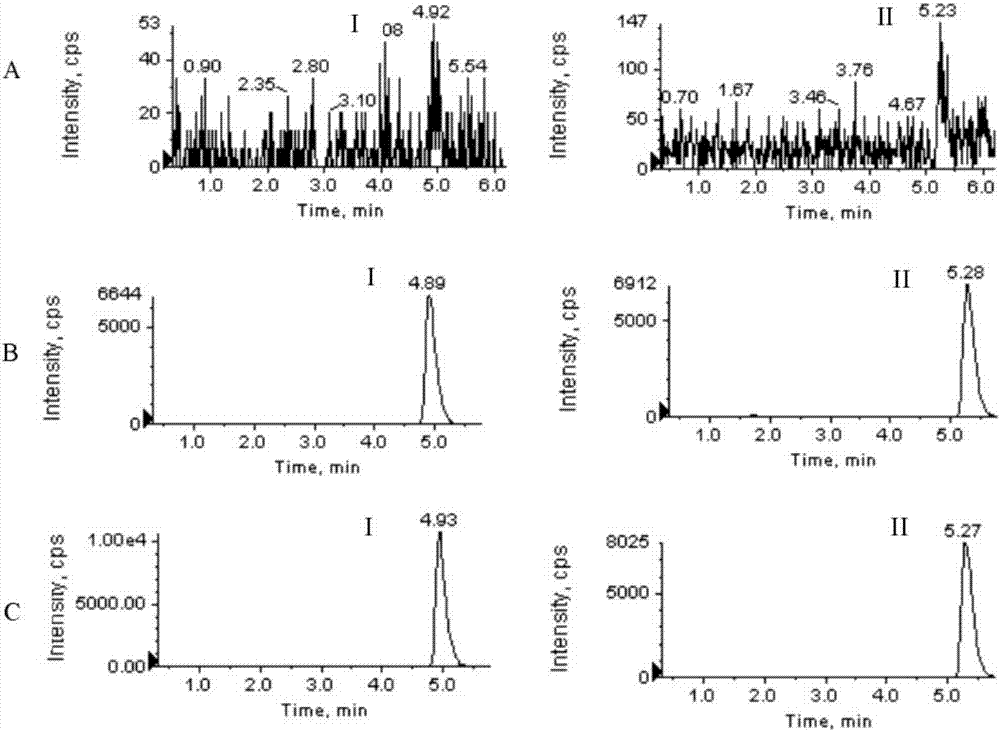
:鉛污染以及鉛中毒對人體健康的危害已經受到廣泛關注。鉛是人體非必需元素,主要通過呼吸道、消化道進入人體吸收,能夠在體內蓄積,對全身各系統和器官有毒性作用,主要影響神經、消化、血液系統,鉛污染和鉛中毒是需要重點解決的公共衛生問題[haoft,duxq,niuym,etal.progressinresearchoftheleadintoxication[j].chinjindmed(中國工業醫學雜志),2008,21:200-202.1;zhouqq,huff,xiacy,etal.studyprogressonhealthhazardsinoccupationallead-exposedworkers[j].chinjindmed(中國工業醫學雜志),2013,26:353-356]。在治療方面,依地酸二鈉鈣被作為首選藥物用于臨床[zhoujy,duanz,dengjx,etal.clinicalobservationonchronicleadpoisoningtreatedwithdifferentdosagesofcana-edta[j].occuphealthemergresue(職業衛生與應急救援),2002,20:159-160]。依地酸二鈉鈣治療鉛中毒有良好的療效,但在絡合鉛的同時,也絡合排出體內的鋅、鈣、錳、鐵、銅等,會造成體內必需微量元素的平衡失調,出現毒副作用,最重要的毒副作用是鋅缺失引起的腎損害。ca-dtpa(又可記作dtpa-ca)又名二亞乙基三胺五乙酸三鈉鈣鹽和zn-dtpa(又可記作dtpa-zn)又名二亞乙基三胺五乙酸三鈉鋅鹽,二者同屬氨羧絡合劑,于2004年8月由美國fda批準同時上市,用于進入放射性核素嚴重污染場所工作或停留前以及放射性核素沾染后的治療[cadadj,levient,bakerde.pentetatecalciumtrisodium(ca-dtpa)andpentetatezinctrisodium(zn-dtpa)[j].hospitalpharmacy,2005,40:65-71]。zn-dtpa與ca-dtpa在體內能選擇性地與放射性核素鑭(140la)、鈰(144ce)、钷(147pm)、镅(124am)、钚(239pu)等的陽離子形成穩定性的可溶性絡合物,很快經腎臟排出體外,從而減少了體內放射性物質的沉積量。由于ca2+同dtpa的絡合常數要小于zn2+[xuehl.thechelatortreatmentofcommonmetalintoxication[j].chemindoccupsafhealth(化工勞動保護),1989,10:22-26],ca-dtpa中dtpa更易于與核素的陽離子絡合,因此其促排作用強于zn-dtpa。但毒理學研究顯示,ca-dtpa易造成內源性的鋅缺失,從而使得與鋅有關的酶的活性受到嚴重的影響,其中包括dna與rna聚合酶、羧肽酶、碳酸酐酶等,可造成肝腎、腸黏膜的損傷和造血抑制等不良反應[shenby,ruantm,wudc.effectofzn-dtpaonthedecorporationofultra-uranium,ultra-plutoniumandlanthanideanditsapplication[j].foreignmedsci(raditmednuclmed)[國外醫學(放射醫學核醫學分冊)],1988,12:70-74;zhaoxc,wudc.toxicityofdtpaanditsapplicationonthedecorporationofnuclide[j].foreignmedsci(raditmed)[國外醫學(放射醫學分冊)],1980,4:211-215]。zn-dtpa的安全性較高,雖也能造成錳和鎂等微量元素的缺失,但不會引起缺鋅而產生嚴重的毒副作用,其毒性約為ca-dtpa的1/10~1/30[zhangzy,xuxw,zhuz.pentetatezinctrisodium[j].chinpharmj(中國藥學雜志),2007,42:557-558]。已有文獻采用石墨爐原子吸收分光光度計法測定鉛含量,考察了zn-dtpa對慢性鉛中毒小鼠的促排作用[yangs,chenl,yinyy,etal.studyoftheeffectofpentetatezinctrisodiumonexcretionofleadinleadpoisonedmice[j].pharmjchinpla(解放軍藥學學報),2011,27:147-149],然而石墨爐原子吸收分光光度計法測定方法復雜、成本高、靈敏度低,對于例如血、尿等生物樣品中的量難以滿足測定要求。另外,還有文獻[陳立,等,icp-ms法分析zn-dtpa對鉛中毒小鼠的促排作用,藥學學報(actapharmaceuticasinica)2014,49(11):1588-1592]報道,應用電感偶合等離子體質譜(icp-ms)測定生物樣本中鉛的濃度,考察核素促排藥zn-dtpa對鉛中毒小鼠的促排作用。小鼠一次性腹腔注射乙酸鉛溶液,每只染鉛1mg,建立急性鉛中毒模型,染鉛后4h腹腔注射zn-dtpa,連續給藥5天。同時設正常對照組、染鉛模型組、zn-dtpa與ca-dtpa聯用組。每天收集尿液,在實驗的第2、4和6天分別處死部分小鼠,取全血、雙側股骨、腦,消解處理后,用icp-ms測定鉛含量。據信結果表明zn-dtpa能顯著增加尿鉛的排出,降低血液、股骨和腦組織中的鉛含量。然而,由于dtpa-ca和dtpa-zn不但可以用于排除體內重金屬鉛,還可以排除體內的鑭、鈰、钷、镅、钚等重金屬甚至作為臨床應用藥品還可用于確診或疑似被钚、镅、鉅體內污染受試者的治療,并提高這些金屬元素的清除速率。在如此廣泛的應用環境下,僅僅考察鉛在體內的分布和含量顯然不足以評價dtpa這種金屬螯合劑的體內行為。因此,本領域仍然期待有可靠的方法來測定生物體例如人、大鼠給予上述金屬螯合劑后生物樣品例如血、尿等中的上述金屬螯合劑的含量,以評估這些金屬螯合劑的治療效果或其在體內的行為。技術實現要素:本發明的目的在于提供一種可靠的方法來測定生物體例如人、大鼠給予上述金屬螯合劑后生物樣品例如血、尿等中的上述金屬螯合劑的含量,以評估這些金屬螯合劑的治療效果或其在體內的行為。已經出人意料的發現,使用本發明液相色譜-串聯質譜(lc-ms/ms)法,能夠有效的實現上述目的。特別是,本發明使用液相色譜-串聯質譜(lc-ms/ms)法測定大鼠血漿生物樣品中的dtpa-zn,呈現出優異的方法學特征。本發明因此發現而得以完成。為此,本發明第一方面涉及一種測定大鼠血漿生物樣品中的dtpa-zn的方法,該方法使用液相色譜-串聯質譜(lc-ms/ms)法測定經處理的大鼠血漿生物樣品中的dtpa-zn的含量,包括如下步驟:(1)生物樣品的處理:(1a)取含有或不含有dtpa-zn的大鼠血漿50μl,置于1.5ml離心管中,加內標溶液即25μg/ml的edta-zn水溶液10μl或者不加內標溶液,0.1%氨水50μl,水400μl,渦流混合3min,全部上樣于固相萃取小柱上;(1b)上樣后依次用1ml水、1ml甲醇清洗,最后用含5%氨水的甲醇1ml洗脫;(1c)收集該洗脫液,吹干,用含0.05%氨水的50%甲醇150μl復溶,吸取20μl進行lc-ms/ms分析;(1d)標準曲線的制備:取不同濃度的dtpa-zn標準系列溶液分別加至空白人血漿中,配制成相當于濃度為1、2、5、10、20、50、100、和200μg/ml的標準曲線血漿樣品;取該血漿樣品50μl,依次加入內標溶液10μl,0.1%氨水50μl,水400μl,渦流混合3min,全部上樣于固相萃取小柱上,接著照以上(1b)和(1c)操作,根據lc-ms/ms分析結果繪制標準曲線,該標準曲線用于計算各種樣品中的目標物質含量;(2)液相色譜-串聯質譜測定:(2a)提供高效液相色譜儀和串聯質譜儀,所述高效液相色譜儀配備梯度泵和進樣器,所述串聯質譜儀配備電噴霧離子源和數據處理系統;(2b)色譜條件:所用的分析柱為shiseidoproteonavi品牌的色譜柱(其規格例如為5μm,250×4.6mmi.d.),柱前連接c18保護柱(其規格例如為4×3.0mmi.d.,例如美國phenomenex公司的保護柱),柱溫25℃,流動相為甲醇-2mm甲酸銨(例如,其中含0.03%氨水)(50:50,v/v),流速0.45ml/min;(2c)質譜條件:電噴霧離子化源(例如使用turboionspray源),負離子方式檢測;噴射電壓為-4000v;源溫度為400℃;卷簾氣(cur)為20;碰撞氣(cad)為4;掃描方式為多反應監測(mrm),用于定量分析的離子反應分別為m/z226.6→m/z204.5(zn-dtpa,ce為-15v)和m/z444.2→m/z319.2(內標edta-zn,ce為-34v),掃描時間為150msec;(3)數據處理與分析(3a)通過上述液相色譜-串聯質譜測定得到生物樣品中的目標物質含量;和,任選的(3b)用非房室模型計算選自下列的一下或多個藥動學參數:cmax、tmax、t1/2、mrt、auc0-t、vz、cl;其中,cmax為實測的最大血藥濃度,tmax為口服給藥后血藥濃度達峰時間,t1/2為藥物末端消除半衰期,mrt為藥物在體內平均滯留時間,血藥濃度-時間曲線下面積auc0-t由梯形法計算得到,vz為穩態時表觀分布容積,cl為清除率;以及,任選的(3c)計算給藥的生物利用度:在等當用藥劑量下,用第二給藥方式所得auc值除以第一給藥方式所得auc值再乘以100%所得百分數,作為第二給藥方式相對于第一給藥方式的相對生物利用度。根據本發明第一方面任一實施方案所述的方法,其中所述大鼠血漿是從給予或未給予zn-dtpa的大鼠靜脈血置于含肝素鈉的離心管中,2000~4000g離心10~30min(例如3000g離心20min)獲得的血漿。根據本發明第一方面任一實施方案所述的方法,其中所獲得的大鼠血漿任選的被置于-20℃冰箱中凍存,以等待測定。根據本發明第一方面任一實施方案所述的方法,其中所述大鼠靜脈血是從大鼠眼眶靜脈竇采血獲得的。根據本發明第一方面任一實施方案所述的方法,其中所用的內標為edta-znna2·xh2o。根據本發明第一方面任一實施方案所述的方法,其中所述固相萃取小柱在上樣前,先用1ml甲醇活化,再用1ml水平衡。根據本發明第一方面任一實施方案所述的方法,其中所述大鼠例如是sprague-dawley(sd)大鼠,本領域通常簡稱為sd大鼠。根據本發明第一方面任一實施方案所述的方法,其中所述高效液相色譜儀例如是美國安捷倫公司agilent1200型液相色譜儀。根據本發明第一方面任一實施方案所述的方法,其中所述串聯質譜儀例如是美國absciex公司api4000型串聯質譜儀;例如其配有turboionspray離子化源以及analyst1.5數據處理系統。根據本發明第一方面任一實施方案所述的方法,其中所述用于藥動學參數計算用的軟件為軟件,例如其版本為5.2.1版。根據本發明第一方面任一實施方案所述的方法,其中步驟(3a)中,各組的參數均用平均數據即“均數±標準差”的方式表示;進一步的,所述平均數據是以樣本數大于等于3所得的平均數。根據本發明第一方面任一實施方案所述的方法,其中所述第二給藥方式相對于第一給藥方式的相對生物利用度,以f(相對)%表征,該f(相對)%是通過以下計算式算得的:上式中:auc是曲線下面積(其單位例如是h*μg/ml),d是給藥劑量(其單位例如是mg/kg)。根據本發明第一方面任一實施方案所述的方法,當所述第一給藥方式是靜脈注射給藥(即靜注給藥)時,所述第二給藥方式相對于該靜注給藥方式而言的生物利用度為其絕對生物利用度,即以f(絕對)%表征,該f(絕對)%是通過以下計算式算得的:例如,氣管吸入給藥相對于靜脈注射給藥的絕對生物利用度f(絕對)%可用下式計算:又例如,氣管吸入給藥相對于肌內注射給藥的相對生物利用度f(相對)%可用下式計算:在本發明中,proteonavi色譜柱是一種采用在多孔球形硅膠填料表面鍵合丁基(c4)的高性能蛋白質-多肽分析專用色譜柱,該填料既具有硅膠類填料的高分離能力和耐壓性,又具有耐酸性、抑制蛋白質的吸附等特長。該色譜柱有時以proteonavis5標示。盡管本發明分析的dtpa金屬絡合劑是一種典型的小分子物質,分子量遠小于普通的蛋白質-多肽,然而,已經出人意料的發現,本發明僅在使用上述proteonavi色譜柱的色譜柱的條件下本發明方法才能獲得優良的方法學性能。例如,在使用ymc-c18、agilentextard-c18、資生堂pakcr-18(其與本文所用proteonavi柱是同一生產商)等c18柱時,dtpa金屬絡合物極其難以洗脫下來,例如在使用本發明色譜條件但改用這些c18柱時dtpa-za的保留時間大于43min且拖尾嚴重,然而無法解釋的是內標物質卻并未如此嚴重的延長保留時間(在不同的c18柱上保留時間約在5~6min之間)。又例如,在使用zorbaxedipsr-c8、dikma鉆石-c8、費羅門gemini-c8等c8柱時,dtpa金屬絡合物在色譜柱中不保留,即保留時間極其短暫,例如在使用本發明色譜條件但改用這些c8柱時dtpa-za的保留時間小于1.5min且與容易與溶劑等混雜在一起而無法獲得有效分離。根據本發明第一方面任一實施方案所述的方法,其中所述固相萃取小柱是型號為wax的固相萃取小柱,其例如購自waters公司。watersoasiswax固相萃取小柱在商業上通常是設計作為混合型弱陰離子交換反相吸附劑,對強酸性化合物具有高的選擇性和靈敏度的固相萃取小柱。已經出人意料的發現,僅在當使用上述oasiswax型固相萃取小柱的情況下,本發明方法才能獲得優良的方法學性能。而當改用其它品牌的固相萃取小柱例如美國艾杰爾的cleanertpwax固相萃取小柱、stratatm-x固相萃取小柱以及甚至是同一廠商的oasismax型固相萃取小柱時,遠遠無法獲得上述oasiswax型固相萃取小柱所獲得的優良結果。例如在照下文表2結果所涉及的方法進行試驗時,用上述三種其它品牌/型號的固相萃取小柱時,回收率2μg/ml、18μg/ml、180μg/ml三種濃度回收率分別在36~41%、45~54%、52~68%范圍內且各種小柱在三種不同濃度下所得rsd在8~19%范圍內波動,這種不同濃度下回收率呈現巨大差異且rsd大范圍波動的結果在生物樣品分析中是不可接受的。另外,在進行生物樣品處理時,在將樣品上樣到固相萃取小柱后,用含少量氨水的洗脫液進行洗脫是必要的,否則各濃度下的回收率比之于本發明下文表2回收率結果低20個百分點以上。在本發明上述操作方法的步驟中,雖然其描述的具體步驟在某些細節上或者語言描述上與下文具體實施方式部分的實例中所描述的步驟有所區別,然而,本領域技術人員根據本發明全文的詳細公開完全可以概括出以上所述方法步驟。本發明的任一方面的任一實施方案,可以與其它實施方案進行組合,只要它們不會出現矛盾。此外,在本發明任一方面的任一實施方案中,任一技術特征可以適用于其它實施方案中的該技術特征,只要它們不會出現矛盾。下面對本發明作進一步的描述。本發明所引述的所有文獻,它們的全部內容通過引用并入本文,并且如果這些文獻所表達的含義與本發明不一致時,以本發明的表述為準。此外,本發明使用的各種術語和短語具有本領域技術人員公知的一般含義,即便如此,本發明仍然希望在此對這些術語和短語作更詳盡的說明和解釋,提及的術語和短語如有與公知含義不一致的,以本發明所表述的含義為準。dtpa金屬絡合劑,例如dtpa的鈣金屬絡合劑或者dtpa的鋅金屬絡合劑,它們的體外檢測,例如在一些化學制品、制劑中的檢測,仍然是目前本領域技術人員遇到的一項巨大檢測難題,而它們體內生物樣品中的檢測難度更是遠遠的比體外檢測困難。特別是,目前國內外都沒有這些化合物體內分析的報導。dtpa的鈣金屬絡合劑,可縮寫為ca-dtpa或者dtpa-ca,其通常亦稱為ca-dtpa(dtpa-cana3);dtpa的鋅金屬絡合劑,可縮寫為zn-dtpa或者dtpa-zn,其通常亦稱為zn-dtpa(dtpa-znna3)。ca-dtpa、zn-dtpa以及本發明中使用到的內標物質edta-zn(為其二鈉鹽水合物edta-znna2·xh2o)的分子式分別為以下式a、式b和式c:其中,ca-dtpa可以靜脈注射和吸入給藥,分別以注射劑和粉吸入劑制劑形式提供于臨床,首批樣品于2004年在美國獲得批準。ca-dtpa在臨床上的適應癥與應用為:ca-dtpa作為一種緩解放射螯合劑被用于確診或疑似被钚、镅、鉅體內污染受試者的治療,并提高這些金屬元素的清除速率。ca-dtpa的劑量與給藥方面,fda的規范要求在受污染24h內給予首劑量的ca-dtpa進行治療,24h后,建議使用zn-dtpa維持螯合治療。螯合治療在體內受污染后的24h內使用效果最好;在確診或者懷疑受到污染時應及時給予螯合治療;如若不能立刻治療,在條件允許時應立刻給予螯合治療。在體內污染后的一段時間螯合治療仍然有效。放射性污染物在體內循環過程中或在間質液中時,ca的螯合效果最佳。螯合療效隨著體內污染過后放射性污染物被隔離在肝和骨中而降低。如若確診或疑似體內污染并非由钚、镅、鉅引起,需進行其他治療。具體的給藥方法是,污染途徑未確定或有可能存在多途徑污染時靜脈注射ca-dtpa;將5ml的ca-dtpa溶液(1g/5ml)用時3-4分鐘緩慢靜脈推注給藥,或將5ml的ca-dtpa溶液于5%葡萄糖水溶液、林格氏乳酸溶液、生理鹽水中稀釋成100-250ml靜脈輸液給藥;若受試者由于吸入而受污染,24h內給予霧化的ca-dtpa可作為治療途徑使用。另外,zn-dtpa可以靜脈注射和吸入給藥,分別以注射劑和粉吸入劑制劑形式提供于臨床,首批樣品于2004年在美國獲得批準。zn-dtpa在臨床上的適應癥與應用為:zn-dtpa適用于確診或疑似的钚、镅、鉅造成的體內污染,并加快其清除速率。zn-dtpa的劑量與給藥方面,fda的規范要求,在受污染24h內給予首劑量的ca-dtpa進行治療;在此期間ca-dtpa比zn-dtpa療效更好;如果ca-dtpa無效,給予zn-dtpa進行首次治療。給藥第二天若額外的螯合療法被建議給予,使用zn-dtpa進行常規治療。若zn-dtpa無效,螯合治療使用ca-dtpa維持。含zn的伴隨礦物質補充劑應被給予。對成年人和青少年,靜脈注射1g劑量的zn-dtpa;對于12歲以下的兒童,靜脈注射14mg/kg的zn-dtpa,用量切勿超過1g。24h后的螯合持續治療使用zn-dtpa,對成年人和青少年,靜脈注射1g劑量的zn-dtpa,每天一次;對于12歲以下的兒童,靜脈注射14mg/kg的zn-dtpa,每天一次,用量勿超過1g。dtpa的螯合治療在體內受污染后的24h內使用效果最好。在確診或者懷疑受到污染時應及時給予螯合治療。如若不能立刻治療,在條件允許時應立刻給予螯合治療。在體內污染后的一段時間螯合治療仍然有效。放射性污染物在體內循環過程中或在間質液中時,zn-dtpa的螯合效果最佳。螯合療效隨著體內污染過后放射性污染物被隔離在肝和骨中而降低。如若確診或疑似體內污染并非由钚、镅、鉅引起,需進行其他治療。具體的給藥方法是,污染途徑未確定或有可能存在多途徑污染時靜脈注射zn-dtpa;將5ml的zn-dtpa溶液(1g/5ml)用時3-4分鐘緩慢靜脈推注給藥,或將5ml的zn-dtpa溶液于5%葡萄糖水溶液、林格氏乳酸溶液、生理鹽水中稀釋成100-250ml靜脈輸液給藥;若受試者僅由于吸入途徑而受污染,24h內給予霧化的zn-dtpa可以作為治療途徑使用。通過建立本發明方法,為dtpa的金屬螯合物在給予動物(例如大鼠、人等)后體內生物樣品(例如血液、尿液、唾液等)中這些物質的含量測定提供了可能。本發明建立的分析方法具有優異的方法學性能。附圖說明圖1:dtpa-zn和edta-zn的二級質譜圖,圖中,a為dtpa-zn,b為edta-zn(內標)。圖2:大鼠血漿樣品的mrm色譜圖,圖中,a為空白血漿,b為加內標空白血漿,c為給藥血漿樣品;另外,圖中,峰i為dtpa-zn,峰ii為內標edta-zn。圖3:dtpa-zn樣品測定階段的一條標準曲線(y=0.0706x+0.0309)。具體實施方式本發明所提供的以下實施例僅用于解釋目的而不是用于,也不應被解釋為以任何方式限制本發明。本領域那些技術人員將會認識到在不超越本發明的精神或范圍的情況下可對以下實施例做出常規變化和修改。本發明的一個目的在于更好地理解dtpa-zn的體內處置規律,本發明試驗建立并驗證了定量檢測生物樣品中dtpa-zn的含量的液相色譜-串聯質譜(lc-ms/ms)法,同時考察dtpa-zn在大鼠體內的藥代動力學及生物利用度情況。一、實驗材料1、藥品、試劑與材料zn-dtpa(dtpa-znna3)原料,白色粉末,含量84.95%,自制。zn-dtpa粉霧劑,白色粉末,含量:53.45%,自制。zn-dtpa注射液,自制。乙二胺四乙酸二鈉鋅鹽水合物(內標,edta-znna2·xh2o),白色結晶性粉末,純度>98.0%,購自梯希愛(上海)化成工業發展有限公司。甲醇(色譜純)為美國fisher公司產品;甲酸(分析純)、甲酸銨(分析純)均購自國藥集團化學試劑有限公司;水為娃哈哈去離子水。固相萃取小柱購自waters公司,型號為wax,1cc。2、儀器液相色譜-質譜聯用儀(lc-ms/ms):美國absciex公司api4000型串聯質譜儀(配有turboionspray離子化源以及analyst1.5數據處理系統);美國安捷倫公司agilent1200四元梯度泵和自動進樣器。ba11os型萬分之一電子分析天平(德國sartorius公司);qb-600型旋渦混合器(海門市其林貝爾儀器制造有限公司出品);tdw-1型恒溫加熱儀(北京通達科技有限責任公司);wyk-45d型空氣壓縮機(天津達因儀器廠)。3、實驗動物sprague-dawley(sd)大鼠,雄性,體重為260±20g,許可證號為scxk(京)2012-0001,合格證號:11400700051827,購自北京維通利華實驗動物技術有限公司。二、實驗方法1、lc-ms/ms條件色譜條件:分析柱為shiseidoproteonavi(5μm,250×4.6mmi.d.,日本shiseido公司),連接c18保護柱(4×3.0mmi.d.,美國phenomenex公司),柱溫25℃,流動相為甲醇-2mm甲酸銨(含0.03%氨水)(50:50,v/v),流速0.45ml/min,內標為edta-znna2·xh2o。質譜條件:電噴霧離子化源(turboionspray源),負離子方式檢測;噴射電壓為-4000v;源溫度為400℃;卷簾氣(cur)為20;碰撞氣(cad)為4;掃描方式為多反應監測(mrm),用于定量分析的離子反應分別為m/z226.6→m/z204.5(zn-dtpa,ce為-15v)和m/z444.2→m/z319.2(內標edta-zn,ce為-34v),掃描時間為150msec。2、生物樣品處理取血漿50μl,加內標溶液(25μg/mledta-zn水溶液)10μl,50μl0.1%氨水,400μl水,渦流混合3min,全部上樣于固相萃取小柱上。固相萃取小柱上樣前先用1ml甲醇活化,再用1ml水平衡。上樣后依次用1ml水、1ml甲醇清洗,最后用1ml甲醇(含5%氨水)洗脫。收集洗脫液吹干,用150μl50%甲醇(含0.05%氨水)復溶,吸取20μl進行lc-ms/ms分析,測定并計算生物樣品中的目標物質的含量。3、zn-dtpa的大鼠實驗方法雄性sd大鼠18只,隨機分成3組,每組6只,分別為靜脈注射給予zn-dtpa注射液、肌肉注射給予zn-dtpa注射液和氣管噴入zn-dtpa粉霧劑組,劑量均為zn-dtpa50mg/kg(以zn-dtpa計算)。動物給藥前未禁食,自由飲水,分別于給藥前及給藥后0.03、0.08、0.17、0.25、0.5、0.75、1、2、4和6h眼眶靜脈竇采血0.2ml,置于含肝素鈉的離心管中,3000g離心20min,取血漿置于-20℃冰箱中凍存待測。4、數據處理與分析藥動學參數用軟件(version5.2.1,美國)的非房室模型計算。cmax為實測的最大血藥濃度,tmax為口服給藥后血藥濃度達峰時間,t1/2為藥物末端消除半衰期,mrt為藥物在體內平均滯留時間,血藥濃度-時間曲線下面積auc0-t由梯形法計算得到,vz為穩態時表觀分布容積,cl為清除率。組平均數據用“均數±標準差”(mean±sd,n≥3)表示。生物利用度的計算:由氣管吸入和靜注(或肌注)的auc比值計算得到相應劑量zn-dtpa粉霧劑的絕對(或相對)生物利用度,計算公式如下:式中,auc:曲線下面積(h*μg/ml);d:給藥劑量(mg/kg)三、結果與評價1、lc-ms/ms定量方法學及驗證(1)方法的選擇性將空白血漿、加標空白血漿和大鼠給藥后的血漿樣品,按上文所述操作進行lc-ms/ms分析,得到mrm色譜圖。經色譜圖比較可見,大鼠血漿中的內源性物質均不干擾待測物及內標的測定。待測物的二級全掃描質譜圖見圖1,大鼠血漿樣品的mrm色譜圖見圖2。zn-dtpa和內標的色譜保留時間(tr)分別為4.9min和5.3min(圖2)。(2)標準曲線和定量下限取不同濃度的dtpa-ca標準系列溶液分別加至空白大鼠血漿中,配制成相當于濃度為1、2、5、10、20、50、100、和200μg/ml的標準曲線血漿樣品;取該血漿樣品50μl,依次加入內標溶液10μl,0.1%氨水50μl,水400μl,渦流混合3min,全部上樣于固相萃取小柱上,接著上樣后依次用1ml水、1ml甲醇清洗,最后用含5%氨水的甲醇1ml洗脫;收集該洗脫液,吹干,用含0.05%氨水的50%甲醇150μl復溶,吸取20μl進行lc-ms/ms分析;根據lc-ms/ms分析結果繪制標準曲線,該標準曲線用于計算各種樣品中的目標物質含量;以待測物濃度為橫坐標,待測物與內標物的峰面積比值為縱坐標,用加權(w=1/x2)最小二乘法進行回歸運算,求得zn-dtpa的直線回歸方程,標準曲線見圖3。zn-dtpa在1~200μg/ml的范圍內,濃度與峰面積比之間呈良好的線性關系(r2>0.998)。由6個樣本分析的精密度和準確度,確定定量下限為1μg/ml。(3)方法的精密度與準確度用大鼠空白血漿加內標配制zn-dtpa低、中和高三個濃度(2,18和180μg/ml)的qc樣品,在一日內對每一濃度進行6樣本分析,得到本法的日內精密度和準確度,連續進行6樣本分析,得到日間精密度和準確度。表1的結果顯示,方法的精密度和準確度均符合生物樣品定量分析要求。表1:zn-dtpa的精密度與準確度(n=18)(4)回收率和基質效應配制3個濃度的大鼠血漿qc樣品,每一濃度進行3樣本分析,與相同濃度的標準溶液樣品進行峰面積比較得到回收率,數據見表2。從表中結果可見,低、中和高三個濃度的回收率基本一致。表2:zn-dtpa的血漿回收率(n=3)在3個qc濃度水平,應用空白血漿提取后加標(即,加內標物質)的方法,考察了zn-dtpa在大鼠血漿樣品中的基質效應,結果見表3。實驗結果表明大鼠血漿中zn-dtpa的基質效應均在85%~115%之間,血漿基質對zn-dtpa的測定沒有顯著的影響。表3:zn-dtpa的基質效應(n=5)qc濃度(μg/ml)基質效應(%)相對標準差(rsd%)相對偏差(re%)299.7±5.35.3-0.31892.4±6.87.4-7.6180105.5±5.35.15.5(5)穩定性考察在3個qc濃度水平,考察了zn-dtpa血漿樣品在各種實驗條件下的穩定性。結果表明,zn-dtpa的rsd均小于9.9%,re在-8.25~9.87%的范圍內(表4),二者的穩定性符合本試驗要求。表4:血漿樣品中dtpa-zn的穩定性(n=4)2、dtpa-zn的大鼠藥代動力學本發明采用雄性大鼠靜脈注射、肌肉注射和氣管吸入給予50mg/kgzn-dtpa后,考察它們的血漿藥代動力學,在不同取樣時間點,測定三種給藥方式中原藥平均血漿藥物濃度(在本申請中未具體提供這些數據),根據這些平均血漿藥物濃度數據可以繪制平均藥-時曲線。用winnonlin藥代動力學程序對所測數據進行分析,得到主要的藥代動力學參數,結果顯示,靜脈注射、肌肉注射和氣管吸入三種方式的t1/2分別在0.3~0.4h范圍內、0.4~0.6h范圍內、和0.7~0.9h范圍內,三種方式的cmax分別在200~300μg/ml范圍內、90~140μg/ml范圍內、和60~80μg/ml范圍內,三種方式的auc(0-t)分別在80~95h*μg/ml范圍內、85~95h*μg/ml范圍內、和45~55h*μg/ml范圍內。另外,經計算,大鼠經氣管吸入zn-dtpa粉霧劑(50mg/kg)后的體內吸收和消除均較快,原藥的達峰時間為3min,t1/2為0.81±0.17h,體內平均駐留時間mrt為0.91±0.24h,給藥后2.0h血藥濃度降至峰濃度的1/10以下,絕對生物利用度f為55.32%,與肌肉注射相比,相對生物利用度為53.37%。這些結果表明本發明液相色譜-串聯質譜法對于測定生物樣品中的dtpa金屬絡合物是可行的。總體上講,本發明建立并驗證了定量檢測生物樣品中zn-dtpa的lc-ms/ms方法,方法的特異性、重現性和準確性均符合藥代動力學研究的要求。大鼠靜脈注射50mg/kg的zn-dtpa注射液后,原藥在血漿中很快消除,t1/2為0.38h,給藥4.0h后血漿濃度降至檢測限以下。大鼠肌肉注射zn-dtpa注射液后,原藥的吸收和消除亦較快,tmax在8min左右,t1/2為0.5h,平均駐留時間mrt為0.6h左右,生物利用度為103.6%。大鼠氣管吸入zn-dtpa粉霧劑后,原藥吸收和消除均較快,tmax在3min左右,t1/2為0.8h,平均駐留時間mrt為0.9h,絕對生物利用度為55.32%,與肌肉注射相比,相對生物利用度為53.37%。參考資料:國家食品與藥品監督管理局:《化學藥品非臨床藥代動力學研究技術指導原則》,2005.3。以上通過本發明較佳實施例對本發明的精神作了詳細闡述。本領域技術人員理解,凡是根據本發明技術實質對以上實施例所作的任何修改、等同變化與修飾,均落在本發明的保護范圍內。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1