一種用于磷酸肽富集和分離的離心式裝置的制作方法
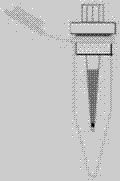
本發明涉及一種用于磷酸肽富集和分離的離心式裝置,屬于分析化學領域。
背景技術:
磷酸化是蛋白質最常見的翻譯后修飾之一,是指由蛋白激酶催化在底物蛋白質氨基酸殘基上添加共價結合的磷酸根基團。其逆反應為由蛋白磷酸酶催化的去磷酸化過程。蛋白激酶和磷酸酶獨立工作,并在平衡中調節蛋白質的功能。有研究表明,在由基因編碼的蛋白中,約30%會發生磷酸化。蛋白質的磷酸化和去磷酸化這一可逆過程幾乎調節著生命活動的所有過程,包括細胞的增殖、發育和分化,分子識別和信號傳導,神經活動,肌肉收縮,新陳代謝,腫瘤發生等。蛋白質磷酸化在1906年由洛克菲勒醫學研究所的phoebuslevene首次報道,他發現了磷酸化的卵黃蛋白。然而,直到1954年,蛋白質的磷酸化過程才由burnett和kennedy報道發現。1955年fisher和krebs揭示了可逆的磷酸化過程在生物調節機制中的重要性,并因此獲得了諾貝爾生理和醫學獎。由于蛋白質磷酸化具有十分廣泛而顯著的生理意義,因此關于磷酸化的研究成為蛋白質組學領域里重要的焦點之一。質譜是目前蛋白質組翻譯后修飾鑒定研究最有力的工具。然而目前以生物質譜為主要研究手段的磷酸化蛋白質組學研究還面臨著一系列技術挑戰:磷酸化蛋白質在生物體內含量極低,研究認為,一般在某一特定的時間,磷酸化的蛋白質相對于生物體的總體蛋白質而言,含量僅為2~3%;在質譜檢測時,大量的非磷酸化肽段會對磷酸化肽段的信號造成干擾和抑制;磷酸化肽段具有負電性,在質譜分析常用的正離子模式下,離子化困難,信號會受到抑制。這些問題都給磷酸化肽段的規模化鑒定帶來不小的困難。因而在對較復雜的樣本進行質譜分析前,先對磷酸化肽段進行特異性的富集,提高其在樣本中的含量,并去除非磷酸肽的干擾,對于提高磷酸肽的分析靈敏度和鑒定規模就顯得尤為重要。目前常用的磷酸肽富集方法主要有金屬氧化物親和色譜(moac)、固相金屬離子親和色譜(imac)、離子交換色譜(sax/scx)等。金屬氧化物親和色譜的原理是利用過渡金屬氧化物與磷酸根的可逆結合選擇性富集磷酸化肽段,常用的金屬氧化物有二氧化鈦(tio2)、二氧化鋯(zro2)等。二氧化鈦因其富集效果好、成本較低而得到了廣泛應用。但其依然存在一些問題:(1)所需樣品起始量大,(2)實驗步驟繁瑣,極為費時費力,(3)樣品分析通量有限,(4)富集鑒定結果的重現性較差。此外,由于目前使用的生物質譜儀器在掃描速度方面的局限性,富集后的磷酸肽樣品一般需要經過反相色譜分離為多個餾分,進一步降低樣品的復雜程度后再進行質譜分析,從而可以有效提高磷酸肽的鑒定規模。然而目前廣泛采用的反相色譜柱式肽段分離模式,樣本損失較大,而且需要配合液相色譜儀器使用,樣品處理通量有限。
技術實現要素:
本發明的目的是提供一種用于磷酸肽富集和分離的離心式富集裝置,具有快速、操作簡便、便于微量樣本分析和高通量的特點,可平行處理多個樣品。
本發明所提供的用于磷酸肽富集和分離的離心式富集裝置,包括富集槍頭、分離槍頭和餾分收集器;
所述富集槍頭內填充有固相萃取膜片a和二氧化鈦填料,所述固相萃取膜片a上覆蓋有八烷基膜,所述固相萃取膜片a靠近所述富集槍頭的出液口;
所述分離槍頭內填充有固相萃取膜片b和c18反相填料(十八烷基硅烷鍵合硅膠),所述固相萃取膜片b上覆蓋有十八烷基膜,所述固相萃取膜片b靠近所述分離槍頭的出液口;
所述富集槍頭可設置于所述分離槍頭內,即以串聯的方式配合;
所述富集槍頭和所述分離槍頭均可與所述餾分收集器配合。
上述的離心式富集裝置中,所述富集槍頭和所述分離槍頭均為移液器槍頭;
所述富集槍頭可采用10μl、200μl或1000μl等不同規格,優選200μl規格的槍頭;
所述分離槍頭可采用10μl或200μl等不同規格,優選10μl規格的槍頭。
上述的離心式富集裝置中,所述富集槍頭內設置一層所述八烷基膜,每層所述八烷基膜的厚度為0.2mm~0.5mm;
所述二氧化鈦填料的用量可為1~10mg。
上述的離心式富集裝置中,所述分離槍頭內設置3層所述十八烷基膜,每層所述十八烷基膜的厚度為2mm~3mm;
所述c18反相填料的用量可為1~10mg。
上述的離心式富集裝置中,所述固相萃取膜片a和所述固相萃取膜片b均可采用empore萃取膜片,其是以聚四氟乙烯(ptfe)纖維薄膜為骨架,纖維之間在有以反相硅膠為基質或以聚苯乙烯-二乙烯苯(ps-dvb)為基質的spe吸附劑顆粒。所述empore萃取膜片的大小尺寸有不同,厚度大約<1mm。
上述的離心式富集裝置中,所述富集槍頭和所述分離槍頭均通過適配器與所述餾分收集器配合,所述適配器可為一圓柱體,具體可采用上下內徑不等的圓柱體。
上述的離心式富集裝置中,所述餾分收集器可為離心管,如ep管,可選用600μl、1500μl和2000μl等不同規格,優選1500μl。
本發明離心式富集裝置可用于富集和分離磷酸肽,將所述富集槍頭和所述分離槍頭串聯,以離心方式進行樣品的上樣、清洗、洗脫和分離,即在一個裝置中完成磷酸肽的富集和反相分離,從而將二者有機結合,不僅精簡了實驗步驟,減少了樣品損失,并降低了實驗的勞動強度;而且該離心式富集分離裝置可與臺式離心機配合使用,一次平行處理24個樣品,大大提高了樣本處理通量,非常適合應用于大規模、微量臨床樣品的磷酸肽分析。
可按照下述步驟用于富集和分離磷酸肽:
(1)將含有磷酸肽的蛋白質酶解產物加入至所述離心式富集裝置中的所述富集槍頭中,然后將所述富集槍頭與所述餾分收集器配合,將所述餾分收集器置于離心機中進行離心分離,即將所述磷酸肽富集于所述二氧化鈦填料中;
(2)將所述富集槍頭設置于所述分離槍頭內,然后將所述分離槍頭與所述餾分收集器配合,采用不同乙腈含量的堿性洗脫液進行梯度洗脫,通過所述餾分收集器收集梯度洗脫的流穿液,即實現對所述磷酸肽的分離。
步驟(1)中,采用臺式離心機離心,使磷酸肽保留于所述二氧化鈦填料中,非磷酸肽隨流穿液流入所述餾分收集器中;收集所述餾分收集器中的流穿液,反復上樣3次,從而達到充分富集磷酸肽的目的;在所述富集槍頭中加入清洗液后離心,清洗去除吸附于tio2上的非磷酸肽。
步驟(2)中,即將所述富集槍頭、所述分離槍頭和所述餾分收集器串聯;將富集的磷酸肽洗脫至所述分離槍頭中,同時利用c18反相填料對疏水性不同的磷酸肽在乙腈含量不同的洗脫液中保留能力的差異,對磷酸肽實現反相分離。
如富集和分離小鼠肝臟蛋白質酶解產物中的磷酸肽時,可采用腈、乳酸、水和三氟乙酸(64:20:12:4,v/v)的混合液溶解樣品;可采用乙腈、水和三氟乙酸(80:15:5,v/v)的混合液作為清洗液。
經過上述富集、分離后的磷酸肽樣品可直接用于液相色譜-質譜聯用鑒定,不需要對樣品進行脫鹽預處理,減少了繁瑣的前處理操作造成的樣本損失。同時,高ph反相分離與液相色譜-質譜聯用時使用的低ph反相分離具有良好的正交性,能夠有效降低富集產物的復雜程度,提高磷酸肽的質譜鑒定效果。另外,將分餾后的餾分交叉合并可將色譜保留行為差異較大的肽段混合,有效提高分餾與后續液相色譜-質譜鑒定中色譜分離的正交性。
本發明具有以下優點:
1)通過tio2富集槍頭和c18反相填料分離槍頭將磷酸肽的富集和反相分離有機結合,有效精簡了實驗步驟,減少了樣品損失;
2)該裝置采用高ph反相分離模式,避免了常用的scx分離中,肽段脫鹽和凍干等一系列繁瑣的實驗操作步驟和樣本損失;
3)該裝置可與實驗室常用的臺式離心機配合使用,通過離心方式進行樣品的上樣、清洗、洗脫和分離,降低了實驗的勞動強度和人為因素干擾,同時可實現多達24個樣品的平行處理,大幅提高樣品處理通量和分析的重現性;
4)該裝置簡單易制,成本低;
5)該裝置非常適合應用于大規模、微量臨床樣品的磷酸肽分析,在蛋白質組翻譯后修飾的富集研究中具有良好的應用潛力。
附圖說明
圖1為本發明離心式富集裝置的富集槍頭的結構示意圖。
圖2為本發明離心式富集裝置的分離槍頭的結構示意圖。
圖3為本發明離心式富集裝置的餾分收集器的結構示意圖。
圖4為本發明離心式富集裝置的富集槍頭與餾分收集器配合時的示意圖。
圖5為本發明離心式富集裝置的富集槍頭、分離槍頭與餾分收集器串聯配合時的示意圖。
圖6為本發明離心式富集裝置應用于小鼠肝臟蛋白質磷酸肽富集分離的實驗流程圖。
圖7為利用本發明離心式富集裝置進行的一次實驗三個餾分的磷酸肽鑒定結果的韋恩圖。
圖8為利用本發明離心式富集裝置重復三次實驗的磷酸肽鑒定結果的韋恩圖。
具體實施方式
下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
本發明提供的離心式富集裝置包括富集槍頭、分離槍頭和餾分收集器,其中,富集槍頭的結構示意圖如圖1所示,它采用規格為200μl的槍頭,富集槍頭內填充有1層覆蓋有八烷基膜的固相萃取膜片1(empore,直徑47nm)和2mg二氧化鈦填料2,且覆蓋有八烷基膜的固相萃取膜片1靠近槍頭的出液口。分離槍頭的結構示意圖如圖2所示,它采用規格為10μl的槍頭,分離槍頭內設有3層且覆蓋有十八烷基膜的固相萃取膜片3(empore,直徑47nm)和3mgc18反相填料4,且覆蓋有十八烷基膜的固相萃取膜片3靠近槍頭的出液口。餾分收集器的結構示意圖如圖3所示,它采用規格為1.5ml的ep管,其管口處設有適配器5,用于與富集槍頭和分離槍頭配合。富集槍頭與餾分收集器配合時的示意圖如圖4所示,富集槍頭、分離槍頭和餾分收集器三者串聯配合時的示意圖如圖5所示。
采用本發明上述離心式富集裝置應用于小鼠肝臟蛋白質磷酸肽富集分離時,可按照圖4所示的流程進行:
(1)小鼠肝臟蛋白質提取:取10周齡c57bl/6小鼠的肝臟于ep管中,加入配置好的尿素裂解液(9m尿素溶于20mmhepes,加入適量蛋白酶抑制劑和磷酸酶抑制劑),使用高通量組織研磨器破碎組織后將樣品置于冰上,使用超聲破碎儀進行蛋白質提取,取上清。
(2)小鼠肝臟蛋白質酶解肽段溶液的制備:取1mg鼠肝蛋白,用尿素裂解液稀釋一倍,在溶液中加入二硫蘇糖醇(dtt,終濃度4.5mm),55℃金屬浴孵育30min。冰上冷卻至室溫后,加入碘乙酰胺(iaa,終濃度10mm),充分混勻,室溫避光靜置30min。稀釋蛋白溶液后,按胰蛋白酶和蛋白質1:100(w/w)加入胰蛋白酶,置于37℃恒溫箱中酶解過夜后,使用sep-pakc18脫鹽小柱(waters)將產物肽段脫鹽并凍干。酶解產物用200μl上樣液(乙腈/乳酸/水/三氟乙酸,64:20:12:4,v/v)溶解。
(3)材料清洗與活化:分別使用200μl清洗液(乙腈/水/三氟乙酸,80:15:5,v/v)和200μl上樣液(乙腈/乳酸/水/三氟乙酸,64:20:12:4,v/v)清洗tio2富集槍頭,500g離心;分別使用200μl純乙腈和200μl15%濃氨水平衡c18分離槍頭,500g離心。
(4)上樣富集:將tio2富集槍頭固定于餾分收集器上(如圖2所示),將肽段溶液轉移至富集槍頭,500g離心。收集餾分收集器中的流穿液,重復上樣,共富集3次。
(5)清洗:使用200μl清洗液(乙腈/水/三氟乙酸,80:15:5,v/v)清洗去除非磷酸肽,500g離心,重復3次。
(6)洗脫、分離:將tio2富集槍頭插入c18分離槍頭中,將二者串聯結合,并固定于新的餾分收集器中(如圖3所示)。依次加入梯度洗脫液各200μl:1)15%濃氨水,500g離心;2)2%乙腈+98%(15%濃氨水),500g離心;3)5%乙腈+95%(15%濃氨水),500g離心;4)8%乙腈+92%(15%濃氨水),500g離心;5)10%乙腈+90%(15%濃氨水),500g離心;6)40%乙腈+60%(15%濃氨水),500g離心。分別收集梯度洗脫的流穿液,兩兩合并:2%+8%乙腈、5%+10%乙腈、0+40%乙腈,凍干后-80℃保存。
(7)質譜檢測:將富集后的3個餾分均以20μl的水/甲酸(90:10,v/v)溶解,取10μl,進行質譜鑒定。質譜條件:正離子掃描模式;電噴霧電壓為2.2kv,一級質譜分辨率為120000,一級agc為5.0e5,最大離子注入時間為50ms,全掃描質荷比范圍為300~1400;二級質譜母離子的選擇采用數據依賴模式,hcd碰撞能量設定為32%,agc為1.0e2,最大離子注入時間為250ms,動態排除時間設為18s,質譜采集時間為78min。
(8)搜庫:proteomediscoverer1.4軟件搜庫分析,以mascot搜索引擎對數據進行檢索,蛋白酶切類型選擇trypsin,允許最大肽段漏切位點數設為2,一級搜索質量偏差≤15ppm,二級搜索質量偏差≤0.5da,固定修飾為carbamidomethyl(c),可變修飾為oxidation(m),acetyl(proteinn-term),phosphorylation(st)和phosphorylation(y)。肽段水平假陽性率(fdr)≤1%。
(9)磷酸肽鑒定結果:三個餾分共計鑒定到10793個磷酸化位點,對應7333個非冗余磷酸肽,富集選擇性為75.8%。三個餾分的磷酸肽鑒定數量及富集選擇性見表1,韋恩圖見圖7。同樣條件下未經餾分分離,直接進行質譜鑒定只能得到3405個磷酸肽,富集選擇性為74.0%,說明該分餾策略可以在保證富集選擇性的前提下顯著提高磷酸肽的鑒定規模。將分餾后的餾分交叉合并可將色譜保留行為差異較大的肽段混合,有效提高分餾與后續液相色譜-質譜鑒定中色譜分離的正交性,比采用順序合并更能使肽段均勻分布在整個色譜梯度洗脫的范圍內,充分利用質譜的掃描時間。使用該裝置,3次重復實驗分別鑒定到7333個、7587個、7962個磷酸肽,韋恩圖見圖8。富集選擇性分別為73.1%、73.5%和69.1%。其中50.2%的磷酸肽至少在兩次實驗中被鑒定到,充分證明其在復雜樣本磷酸化分析中的應用價值。
表1三個餾分的磷酸肽鑒定數及富集選擇性
- 還沒有人留言評論。精彩留言會獲得點贊!