用于等離子體金芯片的蛋白點樣緩沖液的制作方法
本發明屬于生物技術領域,具體而言,涉及用于等離子體金芯片的蛋白點樣緩沖液。
背景技術:
等離子體材料通常指的是貴金屬(例如金)及其復合物,其在特定波長范圍內的光照下具有獨特的表面等離子體共振效應。因為具有特定的結構和表面化學性質,這種等離子體材料在近紅外區(nir-fe,650-1700nm)具有熒光增強效應,通過微量點樣技術在這種材料上固定特定的蛋白(抗體或抗原),可實現生物標志物的檢測。
目前,臨床領域應用的免疫檢測方主要有免疫比濁、免疫層析、酶聯免疫(elisa)、化學發光免疫分析(clia),以及近些年發展應用的蛋白芯片-免疫熒光法。由于微量生物活性物質(如抗原或抗體)固定到芯片上后很容易喪失活性,蛋白芯片法都涉及到一項關鍵的技術,即保持蛋白芯片的穩定性。因此,研究如何保持蛋白芯片的穩定性具有十分重要的意義。
技術實現要素:
本發明旨在至少在一定程度上解決相關技術中的技術問題之一。為此,本發明的一個目的在于提出用于等離子體金芯片的蛋白點樣緩沖液,該緩沖液能夠在較長時間內保持被固定蛋白的生物活性、縮短點樣后的孵育時間、提高蛋白在芯片上的固定能力。
本發明是基于以下發現提出的:目前常用的等離子體金芯片蛋白點樣緩沖液是甘油或磷酸鹽緩沖液,這類緩沖液只能對芯片上的蛋白質起保濕作用,短時間內防止因過度干燥而引起的蛋白質失活,并不能長期有效地保持其生物活性。保持芯片上蛋白質活性的方法通常是將芯片長期保存在-20℃以下的環境中,并且不能凍融,而在2-8℃冰箱存放一周或37℃破壞一天,其生物活性就損失了50%以上。此外,用常規方法點樣時,蛋白質需要孵育12~24h才能固定到芯片上。發明人意外發現,通過采用海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉配置得到的蛋白點樣緩沖液,可以有效解決相關技術中存在蛋白質在芯片上的固定能力差,并且被固定的蛋白質容易喪失活性的問題。
由此,根據本發明的一個方面,本發明提出了一種用于等離子體金芯片的蛋白點樣緩沖液,所述蛋白點樣緩沖液包含海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉。
本發明用于等離子體金芯片的蛋白點樣緩沖液包含海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉。該緩沖液與目前常用甘油或磷酸鹽緩沖液相比,不僅能使蛋白與芯片基底的結合更牢固,還能減少點樣后的孵育時間,并在較長時間內保持被固定蛋白的生物活性。
在本發明的一些實施例中,所述蛋白點樣緩沖液中所述海藻糖的濃度為10-20g/l,所述甘氨酸的濃度為5-10g/l,所述異亮氨酸的濃度為5-10g/l,所述硫酸銨的濃度為0.2-1mol/l,所述檸檬酸鈉的濃度為0.05-0.2mol/l。由此,可以進一步提高蛋白在芯片上的固定能力、減少點樣后的孵育時間并在較長時間內保持被固定蛋白的生物活性。
在本發明的一些實施例中,所述蛋白點樣緩沖液中所述海藻糖的濃度為10g/l,所述甘氨酸的濃度為5g/l,所述異亮氨酸的濃度為5g/l,所述硫酸銨的濃度為0.2mol/l,所述檸檬酸鈉的濃度為0.05mol/l。由此,可以進一步提高蛋白在芯片上的固定能力、減少點樣后的孵育時間并在較長時間內保持被固定蛋白的生物活性。
在本發明的一些實施例中,所述蛋白點樣緩沖液的ph值為6.0-7.2。
在本發明的一些實施例中,所述蛋白點樣緩沖液的ph值為6.0。
在本發明的一些實施例中,所述蛋白點樣緩沖液的ph值是通過加入氫氧化鈉溶液和/或鹽酸溶液調節獲得的。由此,可以有效調節蛋白點樣緩沖液的ph。
在本發明的一些實施例中,所述等離子體金芯片由玻璃基底和形成在所述玻璃基底表面的納米金層組成。由此,可以通過點樣技術將特定的蛋白按預定的序列固定到等離子體金芯片上,方便實現生物標志物的檢測。
附圖說明
圖1是根據本發明一個實施例的點樣后cea抗體在37℃保存1天、3天、5天、7天后的熒光掃描對比圖。
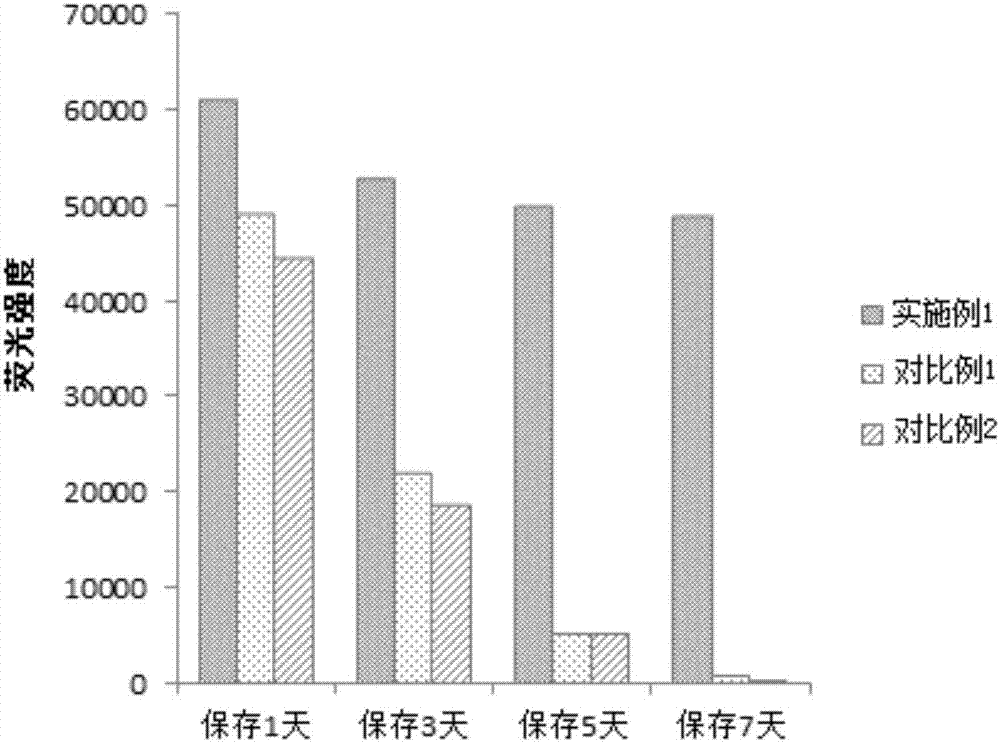
圖2是根據本發明一個實施例的點樣后cea抗體在37℃保存1天、3天、5天、7天后的熒光強度柱狀圖。
圖3是根據本發明一個實施例的點樣后cea抗體在30℃下孵育0.5h、6h和12h后的熒光掃描對比圖。
圖4是根據本發明一個實施例的點樣后cea抗體在30℃下孵育0.5h、6h和12h后的熒光強度柱狀圖。
具體實施方式
下面詳細描述本發明的實施例,所述實施例的示例在附圖中示出,其中自始至終相同或類似的標號表示相同或類似的元件或具有相同或類似功能的元件。下面通過參考附圖描述的實施例是示例性的,旨在用于解釋本發明,而不能理解為對本發明的限制。
根據本發明的一個方面,本發明提出了一種用于等離子體金芯片的蛋白點樣緩沖液,所述蛋白點樣緩沖液包含海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉。
本發明用于等離子體金芯片的蛋白點樣緩沖液包含海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉。該緩沖液與目前常用甘油或磷酸鹽緩沖液相比,可以使蛋白與芯片基底的結合更牢固,還能減少點樣后的孵育時間,并在較長時間內保持被固定蛋白的生物活性。
根據本發明的實施例,蛋白點樣緩沖液可以由含有海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉的水溶液組成。由此,本發明提出的僅由海藻糖、甘氨酸、異亮氨酸、硫酸銨和檸檬酸鈉幾種水溶液組成的用于等離子體金芯片的蛋白點樣緩沖液與目前常用甘油或磷酸鹽緩沖液相比,不僅可以對芯片上的蛋白質起保濕作用,防止因過度干燥而引起的蛋白質失活,還可以使蛋白與芯片基底的結合更牢固、減少點樣后的孵育時間,并在較長時間內保持被固定蛋白的生物活性。
根據本發明的具體實施例,所述蛋白點樣緩沖液中所述海藻糖的濃度可以為10-20g/l,所述甘氨酸的濃度可以為5-10g/l,所述異亮氨酸的濃度可以為5-10g/l,所述硫酸銨的濃度可以為0.2-1mol/l,所述檸檬酸鈉的濃度可以為0.05-0.2mol/l。由此,本發明中通過采用上述配比配置得到的蛋白點樣緩沖液,可以進一步提高蛋白在等離子體金芯片上的固定能力、縮短點樣后的孵育時間,并在較長時間內保持被固定蛋白的生物活性。
根據本發明的具體實施例,所述蛋白點樣緩沖液中所述海藻糖的濃度可以為10g/l,所述甘氨酸的濃度可以為5g/l,所述異亮氨酸的濃度可以為5g/l,所述硫酸銨的濃度可以為0.2mol/l,所述檸檬酸鈉的濃度可以為0.05mol/l。由此,本發明中通過采用上述配比配置得到的蛋白點樣緩沖液,可以進一步提高蛋白在等離子體金芯片上的固定能力、減少點樣后的孵育時間并在較長時間內保持被固定蛋白的生物活性。
根據本發明的具體實施例,所述蛋白點樣緩沖液的ph值為6.0-7.2。由此,本發明中通過采用上述ph值的蛋白點樣緩沖液,可以進一步在較長時間內保持被固定蛋白的生物活性。
根據本發明的具體實施例,所述蛋白點樣緩沖液的ph值可以為6.0。
根據本發明的具體實施例,所述蛋白點樣緩沖液的ph值可以通過加入氫氧化鈉溶液和/或鹽酸溶液調節獲得的。由此,本發明可以通過控制加入氫氧化鈉溶液和/或鹽酸溶液的濃度和加入量來有效調節蛋白點樣緩沖液的ph,使本發明用于等離子體金芯片的蛋白點樣緩沖液具有合適的ph值。
根據本發明的具體實施例,所述等離子體金芯片可以由玻璃基底和形成在所述玻璃基底表面的納米金層組成。由此,可以通過點樣技術將特定的蛋白按預定的序列固定到等離子體金芯片上,方便實現生物標志物的檢測。
根據本發明的具體實施例,通過采用本發明上述實施例的蛋白點樣緩沖液能夠有效增強特定蛋白在等離子體金芯片的固定能力,具體地,能夠將孵育時間縮短至0.5小時。同時,該蛋白點樣緩沖液還能有效保持芯片上特定蛋白的活性,具體地,在37℃下保存7天,其特定蛋白的活性依然保持在初始值的80%以上。
為使本發明的上述目的、特征和優點能夠更加明顯易懂,下面結合附圖和具體實施例對本發明的具體實施方式做詳細的說明。在下面的描述中闡述了很多具體細節以便于充分理解本發明。但是本發明能夠以很多不同于在此描述的其它方式來實施,本領域技術人員可以在不違背本發明內涵的情況下做類似改進,因此本發明不受下面公開的具體實施的限制。
實施例1
按照以下組分的終濃度配置蛋白點樣緩沖液:10g/l海藻糖、5g/l甘氨酸、5g/l異亮氨酸、0.2mol/l硫酸銨、0.05mol/l檸檬酸鈉。用1mol/l氫氧化鈉溶液或1mol/l鹽酸溶液調節ph值至6.0,2-8℃保存。
對比例1
按照以下組分的終濃度配置蛋白點樣緩沖液:5%(v/v)甘油、10mmpbs,用1mol/l氫氧化鈉溶液或1mol/l鹽酸溶液調節ph值至6.0,2-8℃保存。
對比例2
按照以下組分的終濃度配置蛋白點樣緩沖液:10mmpbs,用1mol/l氫氧化鈉溶液或1mol/l鹽酸溶液調節ph值至7.2,2-8℃保存。
(1)驗證實施例1、對比例1和對比例2的點樣緩沖液對芯片上cea抗體的活性保護效果:
1)點樣方法
將cea捕獲抗體分別用實施例1、對比例1和對比例2的點樣緩沖液稀釋到0.2mg/ml,并通過微量蛋白打印儀gesimnano-plottertm2.1分別將利用實施例1、對比例1和對比例2的點樣緩沖液稀釋的cea捕獲抗體打印到等離子體金芯片上每孔的第一排、第二排和第三排。捕獲抗體按照3nl每個點、每個點重復5次打印,最終獲得直徑約400微米的圓形斑點。
2)檢測方法
將點樣后的芯片在室溫下孵育0.5h,然后37℃真空保存,分別在保存1天、3天、5天、7天后各取一片進行檢測。
具體步驟如下:將點樣后的芯片在含1%bsa的pbs中搖動1小時封閉,以減少非特異性結合。用150μl/孔的pbst(0.05%吐溫20)清洗后,每孔加入100微升的cea抗原(10ng/ml),搖動2小時。芯片用pbst洗滌三次,隨后加入熒光染料irdye800標記的檢測抗體(4nmol/l)在黑暗中搖動染色半小時,后依次用pbst洗滌三次、純水清洗一次,離心機甩干。
熒光測量和分析
用midascan掃描儀掃描該芯片,選擇800納米通道、激光強度設置為7.0、分辨率設置為20微米。掃描后獲得16位灰度圖像。用midascansoftwarev1.0.0或更高版本軟件分析該圖像。選擇柵陣列分析模式測量每個點的強度,點陣的形貌由程序自動識別。每個點的強度通過所選區域總信號強度除以面積獲得。圖像上平行的5個點的平均熒光強度被定義為測試的強度。cea捕獲抗體活性與所獲圖像上的熒光強度之間存在正相關關系。
檢測結果如表1、圖1和圖2所示。其中,表1是不同點樣緩沖液打印的抗體在37℃保存1天、3天、5天、7天后測得的熒光強度表,圖1和圖2分別是在37℃下保存1天、3天、5天和7天的點樣后cea抗體的熒光掃描對比圖和熒光強度柱狀圖。
表1點樣緩沖液打印的抗體在37℃保存1天、3天、5天、7天后測得的熒光強度
(2)驗證實施例1、對比例1和對比例2的點樣緩沖液對芯片上cea抗體的固定能力:
1)點樣方法
將cea捕獲抗體分別用實施例1、對比例1和對比例2的點樣緩沖液稀釋到0.2mg/ml,并通過微量蛋白打印儀gesimnano-plottertm2.1分別將利用實施例1、對比例1和對比例2的點樣緩沖液稀釋的cea捕獲抗體打印到等離子體金芯片上每孔的第一排、第二排和第三排。捕獲抗體按照3nl每個點、每個點重復5次打印,最終獲得直徑約400微米的圓形斑點。
2)檢測方法
將點樣后的芯片在30℃下分別孵育0.5h、6h和12h,各取一片進行檢測。
具體步驟如下:將點樣后的芯片在30℃下分別孵育0.5h、4h或12h,然后立即在含1%bsa的pbs中搖動1小時封閉,以減少非特異性結合。用150μl/孔的pbst(0.05%吐溫20)清洗后,每孔加入100微升的cea抗原(10ng/ml),搖動2小時。芯片用pbst洗滌三次,隨后加入熒光染料irdye800標記的檢測抗體(4nmol/l)在黑暗中搖動染色半小時,后依次用pbst洗滌三次、純水清洗一次,離心機甩干。
熒光測量和分析
用midascan掃描儀掃描芯片,選擇800納米通道、激光強度設置為7.0、分辨率設置為20微米。掃描后獲得16位灰度圖像。用midascansoftwarev1.0.0或更高版本軟件分析該圖像。選擇柵陣列分析模式測量每個點的強度,點陣的形貌由程序自動識別。每個點的強度通過所選區域總信號強度除以面積獲得。圖像上平行的5個點的平均熒光強度被定義為測試的強度。cea捕獲抗體活性與所獲圖像上的熒光強度之間存在正相關關系。
檢測結果如表2、圖3和圖4所示。其中,表2是不同點樣緩沖液打印的抗體在30℃下孵育0.5h、6h和12h后測得的熒光強度表,圖3和圖4分別是點樣后的cea抗體在30℃下孵育0.5h、6h和12h后的熒光掃描對比圖和熒光強度柱狀圖。
表2不同點樣緩沖液打印的抗體在30℃下孵育0.5h、6h和12h后測得的熒光強度表
結論:(1)從表1、圖1和圖2中可以得出以下結論:實施例1的點樣緩沖液能有效保持芯片上抗體的活性,在37℃下保存7天,其活性依然能保持在初始值的80%以上,而此時對比例1和對比例2抗體幾乎完全失活。(2)從表2、圖3和圖4中可以得出以下結論:實施例1的點樣緩沖液能夠有效增強抗體在等離子體金芯片上的固定能力,縮短固定時間。
在本說明書的描述中,參考術語“一個實施例”、“一些實施例”、“示例”、“具體示例”、或“一些示例”等的描述意指結合該實施例或示例描述的具體特征、結構、材料或者特點包含于本發明的至少一個實施例或示例中。在本說明書中,對上述術語的示意性表述不必針對的是相同的實施例或示例。而且,描述的具體特征、結構、材料或者特點可以在任一個或多個實施例或示例中以合適的方式結合。此外,在不相互矛盾的情況下,本領域的技術人員可以將本說明書中描述的不同實施例或示例以及不同實施例或示例的特征進行結合和組合。
盡管上面已經示出和描述了本發明的實施例,可以理解的是,上述實施例是示例性的,不能理解為對本發明的限制,本領域的普通技術人員在本發明的范圍內可以對上述實施例進行變化、修改、替換和變型。
- 還沒有人留言評論。精彩留言會獲得點贊!