多種人獸共患病病原菌的同步快速檢測試劑盒的制作方法
本發明涉及快速檢測領域,具體是多種人獸共患病病原菌的同步快速檢測試劑盒。
背景技術:
近年來,隨著畜牧業和旅游業的飛速發展,許多人獸共患傳染病的流行病學特征發生了改變,傳播速度更快、傳播范圍更廣。人獸共患傳染病不僅嚴重威脅人類和動物的健康,還給農牧業帶來巨大經濟損失。布魯氏菌、大腸桿菌o157:h7和單增李斯特菌是諸多人獸共患病病原菌中發病率較高、對人獸危害較嚴重的三種病原菌。人類或動物往往通過攝入被這些細菌污染的食物而發病,建立對這些病原菌的同步快速準確檢測方法已經成為了公共衛生檢測領域的研究熱點之一。
大腸桿菌o157:h7為腸桿菌科、埃希氏菌屬,革蘭氏陰性菌,是腸出血性大腸桿菌中最重要的一個血清型。大腸桿菌o157:h7的生化特性與普通大腸桿菌相似,最適生長溫度為37℃,不耐高溫,在75℃水中1min就可被殺死,但是在低溫環境中可以長時間存活。耐酸,對氯極其敏感,1ppm就可致其死亡。大腸桿菌o157:h7是一種重要的人獸共患病病原菌,感染劑量非常低,10個活菌就可能致病。人誤食被該菌污染的牛肉、豬肉、牛奶、蔬菜、水等均可能患病。
單核細胞增生李斯特菌,簡稱單增李斯特菌,是一種革蘭氏陽性菌,在營養豐富的環境中可形成莢膜。單增李斯特菌的生長溫度范圍較廣,為-1.5~50℃,最適生長環境為30℃、ph4.5~7.0,熱抵抗力較弱,60℃30min可被滅活,對酒精等化學消毒劑及紫外線照射敏感。單增李斯特菌在自然環境中存在廣泛,在植物、土壤、飼料、廢棄物以及人或動物的糞便中都有可能存在,動物感染該菌的可能性較大。由于其能夠在相對極端的環境如低溫、高鹽等環境中生長,可通過多種途徑引起傳播,除了污染食品原料,單增李斯特菌還有可能在食品加工、運輸或冷凍保存過程中傳播,導致人或動物患病。單增李斯特菌作為李斯特氏菌屬中對人畜危害最大的一種病原菌,也是食品衛生中一種重要的食源性病原菌,人類可通過食入被單增李斯特菌污染的食物,如奶及奶制品、豬肉、牛肉、羊肉、海產品、蔬菜、腌制食品等感染該菌。單增李斯特菌的發病率相對其他人獸共患病病原菌而言,并不是很高,但是其病死率可高達30%~40%,超過了沙門氏菌和肉毒桿菌。
布魯氏菌是一種細胞內寄生的革蘭氏陰性短桿菌,主要感染羊、牛、豬等多種家畜、野生動物以及人類,威脅畜牧業的發展和人體的健康,造成巨大的經濟損失,也帶來嚴重的公共衛生問題。不同種類的布魯氏菌大多還具有交叉感染的能力。布魯氏菌可通過呼吸道、消化系統、皮膚粘膜等多種途徑侵入人體,家畜作為人類感染布魯氏菌最主要的感染源,人類通過接觸帶菌的羊、牛、豬等牲畜,進食布魯氏菌污染的奶及奶制品、肉及肉制品等,均可引起發病。
現有的針對人獸共患病病原菌的檢測方法主要包括分離培養鑒定法、免疫學方法和分子生物學方法。由于待測樣品基質復雜,往往是多種病原菌共同存在,且含量相對較低,在進行常規檢測之前往往需要通過前增菌培養,不僅對操作人員帶來潛在感染的威脅,同時檢測時間較長,會延誤疫情的控制。免疫磁分離技術是利用磁性微球與特異性生物大分子結合形成的免疫磁珠,其可以從待測樣品中快速捕獲目標病原菌,并借助外加磁場將其分離出來,一定程度上可以縮短前增菌培養時間,甚至取代前增菌培養,縮短樣品的檢測時間,提高檢測效率。量子點熒光探針標記技術是將量子點通過共價結合或者物理吸附的方式與蛋白質多肽、核酸等生物大分子結合,利用量子點獨特的光學性能對研究對象進行定性或者定量分析的技術。與傳統的熒光染料相比,量子點具有激發光譜寬、發射光譜窄、量子產率高、熒光穩定性好的優點,還可實現一元激發多元發射的同時標記,在基礎生物學研究、醫學診斷和衛生檢測研究領域具有廣闊的應用前景。
技術實現要素:
本發明的目的為解決針對現有人獸共患病病原菌檢測方法存在的問題,而提供了多種人獸共患病病原菌的同步快速檢測試劑盒。
多種人獸共患病病原菌的同步快速檢測試劑盒,它包括:免疫磁珠、量子點熒光生物探針;所述的免疫磁珠是羧基化磁珠用edc和nhs活化后,與三價卵黃抗體igy偶聯;所述的量子點熒光生物探針是不同顏色的熒光量子點,分別與不同的兔多克隆抗體偶聯;
所述的兔多克隆抗體為抗大腸桿菌o157:h7兔多克隆抗體、抗單增李斯特菌兔多克隆抗體和\或抗布魯氏菌兔多克隆抗體;
所述的三價卵黃抗體igy是將大腸桿菌o157:h7、單增李斯特菌和布魯氏菌滅活后,免疫spf雞獲得的;
所述的熒光量子點的熒光發射波長分別為539nm、583nm和634nm;
所述的多種人獸共患病病原菌的同步快速檢測試劑盒,還包括抗副溶血弧菌兔多克隆抗體;
所述的熒光量子點為綠色、黃色、紅色或藍色熒光量子點;
所述的兔多克隆抗體igg蛋白濃度為0.5mg/ml;
所述的雞卵黃抗體igy是采用peg6000法進行純化的;
所述的熒光量子點為cdse/zns量子點。
本發明提供了多種人獸共患病病原菌的同步快速檢測試劑盒,它包括:免疫磁珠、量子點熒光生物探針;所述的免疫磁珠是羧基化磁珠用edc和nhs活化后,與三價卵黃抗體igy偶聯;所述的量子點熒光生物探針是不同顏色的熒光量子點,分別與抗大腸桿菌o157:h7、抗單增李斯特菌、抗布魯氏菌、抗副溶血弧菌兔多克隆抗體偶聯;所述的三價卵黃抗體igy是將大腸桿菌o157:h7、單增李斯特菌和布魯氏菌滅活后,免疫spf雞獲得的;利用本發明制備的試劑盒進行四種病原菌的同步快速檢測,具有特異性好、靈敏度高、重復性和穩定性好、檢測時間短的優點,能夠用于四種病原菌的同步快速定量檢測。
附圖說明
圖1三種病原菌同步檢測流程圖;
圖2免疫磁珠在不同添加量下檢測病原菌的熒光圖譜;
圖3免疫磁珠在不同反應時間下檢測病原菌的熒光圖譜;
圖4量子點熒光生物探針在不同反應用量下檢測病原菌的熒光圖譜;
圖5量子點熒光生物探針在不同反應時間下檢測病原菌的熒光圖譜;
圖6三種病原菌同步檢測的標準曲線;
圖7牛奶樣品中三種病原菌在不同濃度下的熒光圖譜;
圖8牛奶樣品中三種病原菌同步檢測的標準曲線;
圖9羊肉樣品中三種病原菌在不同濃度下的熒光圖譜;
圖10羊肉樣品中三種病原菌同步檢測的標準曲線;
圖11白菜樣品中三種病原菌在不同濃度下的熒光圖譜;
圖12白菜樣品中三種病原菌同步檢測的標準曲線。
具體實施方式
實施例1三價卵黃抗體(igy)的制備
取-80℃保存的大腸桿菌o157:h7、單增李斯特菌和布魯氏菌菌株,活化后分別在la平板上劃線,分離單個菌落,37℃培養18~24h后,挑取單個菌落,接種于lb液體培養基中,37℃振蕩培養至對數中期。取1ml菌液采用平板傾注法進行活菌計數,加入終濃度為1%的甲醛溶液室溫滅活30min,4℃過夜。次日將滅活的菌液3000rpm離心10min,棄上清,收集菌體,用生理鹽水重懸菌體,制成菌懸液,并將三種菌的終濃度均調整為2×1010cfu·ml-1,置于4℃冰箱中保存備用。同時采用平板傾注法檢驗細菌是否完全滅活。取上述制備的三種菌懸液,根據細菌計數結果按照1:1:1比例混合,并調整菌液終濃度為2×109cfu·ml-1。按照體積加入等量的弗氏完全佐劑/弗氏不完全佐劑,置于磁力攪拌器上攪拌至完全乳化,即油包水狀態,4℃放置一周后乳劑不分層,方可作為疫苗免疫實驗動物。
spf級健康高產蛋雞2只,置于負壓雙層不銹鋼隔離飼養箱中飼養一周,記錄產蛋情況,無異常后,采用肌肉多點注射的方式將上述三價疫苗接種于雞胸,每只雞每次接種疫苗體積為1ml。首次免疫采用弗氏完全佐劑疫苗,之后每隔兩周采用弗氏不完全佐劑疫苗進行加強免疫。每次免疫前均于雞翅靜脈采血,離心分離血清,用于血清抗體效價水平的監測。收集雞蛋,按照日期編號,置于4℃冰箱保存。采用peg6000沉淀法提取所收集雞蛋的igy,具體分離提取步驟如下:用自來水洗凈雞蛋表面的污漬,75%酒精擦拭消毒兩次,輕輕打破蛋殼,使用蛋黃分離器對卵黃和卵白進行初步分離;將卵黃置于濾紙上,輕輕翻滾,除去殘留于卵黃膜表面的卵白,刺破卵黃膜,收集卵黃液,記錄卵黃液的體積;加入二倍卵黃體積的pbs緩沖液和3.5%peg-6000(w/v),震蕩混勻10min后4℃10000rpm離心20min,去除卵黃中的卵黃顆粒;過濾上清,將濾液轉移至新的離心管中,記錄上清液體積,加入8.5%peg-6000(w/v),震蕩混勻10min后,4℃10000rpm離心20min,棄上清;用10mlpbs緩沖液重懸沉淀,加入12%peg-6000(w/v),震蕩混勻10min,4℃10000rpm離心20min,棄上清,沉淀即為igy;用1.0mlpbs緩沖液重懸沉淀,將igy溶液轉移至透析袋中,置于0.1%生理鹽水攪拌透析過夜后,置于pbs緩沖液繼續透析4小時,采用超濾離心管將得到的igy溶液濃縮至1.5ml。
采用上述優化好的間接elisa方法分別測定三價血清大腸桿菌o157:h7、單增李斯特菌和布魯氏菌的抗體效價(見表1),結果表明,隨著免疫時間的延長,免疫后蛋雞的血清中逐漸出現抗三種病原菌的抗體,抗體效價呈不斷升高的趨勢,在免疫后第8周,抗體效價達到最高,并趨于穩定;采用peg6000沉淀法提取卵黃中的三價igy,采用上述優化好的間接elisa方法測定igy對三種病原菌的抗體效價(見表2),結果表明,隨著免疫時間的延長,三價igy逐漸出現,且對三種病原菌的效價也逐漸升高,在免疫后第10周,三價igy對三種病原菌的抗體均基本達到最高,且不再降低;采用bca蛋白定量試劑盒測定所有提取的三價igy的蛋白含量,從卵黃中提取的三價igy的蛋白含量約為5.73~21.03mg·ml-1,其中第10周所提取的三價igy的蛋白含量最高,為21.03mg·ml-1,并用pbs緩沖液將其蛋白濃度調整為0.5mg/ml,-20℃保存備用;以第10周所提取的三價igy作為待測樣品,采用間接elisa方法鑒定其特異性,如表3所示,結果表明所制備的三價igy僅與副溶血弧菌(atcc17802)出現了交叉反應,與金黃色葡萄球菌(atcc25923)、鼠傷寒沙門氏菌(atcc13311)、糞鏈球菌(atcc14506)、肺炎克雷伯菌(亞種)(atcc35657)、布氏檸檬酸桿菌(atcc43162)、鮑氏志賀氏菌(atcc9207)、粘質沙雷氏菌(atcc13880)、陰溝腸桿菌(jl08011)和奇異變形桿菌(jl08017)等菌株均沒有交叉反應,特異性良好;本實驗采用sds-page法對第10周所提取的三價igy的純度進行鑒定,結果表明所提取的igy的純度較高。
實施例2兔多克隆抗體的制備
三種人獸共患病病原菌兔多克隆抗體的制備:分別取實施例1中制備的大腸桿菌o157:h7、單增李斯特菌和布魯氏菌菌懸液,加入等體積的弗氏完全佐劑/弗氏不完全佐劑,置于磁力攪拌器上攪拌至完全乳化,即油包水狀態,待4℃放置一周后乳劑不分層,即可作為疫苗,用來免疫健康雌性新西蘭大白兔,適應性飼養一周后,無異常,采用背部皮下多點注射法進行免疫。初次免疫采用弗氏完全佐劑疫苗,之后采用同等劑量的弗氏不完全佐劑疫苗每隔1周進行加強免疫1次,共加強免疫4次,每只兔每次免疫接種1ml疫苗。每次免疫前均于兔耳緣靜脈采血,分離血清,用于監測血清抗體水平的變化。最后一次免疫結束后10天,行頸動脈插管,收集血液,3500rpm離心10min,收集血清,保存于-20℃備用。采用飽和酸銨鹽析沉淀法從兔血清中提取兔多克隆抗體;采用間接elisa方法分別測定免疫大腸桿菌o157:h7疫苗、單增李斯特菌疫苗和布魯氏菌疫苗后的兔血清及多克隆抗體效價,表4為免疫后兔血清及抗體效價結果,結果顯示隨著免疫次數的增加,血清抗體效價逐漸升高,在最后一次免疫結束后10天,血清中抗體效價均達到1:256000,大腸桿菌o157:h7兔多克隆抗體的效價為1:128000,單增李斯特菌兔多克隆抗體的效價為1:512000,布魯氏菌菌兔多克隆抗體的效價為1:2048000;表5、6分別為大腸桿菌o157:h7和單增李斯特菌兔多克隆抗體特異性結果,結果表明,所制備的大腸桿菌o157:h7多克隆抗體與金黃色葡萄球菌(atcc25923)、鮑氏志賀氏菌(atcc9207)和粘質沙雷氏菌(atcc13880)出現了交叉反應,與其他菌沒有出現交叉反應,特異性良好,所制備的單增李斯特菌多克隆抗體與金黃色葡萄球菌(atcc25923)出現了較強的交叉反應,與糞鏈球菌(atcc14506)和粘質沙雷氏菌(atcc13880)出現了交叉反應,與其他菌沒有交叉反應,特異性良好;采用bca蛋白定量試劑盒測定所提取的兩種兔多克隆抗體的蛋白含量,所提取的大腸桿菌o157:h7多克隆抗體的蛋白含量為29.06mg·ml-1,所提取的單增李斯特菌多克隆抗體的蛋白含量為38.27mg·ml-1,所提取的布魯氏菌多克隆抗體的蛋白含量為39.08mg·ml-1,并用pbs緩沖液將其蛋白濃度調整為0.5mg/ml,-20℃保存備用;采用sds-page電泳檢測兩種多克隆抗體的純度,可以觀察到明顯的重鏈條帶和輕鏈條帶,純度較高。
副溶血性弧菌兔克隆抗體igg的制備:取濃度為1×109cfu·ml-1滅活菌液與等量的弗氏完全佐劑/弗氏不完全佐劑乳化完全,制備滅活疫苗。首次免疫取濃度為1×109cfu·ml-1弗氏完全佐劑疫苗免疫健康新西蘭大白兔(由吉林大學基礎醫學院實驗動物中心提供),采用背部皮下多點注射法,每只免疫2ml,在第二周、第三周采用同等劑量的弗氏不完全佐劑疫苗對兔進行第二次免疫、第三次免疫。10天后,用滅活菌液加強免疫兩次。每次免疫前兔耳緣靜脈取血,測定血清效價。達到分離標準,兔心臟采血,分離血清,得到抗副溶血性弧菌的抗血清。采用飽和硫酸銨鹽析沉淀法對所述的抗血清中的多克隆抗體igg進行純化;采用間接elisa法對純化后抗體的效價和特異性進行測定,表7為免疫前后兔血清及抗體效價測定結果,結果顯示,隨著免疫次數的增加,血清抗體效價逐漸升高,最終獲得的副溶血性弧菌兔多克隆抗體效價可以達到1:1024000;表8為兔多克隆抗體igg特異性結果,結果顯示,制備的抗體特異性較好;采用bca蛋白定量試劑盒對純化后的igg抗體的濃度進行測定,并用pbs緩沖液將其蛋白濃度調整為1mg/ml,-20℃保存備用。
實施例3三價卵黃抗體(igy)間接elisa方法
為了更加準確的測定收集的igy的效價,建立了檢測三價血清和卵黃抗體抗三種不同病原菌的間接elisa反應方法,具體步驟為:
以大腸桿菌o157:h7作為包被抗原時,將大腸桿菌o157:h7菌懸液用抗原包被液進行1:800稀釋,按每孔100μl包被于96孔酶標反應板中,37℃孵育1h,棄去板中液體,加入pbst緩沖液,300μl/孔進行洗滌,每次3min,洗滌3次;每孔加入300μl5%脫脂奶粉,37℃孵育2h,重復上述洗滌步驟;加入待測三價血清或者抗體,100μl/孔,37℃孵育0.5h,重復上述洗滌步驟;將hrp標記的山羊抗雞二抗進行1:5000稀釋,按100μl/孔加入到96孔酶標反應板中,37℃孵育0.5h,重復上述洗滌步驟;按100μl/孔加入底物顯色液,室溫避光顯色5min;每孔加入50μl終止液終止顯色反應;采用全波段酶標儀讀取od450值,并進行結果分析。
以單增李斯特菌作為包被抗原時,將單增李斯特菌菌懸液用抗原包被液進行1:50稀釋,按每孔100μl包被于96孔酶標反應板中,37℃孵育1h,棄去板中液體,加入pbst緩沖液,300μl/孔,拍洗三次;每孔加入300μl1%bsa,37℃孵育1h,重復上述洗滌步驟;加入待測三價血清或者抗體,100μl/孔,37℃孵育0.5h,重復上述洗滌步驟;將hrp標記的山羊抗雞二抗進行1:15000稀釋,按100μl/孔加入到96孔酶標反應板中,37℃孵育0.5h,重復上述洗滌步驟;按100μl/孔加入底物顯色液,室溫避光顯色25min;每孔加入50μl終止液終止顯色反應;采用全波段酶標儀讀取od450值,并進行結果分析。
以布魯氏菌作為包被抗原,將布魯氏菌菌懸液用抗原包被液進行1:50稀釋,按每孔100μl包被于96孔酶標反應板中,37℃孵育1h,棄去板中液體,加入pbst緩沖液,300μl/孔,拍洗三次;每孔加入300μl0.1%bsa,37℃孵育2h,重復上述洗滌步驟;加入待測三價血清或者抗體,100μl/孔,37℃孵育0.5h,重復上述洗滌步驟;將hrp標記的山羊抗雞二抗進行1:20000稀釋,按100μl/孔加入到96孔酶標反應板中,37℃孵育0.5h,重復上述洗滌步驟;按100μl/孔加入底物顯色液,室溫避光顯色5min;每孔加入50μl終止液終止顯色反應;采用全波段酶標儀讀取od450值,并進行結果分析。
實施例4兔多克隆抗體間接elisa方法
建立了檢測大腸桿菌o157:h7、單增李斯特菌和布魯氏菌的兔多克隆抗體血清抗體效價的間接elisa反應條件,具體步驟為:
將大腸桿菌o157:h7以1:400用包被液稀釋,按每孔100μl包被于酶標反應板中,4℃過夜,pbst洗板3次;加入5%脫脂奶粉進行封閉,300μl/孔37℃孵育60min,pbst洗板3次;將待測血清或抗體加入到酶標反應板,100μl/孔,37℃孵育30min,pbst洗板3次;hrp標記的山羊抗兔二抗以1:15000稀釋后,按100μl/孔加入酶標反應板,37℃孵育30min,pbst洗板3次;加入顯色液,100μl/孔室溫避光顯色5min;加入終止液,50μl/孔;利用全波段酶標儀讀取od450值,并進行結果分析。
將單增李斯特菌以1:400用包被液稀釋,按每孔100μl包被于酶標反應板中,4℃過夜,pbst洗板3次;加入5%脫脂奶粉進行封閉,300μl/孔37℃孵育60min,pbst洗板3次;將待測血清或抗體加入到酶標反應板,100μl/孔,37℃孵育30min,pbst洗板3次;hrp標記的山羊抗兔二抗以1:10000稀釋后按100μl/孔加入酶標反應板,37℃孵育30min,pbst洗板3次;加入顯色液,100μl/孔室溫避光顯色25min;加入終止液,50μl/孔;利用全波段酶標儀讀取od450值,并進行結果分析。
將布魯氏菌以1:400用包被液稀釋,按每孔100μl包被于酶標反應板中,4℃過夜,pbst洗板3次;加入5%脫脂奶粉進行封閉,300μl/孔37℃孵育60min,pbst洗板3次;將待測血清或抗體加入到酶標反應板,100μl/孔,37℃孵育30min,pbst洗板3次;hrp標記的山羊抗兔二抗以1:10000稀釋后按100μl/孔加入酶標反應板,37℃孵育30min,pbst洗板3次;加入顯色液,100μl/孔室溫避光顯色25min;加入終止液,50μl/孔;利用全波段酶標儀讀取od450值,并進行結果分析。
實施例5免疫磁珠的制備
采用edc和nhs作為催化劑,將羧基磁珠與三價igy偶聯,制備能夠同時捕獲大腸桿菌o157:h7、單增李斯特菌、布魯氏菌和副溶血性弧菌的免疫磁珠,具體制備方法為:取100μl羧基磁珠,用200μlmest緩沖液磁分離洗滌磁珠2次,去除上清液,分別加入200μledc溶液(10mg·ml-1,mest緩沖液配制)和200μlnhs溶液(10mg·ml-1,pbsmest配制),室溫旋轉混合30min,磁分離去除上清,收集已活化磁珠,用pbs緩沖液磁分離洗滌2次,加入200μlpbs緩沖液重懸磁珠。取上述已經活化后的磁珠若干份,磁分離去除pbs緩沖液,分別加入不同蛋白量的三價igy,并定容至200μl,室溫置于旋轉混合儀上反應120min,磁分離,收集上清,采用紫外可見光分光光度計測定上清液的a280,同時測定反應前不同濃度抗體溶液的a280,采用公式1計算抗體偶聯率。用pbs緩沖液洗滌磁珠2次,加入200μl0.1%bsa溶液(w/v,pbs緩沖液配制)封閉磁珠上未與抗體偶聯的位點,室溫旋轉混合60min,pbs緩沖液磁分離洗滌2次,加入200μlpbs緩沖液重懸磁珠,即得到免疫磁珠,4℃保存備用。
實施例6四種量子點熒光生物探針的制備
采用edc和nhs作為催化劑,將四種不同發射波長的熒光量子點分別與大腸桿菌o157:h7兔多克隆抗體、單增李斯特菌兔多克隆抗體、布魯氏菌和副溶血性弧菌兔多克隆抗體偶聯,制備四種具有不同發射波長的量子點熒光生物探針。
1、綠色量子點熒光生物探針的制備
取30μl綠色熒光量子點,加入200μledc溶液(10mg·ml-1,pbs緩沖液配制)和200μlnhs溶液(10mg·ml-1,pbs緩沖液配制),室溫旋轉混合30min活化量子點,12000rpm離心10min,棄上清,收集沉淀,用pbs緩沖液離心洗滌2次。分別加入不同蛋白質量的大腸桿菌o157:h7兔多克隆抗體,用pbs緩沖液定容至200μl,置于旋轉混合儀上反應120min,12000rpm離心10min,收集上清,采用紫外-可見光分光光度計測定波長為280nm處的吸光度值(a280),同時測定反應前不同濃度抗體溶液的a280,采用公式1計算抗體偶聯率。用pbs離心洗滌沉淀2次,加入200μl0.1%bsa溶液(w/v,pbs緩沖液配制)封閉量子點表面未與抗體偶聯的位點,室溫旋轉混合60min,12000rpm離心10min,棄上清,收集沉淀,用pbs緩沖液離心洗滌2次,用200μlpbs緩沖液重懸沉淀,4℃保存備用。
2、黃色量子點熒光生物探針的制備
取45μl黃色熒光量子點,加入200μledc溶液(10mg·ml-1,pbs緩沖液配制)和200μlnhs溶液(10mg·ml-1,pbs緩沖液配制),室溫旋轉混合30min活化量子點,12000rpm離心10min,棄上清,收集沉淀,用pbs緩沖液離心洗滌2次。分別加入不同蛋白質量的單增李斯特菌兔多克隆抗體,用pbs緩沖液定容至200μl,置于旋轉混合儀上反應120min,12000rpm離心10min,收集上清,采用紫外可見光分光光度計測定a280,同時測定反應前不同濃度抗體溶液的a280,采用公式1計算抗體偶聯率。用pbs緩沖液離心洗滌沉淀2次,加入200μl0.1%bsa溶液(w/v,pbs緩沖液配制)封閉量子點表面未與抗體偶聯的位點,室溫旋轉混合60min,12000rpm離心10min,棄上清,收集沉淀,用pbs緩沖液離心洗滌2次,用200μlpbs緩沖液重懸沉淀,4℃保存備用。
3、紅色量子點熒光生物探針的制備
取7μl紅色熒光量子點,加入200μledc溶液(10mg·ml-1,pbs緩沖液配制)和200μlnhs溶液(10mg·ml-1,pbs緩沖液配制),室溫旋轉混合30min活化量子點,12000rpm離心10min,棄上清,收集沉淀,用pbs緩沖液離心洗滌2次。分別加入不同蛋白量的布魯氏菌兔多克隆抗體,用pbs緩沖液定容至200μl,置于旋轉混合儀上反應120min,12000rpm離心10min,收集上清,采用紫外可見光分光光度計測定a280,同時測定反應前不同濃度抗體溶液的a280,采用公式1計算抗體偶聯率。用pbs緩沖液離心洗滌沉淀2次,加入200μl0.1%bsa溶液(w/v,pbs緩沖液配制)封閉量子點表面未與抗體偶聯的位點,室溫旋轉混合60min,12000rpm離心10min,棄上清,收集沉淀,用pbs緩沖液離心洗滌2次,用200μlpbs緩沖液重懸沉淀,4℃保存備用。
4、藍色量子點熒光生物探針的制備
取10ul藍色熒光量子點于1.5ml棕色進樣瓶中,加入用mest緩沖液配制的5mg/mledc和nhs各200μl,漩渦混勻后,利用垂直混合儀在25℃下活化30min。活化結束后將溶液轉移至微量離心管中,12000rpm離心5min。棄去上清并用pbst清洗1遍,活化后的量子點重懸于400μl的pbst中。加入所制備的副溶血性弧菌雞卵黃抗體igy120μg,漩渦混勻后利用垂直混合儀在25℃下避光反應2h。偶聯反應結束后,將量子點溶液移至微量離心管中,12000rpm離心5min,棄去上清并用pbst清洗1遍。加入1ml1%的bsa,渦旋混勻后利用垂直混合儀在25℃下繼續避光孵育1h進行封閉。封閉結束后,將量子點溶液轉移至1.5ml的ep管中,12000rpm離心5min,棄去上清并用pbst清洗1遍。最后重懸于400μl的pbs溶液中,4℃保存備用。
實施例7pbs緩沖液的制備
pbs緩沖液(0.01mol·l-1ph7.4):分別稱取na2hpo4·12h2o3.63g、kh2po40.20g、nacl8.0g、kcl0.20g,加蒸餾水定容至1000ml,調ph為7.4后,121℃高壓滅菌20min,4℃保存備用。
實施例8三種病原菌混懸液的制備
將大腸桿菌o157:h7、單增李斯特菌和布魯氏菌菌懸液用pbs緩沖液稀釋至1×108cfu·ml-1,各取1.0ml,加入到7.0mlpbs緩沖液中混勻,最終三種病原菌混懸液中每種菌的濃度均為1×107cfu·ml-1。以此菌懸液作為儲備液,利用pbs緩沖液進行10倍倍比稀釋,則可以得到三種菌濃度分別為1×106cfu·ml-1、1×105cfu·ml-1、1×104cfu·ml-1、1×103cfu·ml-1、1×102cfu·ml-1和1×101cfu·ml-1的三種病原菌混懸液。
實施例9三種病原菌同步檢測方法的建立
采用免疫磁珠和量子點熒光生物探針對待測樣品中的大腸桿菌o157:h7、單增李斯特菌和布魯氏菌進行同步檢測,檢測流程圖如圖1所示。當待測樣品中含有這三種病原菌時,會與免疫磁珠發生抗原-抗體反應,形成免疫磁珠-病原菌復合物,在外加磁場的作用下可將免疫磁珠-病原菌復合物從待測樣品基質中分離出來。之后同時加入三種不同熒光發射波長的量子點熒光生物探針,量子點熒光生物探針表面的兔多克隆抗體會與相應的病原菌發生特異性結合,形成免疫磁珠-病原菌-量子點熒光生物探針復合物,采用熒光分光光度計測定對應熒光發射峰的熒光信號,進而實現對三種病原菌的定量檢測。當待測樣品中僅含有其中一種病原菌或任意組合的兩種病原菌時,則能夠在相應熒光發射峰的位置檢測到熒光強度,進而實現單一病原菌或任意兩種病原菌的定量檢測。當待測樣品中不含有這三種病原菌時,則不會形成免疫磁珠-病原菌復合物和免疫磁珠-病原菌-量子點熒光生物探針復合物,通過磁分離洗滌除去未能參加反應的量子點熒光生物探針后,最終無法檢測到熒光信號或者熒光信號強度相對較低。為了獲得最佳檢測效果,對免疫磁珠用量、免疫磁珠富集時間、量子點熒光生物探針用量和反應時間進行優化。
1.免疫磁珠反應用量的優化
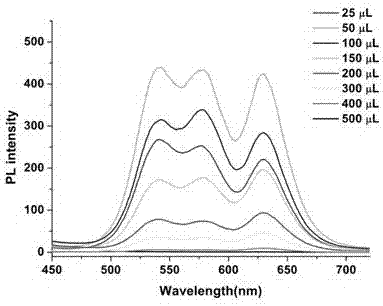
分別取25μl、50μl、100μl、150μl、200μl、300μl、400μl和500μl的免疫磁珠,加入100μl三種菌液濃度均為1×105cfu·ml-1的混懸液,置于旋轉混合儀上室溫反應60min,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌復合物兩次后,同時加入三種量子點熒光生物探針各200μl,繼續反應60min,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌-量子點熒光生物探針復合物兩次后,加入200μlpbs緩沖液重懸磁珠-病原菌-量子點熒光生物探針復合物,采用熒光分光光度計測定激發波長為380nm時的發射圖譜,并記錄三個不同熒光發射峰的熒光強度。熒光圖譜如圖2所示,隨著加入的免疫磁珠用量增加,熒光強度均出現了先升高后降低的趨勢,當加入的免疫磁珠為50μl時,三個熒光發射峰的熒光強度均最高,且三個峰的峰位置相互分離。因此,選擇50μl作為免疫磁珠的最佳用量。
2.免疫磁珠反應時間的優化
取最佳用量的的免疫磁珠8份,加入100μl三種菌液濃度均為1×105cfu·ml-1的混懸液,分別置于旋轉混合儀上反應15min、30min、45min、60min、75min、90min、105min和120min,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌復合物兩次后,同時加入三種量子點熒光生物探針各200μl,繼續反應60min,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌-量子點熒光生物探針復合物兩次后,加入200μlpbs緩沖液重懸磁珠-病原菌-量子點熒光生物探針復合物,采用熒光分光光度計測定激發波長為380nm時的發射圖譜,并記錄三個不同熒光發射峰的熒光強度。熒光圖譜如圖3所示,隨著免疫磁珠反應時間的延長,熒光強度先升高后降低,當反應時間為60min時,熒光強度最強,且三個峰的峰位置相互分離。因此,選擇60min作為免疫磁珠的最佳富集時間。
3.量子點熒光生物探針反應用量的優化
取最佳用量的的免疫磁珠8份,加入100μl上述三種病原菌的混懸液,置于旋轉混合儀上反應最佳時間,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌復合物兩次后,同時加入等體積的三種量子點熒光生物探針,每種量子點熒光生物探針的體積分別為25μl、50μl、100μl、150μl、200μl、300μl、400μl和500μl,繼續反應60min,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌-量子點熒光生物探針復合物兩次后,加入200μlpbs緩沖液重懸磁珠-病原菌-量子點熒光生物探針復合物,采用熒光分光光度計測定激發波長為380nm時的發射圖譜,并記錄三個不同熒光發射峰的熒光強度。熒光圖譜如圖4所示,隨著量子點熒光生物探針用量增加,熒光強度出現了先急劇升高后平緩的趨勢,當加入的三種量子點熒光生物探針的體積均為200μl時,三個熒光發射峰的熒光強度均較高且相差最小,三個熒光發射峰的峰位置相互分離。因此,選擇200μl作為量子點熒光生物探針的最佳用量。
4.量子點熒光生物探針反應時間的優化
取最佳用量的免疫磁珠8份,加入100μl上述三種病原菌的混懸液,置于旋轉混合儀上反應最佳時間,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌復合物兩次后,同時加入等體積的三種量子點熒光生物探針,繼續反應不同時間,分別設置反應時間為15min、30min、45min、60min、75min、90min、105min和120min,磁分離去除上清,pbs緩沖液洗滌磁珠-病原菌-量子點熒光生物探針復合物兩次后,加入200μlpbs緩沖液重懸磁珠-病原菌-量子點熒光生物探針復合物,采用熒光分光光度計測定激發波長為380nm時的發射圖譜,并記錄三個不同熒光發射峰的熒光強度。熒光圖譜如圖5所示,隨著量子點熒光生物探針標記時間的延長,熒光強度先急劇升高后變得平緩,當反應時間為60min時,三個熒光發射峰的熒光強度均較高且相差最小,三個發射峰的峰位置相互分離。因此,選擇60min作為量子點熒光生物探針的最佳標記時間。
5.三種病原菌同步檢測方法的效果評價
(1)檢測限的測定
取若干份50μl的免疫磁珠,加入150μlpbs緩沖液將體積補充至200μl后,加入100μl從107cfu·ml-1到101cfu·ml-1十倍比稀釋的四種病原菌菌懸液,同時設不加病原菌的空白對照,置于旋轉混合儀上室溫反應60min,用pbs緩沖液磁分離洗滌三次,去上清,加入四種量子點熒光生物探針各200μl,室溫旋轉混合反應60min,用pbs緩沖液磁分離洗滌三次,去上清,最終用200μlpbs緩沖液重懸反應產物,采用熒光分光光度計測定熒光強度,記錄熒光值,并進行結果分析。檢測限的判定標準:以空白樣品熒光強度的2.1倍作為陽性檢測結果的判定標準,大于空白樣品熒光強度的2.1倍所對應的最低病原菌稀釋濃度為本方法的檢測限。結果如圖6和表9所示,所建立的檢測方法線性良好,對大腸桿菌o157:h7、單增李斯特菌、布魯氏菌和副溶血性弧菌的最低檢測限(limitsofdetection,lods)依次為103cfu·ml-1、103cfu·ml-1、104cfu·ml-1、104cfu·ml-1。
(2)準確度實驗
采用加標回收實驗評價所建立的檢測方法分別對大腸桿菌o157:h7、單增李斯特菌和布魯氏菌檢測的準確度,具體操作如下:取若干份免疫磁珠,分別加入濃度為105cfu·ml-1的三種病原菌的菌懸液,按照建立好的檢測程序進行檢測,采用熒光分光光度計測定熒光強度,計算加標回收率。當加入大腸桿菌o157:h7濃度為105cfu·ml-1時,測得的熒光光強度為249.172,計算得大腸桿菌o157:h7的濃度為104.96cfu·ml-1,回收率為91.20%;當加入單增李斯特菌濃度為105cfu·ml-1時,測得的熒光光強度為312.583,計算得單增李斯特菌的濃度為105.09cfu·ml-1,回收率為109.65%;當加入布魯氏菌濃度為105cfu·ml-1時,測得的熒光光強度為271.907,計算得布魯氏菌的濃度為104.97cfu·ml-1,回收率為93.33%,三種病原菌的回收率均處于90%~110%范圍內,說明方法的準確度良好,具體結果見表10。
(3)重復性實驗
分別用建立好的檢測程序檢測濃度為105cfu·ml-1和106cfu·ml-1的三種病原菌的混懸液,每次實驗設定三個平行樣品,平行進行三次實驗,測定熒光強度,計算變異系數(coefficientofvariation,cv)。所得到的變異系數均低于10%,說明結果所建立的檢測方法穩定性較好,具體結果見表11。
(4)特異性實驗
取擬進行交叉反應的菌株,包括副溶血弧菌(atcc17802)、金黃色葡萄球菌(atcc25923)、鼠傷寒沙門氏菌(atcc13311)、糞鏈球菌(atcc14506)、布氏檸檬酸桿菌(atcc43162)、鮑氏志賀氏菌(atcc9207)、粘質沙雷氏菌(atcc13880)、陰溝腸桿菌(jl08011)和奇異變形桿菌(proteusmirabilis,jl08017),用pbs緩沖液調整菌懸液濃度為1×105cfu·ml-1。取若干份50μl的免疫磁珠,加入150μlpbs緩沖液將體積補充至200μl后,分別加入上述病原菌的菌懸液,同時設不含任何病原菌的pbs緩沖液作為空白對照,設定同時含有三種病原菌的混懸液作為陽性對照,按照已優化的檢測條件進行檢測,采用熒光分光光度計測定熒光強度,記錄熒光值,進行結果分析。結果見表12,采用熒光值/空白熒光≥2.1作為陽性結果的判定標準,結果表明所建立的檢測方法與粘質沙雷氏菌(atcc13880)有交叉反應,與其他菌株均沒有交叉反應,說明所建立的三種病原菌同步快速檢測方法特異性較好。
實施例10試劑盒的制備
由實施例5所描述的免疫磁珠、實施例6所描述的三種量子點熒光生物探針、實施例7所描述的緩沖液、實施例8所描述的三種病原菌混懸液的同步快速檢測三種病原菌的試劑盒。
實施例11模擬樣品的檢測
1.牛奶模擬樣的制備及檢測
從超市購買超高溫滅菌純牛奶用于制備牛奶模擬樣,具體為用純牛奶作為稀釋液,配制濃度為107cfu·ml-1、106cfu·ml-1、105cfu·ml-1、104cfu·ml-1、103cfu·ml-1、102cfu·ml-1和101cfu·ml-1系列稀釋的三種病原菌的菌懸液,同時采用不添加任何細菌的純牛奶作為空白對照,利用所建立的檢測方法進行檢測,采用熒光分光光度計測定熒光強度,熒光圖譜如圖7所示,隨著加入菌液濃度的增加,熒光強度逐漸升高。以病原菌濃度的對數作為橫坐標,以熒光強度作為縱坐標,繪制所建立的檢測方法檢測三種病原菌的標準曲線,并計算檢測限,結果如圖8和表13所示,所建立的檢測方法線性良好,對大腸桿菌o157:h7、單增李斯特菌和布魯氏菌的最低檢測限均為103cfu·ml-1。
2.羊肉模擬樣的制備及檢測
從超市購買羊肉,稱取10g加入到10ml生理鹽水中,4℃浸泡24h,過濾收集浸出液,用浸出液作為稀釋液,將大腸桿菌o157:h7、單增李斯特菌及布魯氏菌進行稀釋,用羊肉浸出液作為稀釋液,配制濃度為107cfu·ml-1、106cfu·ml-1、105cfu·ml-1、104cfu·ml-1、103cfu·ml-1、102cfu·ml-1和101cfu·ml-1系列稀釋的三種病原菌的菌懸液,同時采用不添加任何細菌的羊肉浸出液作為空白對照,采用所建立的檢測方法進行檢測,利用熒光分光光度計測定熒光強度。熒光圖譜如圖9所示,隨著加入菌液濃度的增加,熒光強度逐漸升高。以病原菌濃度的對數作為橫坐標,以熒光強度作為縱坐標,繪制所建立的檢測方法檢測三種病原菌的標準曲線,并計算檢測限,結果如圖10和表14所示,所建立的檢測方法線性良好,對大腸桿菌o157:h7、單增李斯特菌和布魯氏菌的最低檢測限依次為104cfu·ml-1、103cfu·ml-1和104cfu·ml-1。
3.白菜模擬樣的制備及檢測
從超市購買大白菜一顆,剪碎后放入注射器中,擠壓注射器,收集白菜汁,用菜汁作為稀釋液,用白菜汁作為稀釋液,配制濃度為107cfu·ml-1、106cfu·ml-1、105cfu·ml-1、104cfu·ml-1、103cfu·ml-1、102cfu·ml-1和101cfu·ml-1系列稀釋的三種病原菌的菌懸液,同時采用不添加任何細菌的白菜汁作為空白對照,采用所建立的檢測方法進行檢測,采用熒光分光光度計測定熒光強度。熒光圖譜如圖11所示,隨著加入菌液濃度的增加,熒光強度逐漸升高。以病原菌濃度的對數作為橫坐標,以熒光強度作為縱坐標,繪制所建立的檢測方法檢測三種病原菌的標準曲線,并計算檢測限,結果如圖12和表15所示,所建立的檢測方法線性良好,對大腸桿菌o157:h7、單增李斯特菌和布魯氏菌的最低檢測限依次為103cfu·ml-1、104cfu·ml-1和105cfu·ml-1。
- 還沒有人留言評論。精彩留言會獲得點贊!