基于熒光共振能量轉移的AFP檢測法的制作方法
本發明公開了一種基于熒光共振能量轉移的afp檢測法,屬于納米免疫分析技術領域。
背景技術:
熒光共振能量轉移(fret)是指在兩個不同的熒光基團中,若一個熒光基團(供體donor)的發射光譜與另一個基團(受體acceptor)的吸收光譜有一定的重疊,兩個熒光基團間的距離合適時(一般小于10nm),即可觀察到熒光能量由供體向受體轉移的現象。
量子點(qds)是直徑約為2~20nm,能夠接受激發光產生熒光的半導體納米顆粒。傳統的fret研究的主要集中于有機熒光分子數,作為一種新型fret試劑,qds具有許多有機熒光分子不具備的優點,如有可調諧的激發波、抗漂白性、多個染料分子同時連接、狹窄的發射波長和遠離發射峰激發等優良的光學性質。因此,qds可以成為比有機熒光分子更好的fret的供體或受體。
熒光能量轉移體系發光強度大,靈敏度高,方法簡單。
技術實現要素:
本發明的目的在于提供一種基于熒光共振能量轉移的afp檢測法,利用熒光配對染料之間熒光共振能量轉移快速均相檢測廣譜腫瘤標記物afp。該方法可以在均相中實現對afp的檢測,且對afp的檢測具有靈敏度高和選擇性好的特點。
本發明采用以下技術方案:
一種基于熒光共振能量轉移的afp檢測法,包括以下步驟:
一、探針1和探針2的制備
a、cds的制備
在合成過程保持攪拌狀態的體系中,將0.1mol/l的cdcl2溶液2~8ml注入到100ml去離子水中,加入0.2~2.0mmol的巰基乙酸作為修飾劑,2~5min后用1mol/l的氫氧化鈉溶液調節體系ph值至9~11,溶液體系呈無色透明,隨后加入0.5~4ml濃度為0.1mol/l的na2s水溶液,即得cds量子點(其激發波長364nm,發射波長530nm)。
b、取cds量子點分別用0.05m的mes緩沖溶液稀釋后,加入edc和nhs(qds:edc的摩爾比為1:50~1:200;edc:nhs的摩爾比為1:1~1:5),渦旋振蕩均勻,室溫活化15~60min;將活化的量子點用30kd超濾管在8000r/min,4℃條件下離心10min,超濾純化后,加入pbs7.4稀釋,加入相對應單克隆afp抗體溶液(qds和抗體的摩爾比為1:1~10:1),4℃反應過夜,即得探針1。
c、取熒光物質(羅丹明b或紅色熒光微球)分別用0.05m的mes緩沖溶液稀釋后,加入edc和nhs(熒光物質:edc的質量比為1:50~1:200;edc:nhs的摩爾比為1:1~1:5),渦旋振蕩均勻,室溫活化15~60min;將活化的熒光物質用30kd超濾管在8000r/min,4℃條件下離心10min,超濾純化后,加入pbs7.4稀釋,加入相對應單克隆afp抗體溶液(熒光物質和抗體的質量比為100:1~10:1),4℃反應過夜,即得探針2。
其中,羅丹明激發波長525-550nm,發射波長580nm;紅色熒光微球激發波長520~535nm,發射波長600nm。羅丹明b購于sigma;紅色熒光微球購于蘇州為度生物。
二、探針1-afp-探針2熒光共振能量轉移體系制備
探針1-afp-探針2熒光共振能量轉移體系為:
樣本(標準品或待測樣本)2μl
0.05mg/ml探針120μl
0.05mg/ml探針210μl
pbs7.4緩沖液50μl
ddh2o補足至100ul。
三、afp工作曲線
先將濃度為0.075~30ng/ml的不同濃度的標準品樣本分別與探針1、pbs緩沖液接觸混勻后,分別加入探針2,超純水定容到100μl。然后常溫旋轉30~60min后,將該體系置于多功能酶標儀上檢測熒光強度。記錄混合液在探針2最大發射波長(580nm或600nm處)的熒光強度,存在afp時f,不存在afp時f0,以(f-f0)對afp濃度繪制標準曲線。
通過探針1-afp-探針2熒光共振能量轉移體系檢測待測樣本的熒光信號,將待測樣品的熒光信號值代入afp標準曲線,得出待測樣品中afp的含量。
該方法操作簡單,不需要對雜交體系中未連接的抗體進行分離,實現均相檢測;由于羅丹明b、紅色熒光微球在364nm光激發下不會直接產生熒光信號,因此背景干擾小,信號強。該方法還具有特異、快速、高選擇性和高通量的特點,可用于臨床醫學中腫瘤的廣譜篩查。
附圖說明
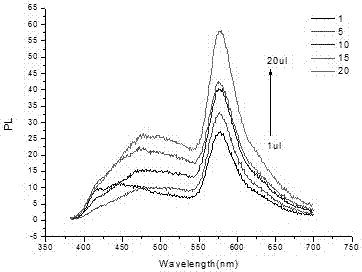
圖1為探針1濃度對fret體系的影響。
圖2為探針2濃度對fret體系的影響。
圖3為不同緩沖液對體系熒光轉化率的影響。
圖4為不同體系的afp(0,0.075,0.375,3.75,7.5,15,30)對fret體系熒光強度的影響。
圖5為afp的標準曲線圖,以(f-f0)與afp的濃度建立標準曲線。
具體實施方式
實施例1熒光共振轉移體系設計
1、探針1濃度對體系的影響
將濃度為3.75ng/ml的afp樣本與1,5,10,15,20μl濃度為0.05mg/ml探針1、50μlpbs7.4緩沖液接觸混勻后,分別加入10μl濃度為0.05mg/ml探針2,超純水定容到100μl,然后常溫旋轉3060min后,最后將該體系置于多功能酶標儀上檢測熒光強度。記錄混合液在探針2最大發射波長(580nm或600nm處)的熒光強度,結果表明固定探針2濃度不變,逐漸增加探針1的濃度,得到體系熒光光譜。如圖1,隨著探針1濃度的增加,探針2的熒光逐漸增強。
2、探針2濃度對體系的影響
將濃度為3.75ng/ml的afp樣本與20μl濃度為0.05mg/ml探針1、50μlpbs7.4緩沖液接觸混勻后,分別加入2,4,6,8,10μl濃度為0.05mg/ml探針2,超純水定容到100μl,然后常溫旋轉30~60min后,最后將該體系置于多功能酶標儀上檢測熒光強度。記錄混合液在探針2最大發射波長(580nm或600nm處)的熒光強度,結果表明固定探針1濃度不變,逐漸增加rhb的濃度,得到體系熒光光譜。如圖2,隨著探針2濃度的增加,探針1的熒光淬滅。進一步說明cds-rhb發生了有效的能量轉移。
3、不同緩沖液對體系的影響
將濃度為3.75ng/ml的afp樣本、20μl濃度為0.05mg/ml探針1分別與50μlmea、pbs7.4、tris-hcl緩沖液接觸混勻后,分別加入10μl濃度為0.05mg/ml探針2,超純水定容到100μl,然后常溫旋轉30~60min后,最后將該體系置于多功能酶標儀上檢測熒光強度。記錄混合液在探針2最大發射波長(580nm或600nm處)的熒光強度,結果表明pbs7.4緩沖液對體系反應最佳。見圖3。
根據實驗結果,將探針1-afp-探針2熒光共振能量轉移體系為:
樣本(標準品或待測樣本)2μl
0.05mg/ml探針120μl
0.05mg/ml探針210μl
pbs緩沖液50μl
ddh2o補足至100μl。
實施例2均相檢測afp的免疫熒光法
以cds和rhb為配對染料,分別標記cea配對抗體,制備探針1和探針2,用于afp檢測。
一種基于熒光共振能量轉移的afp檢測法,包括以下步驟:
一、探針1和探針2的制備
a、cds的制備
在合成過程保持攪拌狀態的體系中,將0.1mol/l的cdcl2溶液5ml注入到100ml去離子水中,加入1.0mmol的巰基乙酸作為修飾劑,2~5min后用1mol/l的氫氧化鈉溶液調節體系ph值至9~11,溶液體系呈無色透明,隨后加入1ml濃度為0.1mol/l的na2s水溶液,即得cds量子點(其激發波長364nm,發射波長530nm)。
b、取cds量子點分別用0.05m的mes緩沖溶液稀釋后,加入edc和nhs(qds:edc的摩爾比為1:50~1:200;edc:nhs的摩爾比為1:1~1:5),渦旋振蕩均勻,室溫活化15~60min;將活化的量子點用30kd超濾管在8000r/min,4℃條件下離心10min,超濾純化后,加入pbs7.4稀釋,加入相對應單克隆afp抗體溶液(qds和抗體的摩爾比為1:1~10:1),4℃反應過夜,即得探針1。
c、取羅丹明b分別用0.05m的mes緩沖溶液稀釋后,加入edc和nhs(羅丹明b:edc的質量比為1:50~1:200;edc:nhs的摩爾比為1:1~1:5),渦旋振蕩均勻,室溫活化15~60min;將活化的羅丹明b用30kd超濾管在8000r/min,4℃條件下離心10min,超濾純化后,加入pbs7.4稀釋,加入相對應單克隆afp抗體溶液(羅丹明b和抗體的質量比為100:1~10:1),4℃反應過夜,即得探針2。
其中,羅丹明激發波長525~550nm,發射波長580nm。
二、afp標準曲線
先將濃度為0.075~30ng/ml的不同濃度的標準品樣本各2μl分別與20μl濃度為0.05mg/ml探針1、50μlpbs7.4緩沖液接觸混勻后,分別加入10μl濃度為0.05mg/ml探針2,超純水定容到100μl,然后常溫旋轉30~60min后,最后將該體系置于多功能酶標儀上檢測熒光強度。記錄混合液在探針2最大發射波長(580nm或600nm處)的熒光強度,存在afp時f,不存在afp時f0,以(f-f0)對afp濃度繪制標準曲線(見圖4、圖5)。
通過探針1-afp-探針2熒光共振能量轉移體系檢測待測樣本的熒光信號,將待測樣品的熒光信號值代入afp標準曲線,得出待測樣品中afp的含量。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種基于熒光共振能量轉移技術的前列腺素受體4篩選模型的制作方法
- 一種基于熒光共振能量轉移技術的g蛋白偶聯受體40篩選模型的制作方法
- 一種基于熒光共振能量轉移技術的血管活性腸肽i型受體抑制劑高通量篩選方法
- 一種基于熒光共振能量轉移技術的多巴胺5受體抑制劑高通量篩選方法
- 一種基于熒光共振能量轉移技術的阿爾法1d受體篩選模型的制作方法
- 基于熒光共振能量轉移的雙酚a痕量檢測法
- 一種基于熒光共振能量轉移技術的黑素皮質素受體1藥物篩選模型的制作方法
- 一種基于熒光共振能量轉移技術的阿爾法1b受體篩選模型的制作方法
- 一種基于熒光共振能量轉移技術的白三烯b4受體1拮抗劑藥物篩選模型的制作方法
- 一種采用共振能量轉移層的寬波段太陽能電池的制作方法