在線監測用葡萄糖氧化酶絲網印刷電極及其制備方法與流程
本發明涉及一種在線監測用葡萄糖氧化酶絲網印刷電極及其制備方法,屬于生物傳感器及電分析化學測試技術領域。
背景技術:
生物傳感器是一種以化學或物理傳感器為基底換能器件,通過特定的生物活性器件的修飾形成的可用于對特定物質進行定性或定量分析的傳感元件,在工業、醫療、環境、軍事等重要領域有廣泛應用。由酶修飾獲得的電流型生物傳感器適用范圍廣、原材料品種繁多、生產制造簡易、傳感性能可靠、使用便捷簡單、響應快速省時,是生物傳感器領域中的重要組成部分。
工業化生產過程中,往往需要對發酵過程中的反應底物的濃度變化進行實時監測,這要求為發酵領域提供一種廉價、使用方便、分析結果可靠的在線檢測方法及設備。葡萄糖是一種極為常見的發酵原料,對其濃度進行在線實時監測在工業生產中具有重要意義。
發酵過程中的實時監測面臨諸多較為棘手的問題,如:便捷自動化的在線取樣、有效避免取樣及分析過程中可能造成的生物污染、較長期保證傳感器的穩定性能等。迄今,美國專利商標局公布的專利中,有關生物傳感器的專利近12,000項,其中約6,000項與葡萄糖的分析測試有關;歐洲專利局公布近10,000項,其中逾700項與葡萄糖分析檢測直接相關;中國專利局公布約600項生物傳感領域的專利,其中不足20項與葡萄糖的分析檢測直接相關。上述專利中,尚未見到面向工業發酵過程中葡萄糖在線分析檢測的報道。
面向市場的葡萄糖生物傳感器,正面臨或難以多次、重復進行分析測試,或難以批量、工業化生產等問題。同時,發酵液的成分通常較為復雜,電流型酶生物傳感器往往難以避免其中非目標檢測組分的干擾。這些都是阻礙葡萄糖生物傳感器進入工業發酵過程在線分析的主要困難。
技術實現要素:
為了解決以上技術問題,本發明提供了一種適于工業化生產及工業生產實際應用的酶傳感器電極。該電極以固定化的葡萄糖氧化酶作為其生物活性元件,以普魯士藍修飾的絲網印刷電極片為電化學換能元件構成。同時提供該酶傳感器電極的電化學基底電極、固定化酶及完整酶電極的制作方法及使用方法。通過與在線取樣系統的聯用,本發明適于發酵過程中的葡萄糖在線分析測試要求。
本發明技術方案如下:
1)普魯士藍摻雜的介體型過氧化氫絲網印刷電極制作:
配制含等摩爾濃度k3fe(cn)6和kcl的水溶液,以鹽酸調節其ph在1.0-2.5范圍內,在快速攪拌條件下向其中逐滴加入1-1.33倍體積含等摩爾濃度的fecl3水溶液,充分反應后以4000rpm離心分離獲得深藍色物質即普魯士藍;置于烘箱內于95℃烘干至恒重,再于同一烘箱內于100℃-150℃下烘制0.5-2h,得到活化的普魯士藍,干燥器內冷卻后以研缽研細成顆粒待用;稱取普魯士藍顆粒0.05g,配和入1mln,n-二甲基甲酰胺以研缽研細,隨后加入3g導電碳漿和2ml導電碳漿專用溶劑精細研磨20min使物料充分混勻,制成普魯士藍摻雜的碳基導電油墨;
取厚度為0.5mm的聚氯乙烯基片,以1mol/lnaoh溶液浸泡處理4h后洗凈晾干;制作普魯士藍摻雜絲網印刷電極:
(1)首先,在洗凈的聚氯乙烯基片上以導電碳漿印制導線及兩個電極,印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發;
(2)兩個電極中取其中一個作為對電極,另一個電極上印制普魯士藍摻雜的碳基導電油墨成工作電極,印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發并使基底電極得到活化;
(3)最后以環氧樹脂印制環氧樹脂絕緣層,覆蓋其導電部分,僅暴露出其工作面積、對電極及同檢測器連接的導電部;印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發;
2)酶固定化載體(pei-cho)制備
以含有0.1mol/l冰乙酸的水溶液在90℃條件下溶解固體聚乙烯亞胺獲得質量濃度為1.0-2.0wt%的聚乙烯亞胺水溶液,冷卻后過濾得純凈的聚乙烯亞胺溶膠;
取1.0-2.0wt%聚乙烯亞胺溶膠,在磁力攪拌條件下逐滴滴加入含量為20-500倍聚乙烯亞胺干重的戊二醛水溶液中進行充分反應,所用戊二醛為質量分數為25%-50%的水溶液,反應時間為12-16h得到pei-cho合成母液;
為去除pei-cho合成母液內的戊二醛以獲得純凈的pei-cho,使用截留分子量為8-50kda的透析袋進行2-3d的透析,其間每隔4-6h更換一次透析液,所用透析液為0.01-0.1mol/l的na2ac-hac緩沖液;或以乙醚或三氯甲烷為萃取劑對合成母液進行反復透析后,與萃取產物等體積的0.01-0.1mol/l的na2ac-hac緩沖液混合;或以截留分子量(mwco)為3-50kda的超濾膜進行超濾;
3)固定化葡萄糖氧化酶(pei-co-gox)的制備及酶電極的制作
(1)取2.5-3份體積的純化pei-cho以0.01-0.1mol/l的na2ac-hac緩沖液稀釋成pei-cho含量為0.1-0.5wt%的稀溶液;
(2)以0.01-0.1mol/l的na2ac-hac緩沖液配制含300-340u/ml的gox酶稀釋液,取0.8-1份與步驟(1)所述的溶液均勻混合并靜置0-30min,于4℃、2000-6000rpm條件下離心5-10min,收集其沉淀部分待用;
(3)將沉淀部分以5-6份體積0.01-0.1mol/lna2ac-hac的緩沖液重新分散,再將分散液同1.7-3.4份體積0.01-0.1mol/lna2ac-hac緩沖液配置的含1-3wt%的羧基化聚乙烯亞胺(c-chit)、羧甲基纖維素鈉(cmc)、牛血清蛋白(bsa)或其混合物均勻混合,靜置0-30min后所得懸濁液即經固定化修飾后的酶制劑;
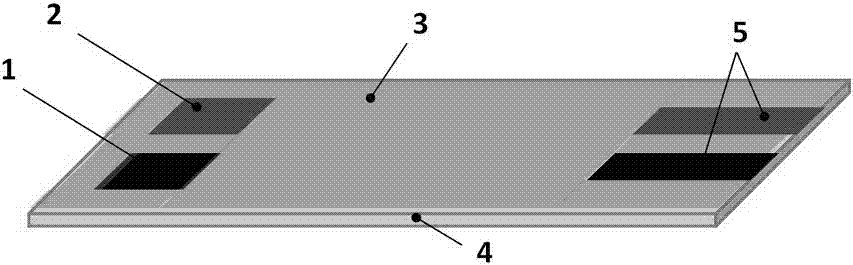
(4)將25-50μl該懸濁液滴加于介體摻雜的絲網印刷電極片工作面積上成固定化酶層,于室溫條件下靜置3-4小時;以切割成合適尺寸的纖維素濾紙或玻璃纖維素濾紙為保護膜緊密覆蓋電極片的工作面積,以雙面膠密封后成為成品酶電極(見圖2);
4)安培型測試
將酶電極片的兩電極接口部分同檢測器電路相連接構成完整檢測器,檢測時以ph6.0-7.0的磷酸鹽緩沖液浸沒電極片工作面積,在恒速磁力攪拌的條件下向電極體系施加一定的恒定電壓,記錄其電流-時間響應曲線;當電流響應穩定后,記錄對含純品葡萄糖量確定的標定液的電流響應值作為滿值,檢測器系統自動生成回歸方程用于定量檢測,隨后可開始對發酵液樣本進行在線檢測;按照本發明方法所制備的酶電極在不同的葡萄糖濃度下測定的傳感結果(見圖3),響應時間12-20s,在葡萄糖濃度為0.05-1mmol/l范圍內獲得電流與葡萄糖濃度的線性關系。利用儀器自動標定產生的回歸方程可定量分析試樣中的葡萄糖濃度。
絲網印刷電極具有制作簡便、成本低廉、成品間的重現性理想、電極體積小等優勢,已在多種電化學檢測器件的工業化生產中占用重要地位。普魯士藍是一種過氧化氫的理想電化學催化劑,不僅能夠在極低的電位條件下對過氧化氫產生高效電催化,同時其電催化作用以電化學還原反應的形式體現,不同于常規測試方法中所依賴利用的電化學氧化反應。大量實驗已經證實,應用普魯士藍修飾的電化學傳感器能夠實現對過氧化氫的高效、專一性電分析檢測。
化學沉積法同電化學沉積法制備的普魯士藍相比具有相似的過氧化氫電化學活性,但操作更為簡單,所需的合成設備簡易而廉價,合成時間短,可按照生產需要進行批量合成的明顯優勢,特別適合應用于批量生產的電化學修飾電極設計、制造中。將絲網印刷技術與普魯士藍結合,適合可工業化生產的過氧化氫電極的開發。目前國內外均已出現普魯士藍修飾的絲網印刷電極產品。
通過對葡萄糖氧化酶對其底物葡萄糖的酶促反應產物過氧化氫的定量分析,可以間接實現對葡萄糖的定量分析。相比于第一代溶氧測量型傳感器具有明顯優勢。
本發明利用普魯士藍作為電子媒介體制備修飾基底電極,制作簡單、成本低廉,利用過氧化氫的電化學還原過程進行定量分析有效避免了分析試樣中易氧化成分帶來的干擾。以本發明提供的方法制備的固定化酶活力保留率高,壽命較長,用于制作酶電極片修飾操作簡單,對分析物的傳質阻力小。借助絲網印刷工藝,電極片的生產簡易、經濟且信號重現性良好,適于投入工業化生產,用于發酵工業中的在線分析。
附圖說明
圖1為本發明介體摻雜絲網印刷電極片的制作過程示意圖;
圖2為本發明基于介體摻雜絲網印刷電極片的固定化酶修飾過程示意圖;
圖3為本發明完整酶電極的結構示意圖;
圖4為固定化載體pei-coh及固定化酶pei-co-gox的紅外表征結果圖;
圖5為本發明實施例1中酶電極對0.05-1mmol/l的葡萄糖標準溶液的電流-時間響應關系圖;
圖6為本發明實施例2中酶電極對以1mmol/l葡萄糖標準溶液定標的電流-時間響應、對發酵液(檸檬酸發酵液,發酵時間57h)實際樣本的響應及其對5次0.1mmol/l葡萄糖標準溶液的加標響應。
具體實施方式
以下通過具體實施例對本發明做進一步闡述:
實施例1
葡萄糖標準品的檢測
1)普魯士藍摻雜的介體型過氧化氫絲網印刷電極制作:
配制含等摩爾濃度k3fe(cn)6和kcl的水溶液,以鹽酸調節其ph在1.0-2.5范圍內,在快速攪拌條件下向其中逐滴加入1-1.33倍體積含等摩爾濃度的fecl3水溶液,充分反應后以4000rpm離心分離獲得深藍色物質即普魯士藍;置于烘箱內于95℃烘干至恒重,再于同一烘箱內于100℃-150℃下烘制0.5-2h,得到活化的普魯士藍,干燥器內冷卻后以研缽研細成顆粒待用;稱取普魯士藍顆粒0.05g,配和入1mln,n-二甲基甲酰胺以研缽研細,隨后加入3g導電碳漿和2ml導電碳漿專用溶劑精細研磨20min使物料充分混勻,制成普魯士藍摻雜的碳基導電油墨;
取厚度為0.5mm的聚氯乙烯基片4,以1mol/lnaoh溶液浸泡處理4h后洗凈晾干;制作普魯士藍摻雜絲網印刷電極:
(1)首先,在洗凈的聚氯乙烯基片上以導電碳漿印制導線6及兩個電極,印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發;
(2)在兩個電極中取其中一個作為對電極2,另一個電極上印制普魯士藍摻雜的碳基導電油墨成工作電極1,印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發并使基底電極得到活化;
(3)最后以環氧樹脂印制環氧樹脂絕緣層3,覆蓋其導電部分,僅暴露出其工作面積1、對電極2及同檢測器連接的導電部5;印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發;見圖1;
2)酶固定化載體(pei-cho)制備
以含有0.1mol/l冰乙酸的水溶液在90℃條件下溶解固體聚乙烯亞胺獲得質量濃度為1.0-2.0wt%的聚乙烯亞胺水溶液,冷卻后過濾得純凈的聚乙烯亞胺溶膠;
取1.0-2.0wt%聚乙烯亞胺溶膠,在磁力攪拌條件下逐滴滴加入含量為20-500倍聚乙烯亞胺干重的戊二醛水溶液中進行充分反應,所用戊二醛為質量分數為25%-50%的水溶液,反應時間為12-16h得到pei-cho合成母液;
為去除pei-cho合成母液內的戊二醛以獲得純凈的pei-cho,使用截留分子量為8-50kda的透析袋進行2-3d的透析,其間每隔4-6h更換一次透析液,所用透析液為0.01-0.1mol/l的na2ac-hac緩沖液;或以乙醚或三氯甲烷為萃取劑對合成母液進行反復透析后,與萃取產物等體積的0.01-0.1mol/l的na2ac-hac緩沖液混合;或以截留分子量(mwco)為3-50kda的超濾膜進行超濾;
3)固定化葡萄糖氧化酶(pei-co-gox)的制備及酶電極的制作
(1)取2.5-3份體積的純化pei-cho以0.01-0.1mol/l的na2ac-hac緩沖液稀釋成pei-cho含量為0.1-0.5wt%的稀溶液;
(2)以0.01-0.1mol/l的na2ac-hac緩沖液配制含300-340u/ml的gox酶稀釋液,取0.8-1份與步驟(1)所述的溶液均勻混合并靜置0-30min,于4℃、2000-6000rpm條件下離心5-10min,收集其沉淀部分待用;
(3)將沉淀部分以5-6份體積0.01-0.1mol/lna2ac-hac的緩沖液重新分散,再將分散液同1.7-3.4份體積0.01-0.1mol/lna2ac-hac緩沖液配置的含1-3wt%的羧基化聚乙烯亞胺(c-chit)、羧甲基纖維素鈉(cmc)、牛血清蛋白(bsa)或其混合物均勻混合,靜置0-30min后所得懸濁液即經固定化修飾后的酶制劑;其紅外表征圖如圖4:(a)gox純品;(b)pei純品;(c)pei-gdi純品;(d)pei-gdi-gox,所有樣品皆為經過脫水處理:并制作brk壓片后進行表征。1107cm-1:c-n伸縮振動;1637cm-1:西弗堿(c=n)伸縮振動;1717cm-1:游離醛基c=o;2869cm-1及2939cm-1:甲基及飽和c-h伸縮振動;3424cm-1:n-h或nh2伸縮振動;可以看出,pei經戊二醛處理后形成了西弗堿結構并使分子體系攜帶有游離醛基,說明分子改造過程已經使pei-gdi形成;pei-gdi同酶分子結合后,分子體系的西弗堿結構含量有所增加而游離醛基的特征峰基本消失,表明pei-gdi結合酶分子并同其建立共價聯接的能力;
(4)將25-50μl該懸濁液滴加于介體摻雜的絲網印刷電極片工作面積上成固定化酶層7,于室溫條件下靜置3-4小時;以切割成合適尺寸的纖維素濾紙或玻璃纖維素濾紙為保護膜8緊密覆蓋電極片的工作面積,以雙面膠密封后成為成品酶電極(見圖2、圖3);
4)安培型測試
將新制的酶電極片與一支飽和ag/agcl電極組成三電極系統。測量時于容量為5ml的反應池內以濃度為0.1mol/l的ph6.0磷酸鹽緩沖液浸沒電極體系,在恒速磁力攪拌下向電極施加一定的恒定電壓。待電流響應穩定后向反應池內加入已知濃度的葡萄糖標準溶液,記錄其對葡萄糖標準樣品的電流-時間響應曲線(見圖5)。利用由該響應曲線繪制的電流-濃度關系曲線及其回歸方程可完成發酵液實際樣品的定量分析。
實施例2
1)普魯士藍摻雜的介體型過氧化氫絲網印刷電極制作:
配制含等摩爾濃度k3fe(cn)6和kcl的水溶液,以鹽酸調節其ph在1.0-2.5范圍內,在快速攪拌條件下向其中逐滴加入1-1.33倍體積含等摩爾濃度的fecl3水溶液,充分反應后以4000rpm離心分離獲得深藍色物質即普魯士藍;置于烘箱內于95℃烘干至恒重,再于同一烘箱內于100℃-150℃下烘制0.5-2h,得到活化的普魯士藍,干燥器內冷卻后以研缽研細成顆粒待用;稱取普魯士藍顆粒0.05g,配和入1mln,n-二甲基甲酰胺以研缽研細,隨后加入3g導電碳漿和2ml導電碳漿專用溶劑精細研磨20min使物料充分混勻,制成普魯士藍摻雜的碳基導電油墨;
取厚度為0.5mm的聚氯乙烯基片4,以1mol/lnaoh溶液浸泡處理4h后洗凈晾干;制作普魯士藍摻雜絲網印刷電極:
(1)首先,在洗凈的聚氯乙烯基片上以導電碳漿印制導線6及兩個電極,印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發;
(2)在兩個電極中取其中一個作為對電極2,另一個電極上印制普魯士藍摻雜的碳基導電油墨成工作電極1,印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發并使基底電極得到活化;
(3)最后以環氧樹脂印制環氧樹脂絕緣層3,覆蓋其導電部分,僅暴露出其工作面積1、對電極2及同檢測器連接的導電部5;印刷完成后,置于90℃的烘箱內使有機溶劑充分揮發;見圖1;
2)酶固定化載體(pei-cho)制備
以含有0.1mol/l冰乙酸的水溶液在90℃條件下溶解固體聚乙烯亞胺獲得質量濃度為1.0-2.0wt%的聚乙烯亞胺水溶液,冷卻后過濾得純凈的聚乙烯亞胺溶膠;
取1.0-2.0wt%聚乙烯亞胺溶膠,在磁力攪拌條件下逐滴滴加入含量為20-500倍聚乙烯亞胺干重的戊二醛水溶液中進行充分反應,所用戊二醛為質量分數為25%-50%的水溶液,反應時間為12-16h得到pei-cho合成母液;
為去除pei-cho合成母液內的戊二醛以獲得純凈的pei-cho,使用截留分子量為8-50kda的透析袋進行2-3d的透析,其間每隔4-6h更換一次透析液,所用透析液為0.01-0.1mol/l的na2ac-hac緩沖液;或以乙醚或三氯甲烷為萃取劑對合成母液進行反復透析后,與萃取產物等體積的0.01-0.1mol/l的na2ac-hac緩沖液混合;或以截留分子量(mwco)為3-50kda的超濾膜進行超濾;
3)固定化葡萄糖氧化酶(pei-co-gox)的制備及酶電極的制作
(1)取2.5-3份體積的純化pei-cho以0.01-0.1mol/l的na2ac-hac緩沖液稀釋成pei-cho含量為0.1-0.5wt%的稀溶液;
(2)以0.01-0.1mol/l的na2ac-hac緩沖液配制含300-340u/ml的gox酶稀釋液,取0.8-1份與步驟(1)所述的溶液均勻混合并靜置0-30min,于4℃、2000-6000rpm條件下離心5-10min,收集其沉淀部分待用;
(3)將沉淀部分以5-6份體積0.01-0.1mol/lna2ac-hac的緩沖液重新分散,再將分散液同1.7-3.4份體積0.01-0.1mol/lna2ac-hac緩沖液配置的含1-3wt%的羧基化聚乙烯亞胺(c-chit)、羧甲基纖維素鈉(cmc)、牛血清蛋白(bsa)或其混合物均勻混合,靜置0-30min后所得懸濁液即經固定化修飾后的酶制劑;
(4)將25-50μl該懸濁液滴加于介體摻雜的絲網印刷電極片工作面積上成固定化酶層7,于室溫條件下靜置3-4小時;以切割成合適尺寸的纖維素濾紙或玻璃纖維素濾紙為保護膜8緊密覆蓋電極片的工作面積,以雙面膠密封后成為成品酶電極(見圖2、圖3);
4)安培型測試
酶電極的安培型測試:將新制的酶電極片按照圖6所示連接方式組成完整葡萄糖在線檢測系統。測量時于容量為5ml的反應池內以濃度為0.1mol/l的ph6.0磷酸鹽緩沖液浸沒電極體系,在恒速磁力攪拌下向電極施加一定的恒定電壓,待電極在空白緩沖溶液中的電流響應穩定后,向反應池中加入100mmol/l的葡萄糖標準溶液50μl,記錄其加入18s后的相應電流值作為滿度值。更換反應池內的緩沖溶液,待電極的電流響應再次穩定后,向反應池內加入50μl發酵液樣本原液,以標準加入法計算其葡萄糖濃度。隨后逐次向反應池內加入50μl的100mmol/l葡萄糖標準溶液共5批,并由此計算其回收率(見圖6、表1)。
- 還沒有人留言評論。精彩留言會獲得點贊!