MALDI?TOFMS技術鑒定臨床感染豬腸球菌的方法與流程
本發明涉及細菌檢測領域,尤其是公開了一種maldi-tofms技術鑒定臨床感染豬腸球菌的方法。
背景技術:
腸球菌為革蘭陽性兼性厭氧菌,是動物性食品污染的常見菌之一,近來腸球菌對動物致病性的報道不斷增多,尤其是20~70日齡豬常發生一種高熱、皮下及實質臟器腫大、出血為主要特征的傳染病,以散養和小規模豬群多發,給養豬業造成了嚴重的經濟損失。由于腸球菌對現有抗生素均產生不同程度的耐藥性,且抗性基因通過食物鏈由動物傳播給人或在其他細菌之間傳遞,這使得腸球菌快速準確的鑒定顯得尤為重要,并對感染腸球菌的診斷和治療具有重要意義。
技術實現要素:
本發明克服現有技術存在的不足,提供一種操作簡便、快速、準確性高的鑒定臨床感染豬腸球菌的方法。
為了解決上述技術問題,本發明采用的技術方案為:maldi-tofms技術鑒定臨床感染豬腸球菌的方法,其特征在于,包括以下步驟:
步驟一:采用甲酸提取法對樣品進行處理與點樣;
1)向1.5mlep離心管中加入300μl去離子水;取待測樣本(一個菌落)5-10mg至離心管中;充分混勻;加入900μl無水乙醇,充分混勻;
2)13000rpm離心2min,倒去上清。再次離心,用移液槍完全吸取殘余的上清液,整個過程不觸碰沉淀。室溫下干燥沉淀2-3min。
3)加入70%甲酸水溶液50μl,充分混勻;再加入50μl的純乙腈,充分混勻;13000rpm離心2min,吸取上清置于另一新的離心管中;
4)取上清1μl置于maldi靶板上,室溫晾干,再加1μlhcca基質液覆蓋樣品,室溫晾干后上機;
5)分別取等體積的標準肽溶液與基質溶液混合后,取1μl混合液置于maldi靶板上,室溫晾干,待完全干燥后進行檢測,每個樣品和標準品各做三個平行孔。
步驟二:利用maldibiotyper高通量微生物鑒定系統對經過步驟一處理的樣品進行質譜分析,得到質譜圖;
放入已點好樣品和校準品的靶板。打開flexcontrol,校準儀器,先用標準品進行系統誤差校正,再進行待測樣本的質譜分析,通過biotyper軟件進行分析鑒定。
步驟三:使用biotyper軟件,對得到的質譜圖進行分析,得到腸球菌質譜圖數據庫的標準圖譜;
步驟四:將待檢測的腸球菌用腦心浸液瓊脂培養及分純,并進行步驟一和步驟二處理;
步驟五:對待檢測的腸球菌質譜圖進行聚類分析。
所述步驟一具體包括以下步驟:1)向1.5mlep離心管中加入300μl去離子水;取待測樣本5-10mg至離心管中;充分混勻;加入900μl無水乙醇,充分混勻;
2)13000rpm離心2min,倒去上清;再次離心,用移液槍完全吸取殘余的上清液,整個過程不觸碰沉淀;室溫下干燥沉淀2-3min;
3)加入70%甲酸水溶液50μl,充分混勻;再加入50μl的純乙腈,充分混勻;13000rpm離心2min,吸取上清置于另一新的離心管中;
4)取上清1μl置于maldi靶板上,室溫晾干,再加1μlhcca基質液覆蓋樣品,室溫晾干后上機;
5)分別取等體積的標準肽溶液與基質溶液混合后,取1μl混合液置于maldi靶板上,室溫晾干,每個樣品和標準品各做三個平行孔;所述步驟二具體包括以下步驟:放入已點好樣品和校準品的靶板;打開flexcontrol,校準儀器,先用標準品進行系統誤差校正,再進行待測樣本的質譜分析,通過biotyper軟件進行分析鑒定。
所述樣品為16srrna確認的臨床株;所述標準品為atcc29212糞腸球菌。
所述步驟三具體包括以下步驟:對樣品處理與點樣,每個平行樣品重復點3個樣品孔;每個樣品孔采集8張質譜圖;每個菌株采集24張譜圖,共收集到240張并保存;使用biotyper軟件,分別調入所采集的每株腸球菌的質譜圖,將此質譜圖匯總進行分析,該圖譜即為腸球菌質譜圖數據庫的標準圖譜。
所述待檢測的腸球菌為33株腸球菌臨床野生株。
本發明與現有技術相比有以下有益效果:
本發明采用的檢測方法與傳統和基因型鑒定方法相比,maldi-tofms是基于蛋白指紋圖譜的鑒定方法,操作簡便、快速、準確性高。本研究從河南不同地區病豬分離的腸球菌,利用maldi-tofms方法鑒定均為糞腸球菌和屎腸球菌,且親緣關系較近。而糞腸球菌和屎腸球菌是所有腸球菌感染致病中較為常見的菌株,也是醫院、食品和豬糞等環境中的優勢菌,由于腸球菌具有較強的獲得性耐藥能力,且在各種環境中生存能力較強,maldi-tofms方法對腸球菌的快速鑒定,可避免菌株的傳播和更多耐藥菌株的產生,對于獸醫臨床實踐具有重要的意義。
附圖說明
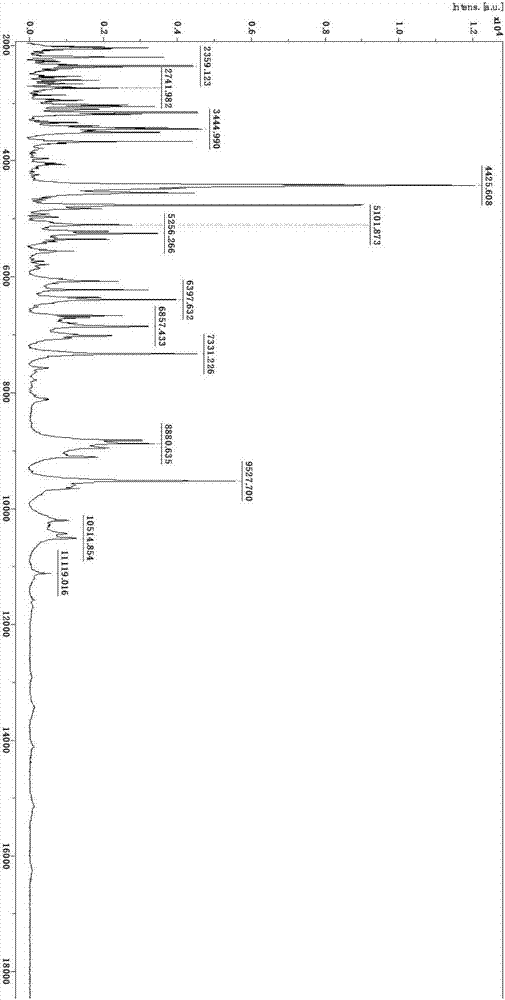
圖1為腸球菌的主要離子峰圖譜;
圖2為33株腸球菌的可信度分值;
圖3為33株腸球菌指紋圖譜的聚類分析。
具體實施方式
下面結合附圖和實施例,對本發明的具體實施方式作進一步詳細描述,以下實施例用于說明本發明,但不用來限制本發明的范圍。
本實施例中,10株建庫的腸球菌為16srrna確認的臨床株,33株建庫后驗證的腸球菌為臨床野生分離株。質控菌株atcc29212為糞腸球菌,以上均為河南農業大學贈送。
實驗中用到的甲酸、乙腈、三氟乙酸、無水乙醇都是由fisher公司提供的色譜純。bts標準品、基質α-氰-4-羥基肉桂酸(hcca)、msp96孔靶由德國bruker公司提供。
革蘭陽性細菌鑒定卡(gpi;生產批號:b56k),購自法國生物梅里埃中國有限公司產品;
腦心浸液瓊脂培養基(bhi)(生產批號:160220)購自北京陸橋;maldibiotyper高通量微生物鑒定系統,購自德國brukerdahonics公司,參數設置:線性操作模式,正離子,基質抑制偏轉模式。脈沖離子提取時間:100ns。相對分子質量:2000~20000d;
具體鑒定方法包括如下步驟:
步驟一:采用甲酸提取法對樣品進行處理與點樣;
步驟二:利用maldibiotyper高通量微生物鑒定系統對經過步驟一處理的樣品進行質譜分析,得到質譜圖;
步驟三:使用biotyper軟件,對得到的質譜圖進行分析,得到腸球菌質譜圖數據庫的標準圖譜;
步驟四:將待檢測的腸球菌用腦心浸液瓊脂培養及分純,并進行步驟一和步驟二處理;
步驟五:對待檢測的腸球菌質譜圖進行聚類分析。
1.2.1樣品處理與點樣采用甲酸提取法
1)向1.5mlep離心管中加入300μl去離子水;取待測樣本(一個菌落)5-10mg至離心管中。充分混勻;加入900μl無水乙醇,充分混勻;
2)13000rpm離心2min,倒去上清。再次離心,用移液槍完全吸取殘余的上清液,整個過程不觸碰沉淀。室溫下干燥沉淀2-3min;
3)加入70%甲酸水溶液50μl,充分混勻;再加入50μl的純乙腈,充分混勻;13000rpm離心2min,吸取上清置于另一新的離心管中;
4)取上清1μl置于maldi靶板上,室溫晾干,再加1μlhcca基質液覆蓋樣品,室溫晾干后上機;
5)分別取等體積的標準肽溶液與基質溶液混合后,取1μl混合液置于maldi靶板上,室溫晾干,待完全干燥后進行檢測,每個樣品和標準品各做三個平行孔;
1.2.2數據采集
放入已點好樣品和校準品的靶板。打開flexcontrol,校準儀器,先用標準品進行系統誤差校正,再進行待測樣本的質譜分析,通過biotyper軟件進行分析鑒定。
1.2.3建立數據庫的方法
按1.2.1.1的方法進行樣品處理與點樣,每個平行樣品重復點3個樣品孔。每個樣品孔采集8張質譜圖。每個菌株采集24張譜圖,共收集到240張并保存。使用biotyper軟件,分別調入所采集的每株腸球菌的質譜圖,將此質譜圖匯總(已有數據庫和新建數據庫)進行分析,該圖譜腸球菌質譜圖數據庫的標準圖譜。
1.2.4臨床野生株的鑒定
取33株腸球菌臨床野生株,用腦心浸液瓊脂(bhi)培養及分純,
參照上述建庫時的處理方法,然后上機。
1.2.5結果判斷如表1所示為質譜數據判斷標準
表1
2結果
2.1建庫
經過16srrna確認的10株腸球菌臨床株,用于建立maldi-tofms數據庫,對10株菌全部進行了數據采集與匯總,建立了標準圖譜,最終建成包含10株腸球菌信息的數據庫,如圖1所示。這10株腸球菌菌株的主要離子峰一致,峰譜穩定;
2.2臨床野生株的鑒定
依次將1-33株腸球菌如圖2所示,分別進行鑒定,分析與腸球菌數據庫中的匹配結果。經maldi-tofms鑒定,33株腸球菌的匹配分值均大于2.300,表明鑒定結果的可信度很高。
2.3腸球菌maldi-tofms質譜聚類分析結果
選取33株腸球菌質譜圖進行聚類分析,采用相似分值構建系統樹,33株腸球菌聚類分型樹狀圖如圖3所示。差異程度0-1000表示菌株之間的同源性程度高低,差異程度越接近1000,表示菌株同源性越低,越接近0時表示菌株同源性越高。經maldi-tofms分析33株腸球菌在差異程度為0.8時分成兩個主要的類別,用不同的顏色標示,其中綠色為糞腸球菌共13株,紅色為屎腸球菌20株,1號菌株為糞腸球菌atcc29212,與5號菌株同源性最高,與屎腸球菌相比,糞腸球菌的親緣關系更近一些。
以上所述僅為本發明的優選實施例而已,并不用于限制本發明,盡管參照前述實施例對本發明進行了詳細的說明,對于本領域的技術人員來說,其依然可以對前述各實施例所記載的技術方案進行修改,或者對其中部分技術特征進行等同替換,凡在本發明的精神和原則之內,所作的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!