基于背景熒光猝滅?免疫層析測定牛奶中林可霉素的方法與流程
本發明涉及牛奶檢測技術領域,是一種基于背景熒光猝滅-免疫層析測定牛奶中林可霉素的方法。
背景技術:
林可霉素(linconycin,lin)屬于林可胺類抗生素,對于革蘭氏陽性菌有較強抗菌作用,對支原體也有抑菌作用,但對革蘭氏陰性菌無效。臨床上主要應用于葡萄球菌、化膿性鏈球菌、肺炎球菌及厭氧菌所致的呼吸道感染、皮膚軟組織感染、女性生殖道及盆腔感染和厭氧菌所致的腹腔感染等。還可用于鏈球菌和葡萄球菌所致的敗血癥、骨和關節感染、慢性骨和關節感染的外科輔助治療、葡萄球菌所致的急性血源性骨髓炎等。作為獸藥,常被添加在飼料中或直接乳房注射治療奶牛的乳房炎,但殘留在乳腺管中的林可霉素,會經乳汁排出,導致生鮮乳中抗生素殘留,對消費者引起機體的過敏反應或抗藥性。各國都對其有限量要求,中華人民共和國農業部公告第253號-2002牛奶中最高殘留限量為100ng/ml。
在進出口動物源性食品snt2218-2008中林可胺類藥物殘留量檢測方法中林可霉素的檢測方法為液相色譜-串質譜法和質譜法。在中華人民共和國國家標準gb/t4789.27-2008規定鮮乳中林可霉素殘留的檢驗方法為嗜熱鏈球菌抑制法和嗜熱脂肪芽孢桿菌抑制法。文獻報道有酶聯免疫吸附法(elisa)、高效液相色譜法、膠體金免疫層析法等。嗜熱鏈球菌抑制法和嗜熱脂肪芽孢桿菌抑制法試驗價格低廉,但樣品前處理過程繁瑣,重現性差;高效液相色譜法、液相色譜串聯質譜法等,這類方法靈敏度高,特異性好,但是此類儀器沒有便攜性,價格昂貴,樣品前處理復雜;elisa方法靈敏度較高、快速、經濟,但在檢測實驗過程需多次洗板,重復性較差,試劑需低溫保存等,適用于實驗室大量樣本初篩,不適合現場快速檢測;膠體金免疫層析因快速、簡便且經濟實用,在食品檢測的大量樣本篩查中表現出較強的優勢,但只能用于定性檢測,而不能進行定量,篩選后的陽性樣本需送實驗室進行進一步定量分析。
技術實現要素:
本發明提供了一種基于背景熒光猝滅-免疫層析測定牛奶中林可霉素的方法,克服了上述現有技術之不足,其能有效解決現有鮮乳中林可霉素殘留的檢驗方法存在樣品前處理過程繁瑣、重現性差、不適合現場快速檢測和不能進行定量分析的問題。
本發明的技術方案是通過以下措施來實現的:一種基于背景熒光猝滅-免疫層析測定牛奶中林可霉素的方法,按下述步驟進行:第一步,將林可霉素標準曲線方程和名稱輸入二維碼制碼器,制成林可霉素二維碼,然后把林可霉素二維碼粘貼在林可霉素試紙條上的二維碼粘貼處,得到林可霉素檢測卡;第二步,取待檢測樣品200μl至固定有金標抗體的小試杯中,充分混勻后吸取100μl滴加至林可霉素檢測卡上的加樣孔內,室溫下層析10min;第三步,層析后將林可霉素檢測卡插入熒光免疫分析儀的插卡口,點擊測樣,熒光免疫分析儀的顯示屏上就會顯示出待檢測樣品名稱和待檢測樣品中林可霉素的濃度。
下面是對上述發明技術方案的進一步優化或/和改進:
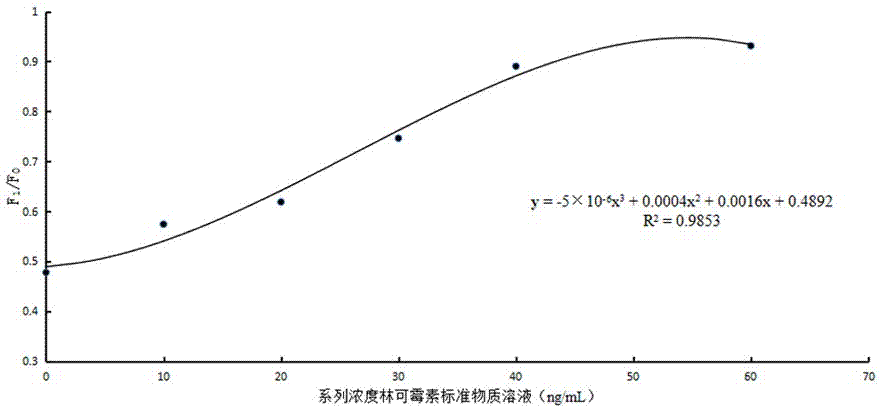
上述林可霉素標準曲線方程按下述方法得到:第一步,林可霉素儲備液的配置,取林可霉素標準物質,用pbs配成1μg/ml的林可霉素溶液,得到林可霉素儲備液;第二步,林可霉素系列濃度標準溶液的配置,將林可霉素儲備液用標準牛奶樣依次配成10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml的林可霉素系列溶液,得到林可霉素系列濃度標準溶液;第三步,取標準牛奶樣200μl、林可霉素系列濃度標準溶液各200μl至固定有金標抗體的小試杯中,充分混勻后吸取100μl滴加至林可霉素試紙條上的加樣孔內,室溫下層析10min;第四步,層析后將林可霉素試紙條插入熒光免疫分析儀的插卡口,點擊測樣,熒光免疫分析儀掃描林可霉素試紙條上的t線和c線,獲得樣品f1/f0的比值;第五步,以溶液中林可霉素的濃度為橫坐標,相對應的f1/f0為縱坐標,得到林可霉素標準曲線方程y=-5×10-6x3+0.0004x2+0.0016x+0.4892。
上述標準牛奶樣為經檢測不含有林可霉素的牛奶樣。
上述待檢測樣品為待檢測牛奶。
本發明測定牛奶中林可霉素的檢測限為0.088μg/kg,最優加樣量為100μl,最優層析時間為10min;本發明較現有方法靈敏度高、反應時間短、操作簡便,可實現牛奶中林可霉素現場快速定量檢測,為廣泛應用于食品安全領域奠定了基礎。
附圖說明
附圖1為現有林可霉素試紙條的背景熒光猝滅-免疫層析檢測示意圖。
附圖2為本發明林可霉素標準曲線。
附圖3為本發明林可霉素檢測卡和熒光免疫分析儀的立體結構示意圖。
具體實施方式
本發明不受下述實施例的限制,可根據本發明的技術方案與實際情況來確定具體的實施方式。
實施例1,該基于背景熒光猝滅-免疫層析測定牛奶中林可霉素的方法,按下述步驟進行:第一步,將林可霉素標準曲線方程和名稱輸入二維碼制碼器,制成林可霉素二維碼,然后把林可霉素二維碼粘貼在林可霉素試紙條上的二維碼粘貼處,得到林可霉素檢測卡;第二步,取待檢測樣品200μl至固定有金標抗體的小試杯中,充分混勻后吸取100μl滴加至林可霉素檢測卡上的加樣孔內,室溫下層析10min;第三步,層析后將林可霉素檢測卡插入熒光免疫分析儀的插卡口,點擊測樣,熒光免疫分析儀的顯示屏上就會顯示出待檢測樣品名稱和待檢測樣品中林可霉素的濃度。
實施例2,林可霉素標準曲線方程按下述方法得到:第一步,林可霉素儲備液的配置,取林可霉素標準物質,用pbs配成1μg/ml的林可霉素溶液,得到林可霉素儲備液;第二步,林可霉素系列濃度標準溶液的配置,將林可霉素儲備液用標準牛奶樣依次配成10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml的林可霉素系列溶液,得到林可霉素系列濃度標準溶液;第三步,取標準牛奶樣200μl、林可霉素系列濃度標準溶液各200μl至固定有金標抗體的小試杯中,充分混勻后吸取100μl滴加至林可霉素試紙條上的加樣孔內,室溫下層析10min;第四步,層析后將林可霉素試紙條插入熒光免疫分析儀的插卡口,點擊測樣,熒光免疫分析儀掃描林可霉素試紙條上的t線和c線,獲得樣品f1/f0的比值;第五步,以溶液中林可霉素的濃度為橫坐標,相對應的f1/f0為縱坐標,得到林可霉素標準曲線方程y=-5×10-6x3+0.0004x2+0.0016x+0.4892。
實施例3,作為上述實施例的優化,標準牛奶樣為經檢測不含有林可霉素的牛奶樣。
實施例4,作為上述實施例的優化,待檢測樣品為待檢測牛奶。
現有林可霉素試紙條的背景熒光猝滅-免疫層析檢測示意圖見圖1所示,圖1中,1.小試杯底部固定有膠體金標記的目標物抗體(金標抗體)和膠體金標記的羊抗鼠抗體,2.供試品溶液進行層析的樣品墊,3.包被有“目標物抗原-牛血清白蛋白(bsa)偶聯物”的測試線(t線),4.包被有“羊抗鼠抗原-牛血清白蛋白(bsa)偶聯物”控制線(c線),5.帶有背景熒光f0的硝酸纖維素膜;圖1中,底部固定有膠體金標記的目標物抗體(金標抗體)和膠體金標記的羊抗鼠抗體的小試杯,固定有熒光試劑的硝酸纖維素膜熒光區(可產生背景熒光f0),在熒光區包被有“目標物抗原-牛血清白蛋白偶聯物”的測試線(t線),包被有“羊抗鼠抗原-牛血清白蛋白偶聯物”的控制線(c線)。樣品檢測原理為:將一定量樣品溶液,加入固定有金標抗體小試杯中,混勻(樣品溶液中的待測目標物-林可霉素抗原與金標抗體特異性結合),吸取一定量的混勻溶液滴加至樣品墊上,通過毛細管作用進行層析。當混合溶液到達t線處,剩余的金標抗體與t線處的目標物-林可霉素抗原結合,形成抗原-金標抗體復合物,被截留在t線上,使背景熒光猝滅,以t線處熒光強度的測量值記為f1,熒光猝滅程度(f1/f0)與供試品中待測目標物含量有關。當供試品中目標物濃度大時,結合小試杯中金標抗體的量就多,小試杯中剩余的金標抗體與t線處“目標物抗原-牛血清白蛋白偶聯物”結合的就少,猝滅程度就弱,f1/f0的值就大。f1/f0隨待測物濃度增大而增大,零值樣本f1/f0值最小。為對試紙條進行質控,在具有背景熒光的硝酸纖維素膜上還固定了“羊抗鼠抗原-牛血清白蛋白偶聯物”(c線),用于對試紙條進行質控,當上述混合溶液繼續前行到達c線處,金標羊抗鼠抗體與c線處的“羊抗鼠抗原-牛血清白蛋白偶聯物”結合,使c線處的背景熒光發生猝滅。說明試紙條質量合格。
本發明試驗如下:
1.實驗部分
1.1儀器與材料
熒光免疫分析儀(zc2015-0797,上海鑫譜生物科技有限公司);
林可霉素標準物質(lin,10ppm,上海鑫譜生物科技有限公司,批號:20160911);林可霉素試紙條、固定有林可霉素金標抗體的小試杯(上海鑫譜生物科技有限公司,批號:20160926);
標準牛奶樣(經檢測沒有林可霉素,上海榮輝生物科技有限公司);
供試品,為了驗證背景熒光猝滅-免疫層析法和國標規定方法的差異,本實驗在標準牛奶樣中人為添加一定量的林可霉素標準物質,制成含林可霉素300ng/ml、220ng/ml和50ng/ml的供試品004、005、006。
1.2溶液的配制
林可霉素儲備液的制備:將林可霉素標準物質(10ppm),用pbs配成1μg/ml的溶液,得到林可霉素儲備液。
林可霉素系列濃度標準溶液:將1μg/ml的林可霉素儲備液,用標準牛奶樣配成10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml的林可霉素系列溶液,得到林可霉素系列濃度標準溶液。
2.方法與結果
2.1反應時間與加樣量的確定
2.1.1反應時間的選擇
取200μl標準牛奶樣,加到固定有金標抗體的小試杯中,混勻后吸120μl加入林可霉素試紙條上的加樣孔中,分別層析8min和10min,用熒光免疫分析儀檢測,記錄f1/f0的值見表1所示。
從表1可以看出,層析時間為8min時,rsd值為6.12%,層析時間為10min時,rsd值為4.30%;說明層析時間為10min時的rsd值小,所以選擇層析10min。
2.1.2加樣量的選擇
取三份標準牛奶樣,每份200μl,分別加到固定有金標抗體的小試杯中,混勻后依次從三個固定有金標抗體的小試杯中吸80μl、100μl、120μl分別加入三個林可霉素試紙條上的加樣孔中,層析10min,層析后將林可霉素試紙條插入熒光免疫分析儀的插卡口,點擊測樣,記錄f1/f0的值,見表2所示。
從表2可以看出,當加樣量為80μl、100μl和120μl時,rsd值依次為6.35%、1.41%、3.68%;說明當加樣量為100μl時,rsd值最小,所以選擇100μl加樣量。
2.2方法學驗證
2.2.1曲線方程與范圍
分別取標準牛奶樣200μl、1.2項下的10ng/ml的林可霉素系列濃度標準溶液200μl、20ng/ml的林可霉素系列濃度標準溶液200μl、30ng/ml的林可霉素系列濃度標準溶液200μl、40ng/ml的林可霉素系列濃度標準溶液200μl、60ng/ml的林可霉素系列濃度標準溶液200μl,分別加到固定有金標抗體的小試杯中,混勻后各吸100μl分別加入林可霉素試紙條上的加樣孔中,層析10min,用熒光免疫分析儀檢測,記錄f1/f0,見表3所示;以溶液中林可霉素的濃度為橫坐標,對應的f1/f0為縱坐標,進行回歸,得到林可霉素標準曲線方程為y=-5×10-6x3+0.0004x2+0.0016x+0.4892,林可霉素標準曲線見圖2所示;從表3和圖2可以看出,林可霉素在0.102ng/ml至60ng/ml之間呈良好的相關性,相關系數為r=0.9923。取標準牛奶樣200μl,加到固定有金標抗體的小試杯中,混勻后吸100μl加入林可霉素試紙條上的加樣孔中,層析10min,用熒光免疫分析儀檢測,記錄f1/f0,重復操作20次,計算20次的均值和標準差(sd),以均值+2sd計算檢出限為0.088ng/ml。
2.2.2精密度實驗
取10ng/ml、30ng/ml、40ng/ml三個濃度的林可霉素系列濃度標準溶液,各取200μl,加到固定有金標抗體的小試杯中,混勻后各吸100μl分別加入林可霉素試紙條上的加樣孔中,層析10min,用熒光免疫分析儀檢測,記錄f1/f0,見表4所示;從表4可以看出,10ng/ml、30ng/ml、40ng/ml三個濃度的林可霉素系列濃度標準溶液的f1/f0值的rsd依次為1.2%,0.6%,1.1%,精密度的rsd小于5%,符合要求。
2.2.3加標回收率
取3份標準牛奶樣分別置ep管中,每份1ml,依次在3份標準牛奶樣中加入林可霉素儲備液20μl、30μl和40μl,依次配成低、中和高三個濃度,每個濃度平行3份,各取200μl,加到固定有金標抗體的小試杯中,混勻后各吸100μl分別加入林可霉素試紙條上的加樣孔中,層析10min,用熒光免疫分析儀檢測,記錄各樣本中林可霉素的檢測濃度,見表5所示;從表5可以看出,標準牛奶樣中高、中、低林可霉素測定的平均加標回收率分別為103.4%,99.7%,98.5%,rsd為2.46%,rsd小于5%,符合要求。
2.2.4重復性試驗
取標準牛奶樣995μl于ep管中,再加入林可霉素儲備液5μl,混勻,配成5ng/ml的樣品。取200μl加到固定有金標抗體的小試杯中,混勻,再吸100μl加入林可霉素試紙條上的加樣孔中,層析10min,用熒光免疫分析儀檢測,記錄供試品中林可霉素檢測值的f1/f0,見表6所示;從表6可以看出,林可霉素重復性實驗中,f1/f0測定值的rsd為0.82%,濃度測定值的rsd為1.25%,rsd小于5%,符合要求。
2.2.5長期重復性實驗
取同一批次林可霉素試紙條、標準牛奶樣200μl和1.2項下的林可霉素系列濃度標準溶液各200μl,分別加到固定有金標抗體的小試杯中,混勻后各吸100μl分別加入林可霉素試紙條上的加樣孔中,層析10min,用熒光免疫分析儀檢測,每個月重復一次林可霉素標準曲線,連續做5個月,林可霉素長期重復性實驗考查測定結果見表7所示;從表7可以看出,5個月內,標準牛奶樣、林可霉素系列濃度標準溶液10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml,對應的rsd為依次為0.42%、0.35%、0.39%、0.27%、0.24%和0.31%;rsd小于5%,符合要求。
2.3二維碼的制作
以上經方法學驗證,林可霉素標準曲線方程符合要求,將獲得的林可霉素標準曲線方程和對應林可霉素名稱輸入二維碼制碼器,制成林可霉素二維碼,貼在林可霉素試紙條上,得到林可霉素檢測卡。
2.4樣品測定
分別取供試品004、005和006各200μl至固定有金標抗體的小試杯中,充分混勻后吸取100μl滴加至林可霉素檢測卡上的加樣孔內,室溫下層析10min;層析后將林可霉素檢測卡插入熒光免疫分析儀的插卡口,點擊測樣,熒光免疫分析儀先掃描林可霉素二維碼,獲得二維碼中儲存的林可霉素標準曲線方程,再依次掃描林可霉素檢測卡上的t線和c線,獲得樣品f1/f0的比值,熒光免疫分析儀中的simple1軟件將f1/f0的比值代入林可霉素標準曲線方程進行計算,計算后顯示屏將顯示待檢測樣品名稱和待檢測樣品的濃度。再分別取供試品004、005和006按國標(gb29685-2013)進行測定;采用spss17.0軟件,對本發明和國標法測定后測定值作t檢驗分析;供試品中林可霉素測定結果(
本發明應用的背景熒光猝滅-免疫層析法(backgroundfluorescencequenchingimmunochromatographicassay,bfqica)主要包括林可霉素檢測卡和熒光免疫分析儀,本發明林可霉素檢測卡和熒光免疫分析儀的立體結構示意圖見圖3所示;熒光免疫分析儀安裝有simple1軟件系統。
本發明基于背景熒光猝滅-免疫層析技術,建立檢測牛奶中林可霉素的方法學,本發明將林可霉素標準曲線方程和名稱輸入二維碼制碼器,制成林可霉素二維碼,然后把林可霉素二維碼粘貼在林可霉素試紙條上的二維碼粘貼處,得到林可霉素檢測卡;林可霉素檢測卡與熒光免疫分析儀配合使用,用于實際樣品的快速測定,與國標法比較沒有顯著性差異。
3.小結
本發明應用已研制的林可霉素檢測卡,建立了檢測牛奶中林可霉素的檢測方法。本發明測定牛奶中林可霉素的濃度范圍為0.102ng/ml至60.0ng/ml,最低檢測限為0.088ng/ml。本發明牛奶樣品中高、中、低林可霉素測定的平均加標回收率分別為103.4%,99.7%,98.5%,rsd為2.46%(n=9)。
用本發明測定牛奶中的林可霉素與國標方法(gb29685-2013)測定牛奶中林可霉素的方法相比,本發明是基于抗原、抗體的反應,所以專屬性強;本發明中的硝酸纖維素膜上標記有背景熒光,膠體金猝滅劑與抗體結合,硝酸纖維素膜上的t線處固定有對應的抗原,當液體在試紙條上流動,t線處抗原-抗體-膠體金結合,引起t線處背景熒光猝滅,猝滅的程度用f1/f0表示,進行定量分析,所以檢測靈敏度高。用本發明測定牛奶中林可霉素的檢測限是0.088μg/kg,國標方法(gb29685-2013)中的液質聯用測定牛奶中林可霉素的檢測限是8μg/kg;用本發明測定牛奶中的林可霉素,不需要樣品前處理,且本發明將檢測牛奶中林可霉素標準曲線的信息,儲存在林可霉素二維碼中,檢測人員不用現場做標曲,使檢測變的方便、快捷,每份樣本僅需10min。而國標方法(gb29685-2013)中的液質聯用測定牛奶中林可霉素不僅需要樣品前處理,還需要檢測人員現場做標曲,每份樣本的檢測需要55min;本發明與gica方法相比較,gica只能進行定性分析,適合大量樣本的最初篩選,篩選出的樣本還需要采用定量的方法再檢測。而本發明不僅可以根據t線處抗原-抗體-膠體金結合引起的顏色變化進行定性分析,還可進行定量分析。
綜上所述,本發明測定牛奶中林可霉素的檢測限為0.088μg/kg,最優加樣量為100μl,最優層析時間為10min;本發明較現有方法靈敏度高、反應時間短、操作簡便,可實現牛奶中林可霉素現場快速定量檢測,為廣泛應用于食品安全領域奠定了基礎。
以上技術特征構成了本發明的實施例,其具有較強的適應性和實施效果,可根據實際需要增減非必要的技術特征,來滿足不同情況的需求。
表1不同反應時間的選擇
表2不同加樣量的選擇
表3牛奶中林可霉素標準曲線數據
表4精密度試驗(n=6)
表5牛奶中林可霉素加標回收率
表6林可霉素的重復性試驗
表7林可霉素長期重復性實驗考查測定結果
表8供試品中林可霉素測定結果(
- 還沒有人留言評論。精彩留言會獲得點贊!
- 基于量子點的CA15?3免疫層析試紙條的制備方法與制造工藝
- 肌紅蛋白熒光免疫層析試紙條用活化熒光乳膠微球及應用的制造方法與工藝
- 鐵蛋白熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 全程C?反應蛋白熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 一種微流控芯片上基于熒光量子點磁性富集并分離結核分枝桿菌TB的方法及裝置與制造工藝
- 25?羥基維生素D熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 25?羥基維生素D3熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 降鈣素原熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 一種改變量子點熒光色的方法與制造工藝
- 一種基于熒光免疫層析技術的定量檢測計算方法與制造工藝