以TMB為顯色劑的Ag+可視化檢測方法與流程
本發明屬于分析化學領域,具體涉及一種以TMB為顯色劑的Ag+可視化檢測方法。
背景技術:
銀作為一種貴金屬,因其極好的光學、電學和殺菌特性而被廣泛應用于能源、攝影、醫藥等各個行業,而實際應用中必然會產生含銀的廢液,這些廢液被排放到水體環境中后會對水生生物和人類健康造成潛在的威脅。有報道顯示,銀雖然是人體所需要的重要微量元素之一,但人體內Ag+過量后會在人大腦、肝臟、腎臟、肺、骨骼等處沉積,從而對身體產生傷害作用,尤其傷害人的眼睛和內臟。因此,開發高效方便的分析方法用于銀離子高靈敏度、高選擇性檢測,具有重要的現實意義。
目前,對痕量Ag+的檢測主要依賴于原子吸收光譜(AAS)、電感耦合等離子體質譜(ICP-MS)、X-射線熒光、電化學方法(CV)等。這些方法雖然檢測精密度高,但其所用儀器昂貴、運行費用高,對檢測條件要求較高,且檢測時需進行萃取、濃縮富集或抗干擾等復雜的前處理過程,使得整個檢測過程費時、費力,不適用于大規模現場快速檢測。
技術實現要素:
本發明的目的是為了解決上述檢測方法中的技術問題,提供一種成本低廉、操作方便、以TMB為顯色劑的Ag+可視化檢測方法,以實現Ag+的大規模現場快速檢測。
本發明檢測方法的原理如下:以TMB為顯色底物,在檸檬酸-Na2HPO4緩沖液存在的條件下,將Hg2+配成痕定量的溶液加入體系中,由于檸檬酸鹽的弱還原性,Hg2+被還原成Hg0,生成包裹檸檬酸鹽的Hg NPs;繼續往溶液中加入配制好的Ag+溶液,包裹有檸檬酸鹽的Hg NPs可以將Ag+還原成Ag NPs,生成Hg-Ag 合金;運用Hg-Ag 合金的類過氧化物酶活性催化H2O2與TMB發生反應,當TMB與·OH發生作用時,·OH奪取TMB中的電子,使反應體系由無色變為藍色,TMB失去一個電子的產物在652 nm處有最大吸收峰出現,從而高靈敏度、高選擇性的間接檢測Ag+。
本發明以TMB為顯色劑的Ag+可視化檢測方法,以 TMB為顯色劑,在檸檬酸-Na2HPO4緩沖液中,利用不同濃度Ag+與Hg2+生成Hg-Ag 合金催化H2O2氧化TMB得到不同深度藍色和吸光度的反應液,實現對Ag+的可視化半定量及定量檢測。
上述檢測方法按以下步驟進行:
(1)建立Ag+的可視化半定量或定量檢測標準:
利用不同濃度Ag+與Hg2+生成Hg-Ag 合金催化H2O2氧化TMB得到不同深度藍色的反應液,記錄顏色比較圖像;采用可見光譜儀掃描反應液500-750nm范圍內的吸收光譜,測定不同濃度Ag+在652 nm下的吸光度,得到的吸光度值(A)與銀離子濃度(C,μmol/L)之間的線性方程為:A=0.01197C+0.00627,R2=0.9921。
(2)檢測樣品溶液中的Ag+:
以體積計,取200份檸檬酸-Na2HPO4緩沖液于試管中,分別加入2份Hg2+溶液,2份樣品溶液,2份H2O2溶液,最后加入1份TMB,記錄反應液的顏色,然后與步驟(1)中顏色比較圖像對照,確定Ag+濃度范圍;或者得到反應液在652 nm下的吸光度值,根據線性方程得到待測樣品溶液中Ag+的濃度。
由于TMB難溶于水,易溶于丙酮、乙醚、DMSO、DMF等有機試劑,出于安全環保、經濟實惠的考慮,優選上述步驟(2)中TMB溶液的溶劑為DMF。
通過單因素優化實驗,得到反應液的最佳pH值為4,反應溫度為22℃,檸檬酸-Na2HPO4緩沖液濃度為0.2 mol/L,Hg2+溶液的濃度為2.5 mmol/L,H2O2溶液的濃度為0.4 mol/L,TMB溶液的濃度為0.1 mmol/L。
該方法Ag+檢出限為1×10-4μmol/L,線性范圍為1×10-3 - 40μmol/L。
本發明采用具有大的共軛體系,是良好電子供體的TMB的顯色反應對樣品溶液中Ag+進行定量或可視化半定量檢測,整個過程不需要對樣品進行復雜處理,不會對樣品造成損傷,所需儀器和操作方法簡單,且具有檢測靈敏度高、檢出限低的優點,能夠對樣品溶液進行實時檢測。
附圖說明
圖1為本發明反應液在500-750nm范圍內的紫外可見光譜圖。
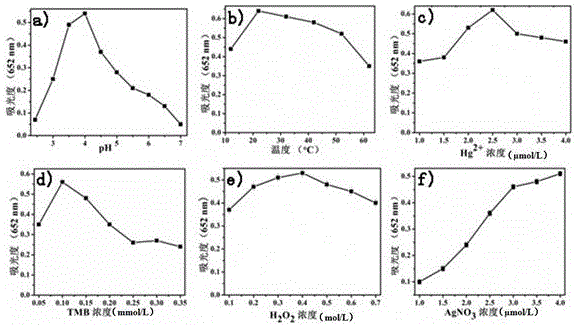
圖2為本發明檢測方法的反應條件優化結果,其中:(a)為pH值優化結果;(b)為反應溫度優化結果;(c)為Hg2+濃度優化結果;(d)為TMB濃度優化結果;(e)為H2O2濃度優化結果;(f)為Ag+濃度優化結果。
圖3為本發明Ag+檢測方法對16種金屬離子的選擇性實驗結果。
圖4為本發明Ag+檢測方法對16種金屬離子的抗干擾實驗結果。
圖5為本發明Ag+檢測方法的線性圖。
具體實施方式
為了更好地理解本發明,現結合附圖和具體實施方式對本發明的檢測方法和優化過程作進一步說明。
1、反應液的可見吸收光譜
取兩只相同的石英比色皿,一只中依次加入檸檬酸- Na2HPO4緩沖液(0.2mol/L,2 mL),Hg2+(1×10-4 mol/L,20μL), Ag+ (2.5×10-4 mol/L,20μL),H2O2 (0.1 mol/L,20μL) 和TMB(1 mmol/L,20μL),另一只中不加Ag+作為對照,采用可見光譜儀掃描二者在500-750nm范圍內的吸收光譜,結果如圖1所示。
從圖1中可以看出,依序添加Ag+的反應液在652nm處出現最大吸收峰,而未添加Ag+的對照反應液在500-750nm范圍內沒有紫外吸收,因此,本發明以652nm作為Ag+定量檢測的最大吸收波長。
2、本發明檢測方法反應條件的優化:
(1)pH值的優化:配制pH分別為2.44、3、3.5、4、4.5、5、5.5、6、6.5、7,濃度為0.2 mol/L的檸檬酸- Na2HPO4緩沖液,依次加入Hg2+(1×10-4 mol/L,20μL),Ag+(1.0×10-5 mol/L,20μL),H2O2(0.1 mol/L,20μL)和TMB(1 mmol//L,20μL)。用不同pH值的檸檬酸- Na2HPO4緩沖液調節反應液的酸堿度,在35℃的恒溫條件下,測定反應液652nm處的吸光度隨pH值的變化,結果如圖2(a)所示,圖2(a)顯示pH值為4時反應液吸光度最大,故選擇最佳pH值為4。
(2)反應溫度的優化:于2mL、 pH值為4的檸檬酸- Na2HPO4緩沖液中,依次加入Hg2+(1×10-4 mol/L,20μL),Ag+(1.0×10-5 mol/L,20μL),H2O2(0.1 mol/L,20μL)和TMB(1mmol/L,20μL),于12-62℃(12℃,22℃,32℃,42℃,52℃,62℃)的溫度下測定反應液652nm處的吸光度結果如圖2(b)所示,圖2(b)顯示溫度為22℃時反應液吸光度最大,故選擇最佳溫度為22℃。
(3)Hg2+濃度的優化:在pH值為4、溫度為22℃的條件下,于2mL濃度為0.2 mol/L的檸檬酸- Na2HPO4緩沖液中依次加入20μL不同濃度(1.0,1.5,2.0,2.5,3.0,3.5,4.0 μmol/L)的Hg2+,Ag+(1.0×10-5 mol/L,20μL),H2O2(0.1 mol/L,20μL)和TMB(1 mM,20μL),測定反應液652nm處的吸光度結果如圖2(c)所示,圖2(c)顯示Hg2+濃度為2.5 mmol/L時反應液吸光度最大,故選擇最佳Hg2+濃度為2.5 mmol/L。
(4)TMB濃度的優化:在pH值為4、溫度為22℃的條件下,于2mL濃度為0.2 mol/L的檸檬酸- Na2HPO4緩沖液中依次加入Hg2+(2.5 mM,20μL),Ag+(1.0×10-5 mol/L,20μL),H2O2(0.1 mol/L,20μL)和20μL不同濃度(0.05,0.10,0.15,0.20,0.25,0.30,0.35 mmol/L)的TMB,測定反應液652nm處的吸光度結果如圖2(d)所示,圖2(d)顯示TMB濃度為0.1 mmol/L時反應液吸光度最大,故選擇最佳TMB濃度為0.1 mmol/L。
(5)H2O2濃度的優化:在pH值為4、溫度為22 ℃的條件下,于2mL濃度為0.2 mol/L的檸檬酸- Na2HPO4緩沖液中依次加入Hg2+(2.5 mM,20μL),Ag+(1.0×10-5 mol/L,20μL),20μL不同濃度(0.1,0.2,0.3,0.4,0.5,0.6,0.7 mol/L)的H2O2和TMB(0.1 mmol/L,20μL),測定反應液652nm處的吸光度結果如圖2(e)所示,圖2(e)顯示H2O2濃度為0.4 mol/L時反應液吸光度最大,故選擇最佳H2O2濃度為0.4 mol/L。
(6)Ag+濃度的優化:在pH為值4、溫度為22℃的條件下,于2mL濃度為0.2mol/L的檸檬酸- Na2HPO4緩沖液中依次加入Hg2+(2.5 mM,20μL),20μL不同濃度(1.0,1.5,2.0,2.5,3.0,3.5,4.0 μmol/L)的Ag+,H2O2(0.4 M,20μL)和TMB(0.1 mM,20μL),測定反應液652nm處的吸光度結果如圖2(f)所示,圖2(f)顯示Ag+濃度為4.0 μmol/L時反應液吸光度最大,故選擇最佳Ag+濃度為4.0μmol/L。
綜上,本發明檢測方法的最佳反應條件為:反應液的pH值為4,反應溫度為22℃,檸檬酸-Na2HPO4緩沖液濃度為0.2 mol/L,Hg2+溶液濃度為2.5mmol/L,H2O2溶液濃度為0.4mol/L,TMB溶液濃度為0.1mmol/L。
實際檢測過程中由于含Ag+的待測樣品來源不一,成分復雜,因此,為了驗證本發明方法對含Ag+樣品溶液的普適性,下面進行Ag+的選擇性實驗和抗干擾實驗。
3、選擇性實驗
分別制備2 mmol/L的Na+,K+, Mg2+,Ca2+,Mn2+,Co2+,Ni2+,Hg2+,Zn2+,Pb2+,Cd2+,Cu2+,Fe2+,Al3+,Cr3+,Fe3+離子溶液;在石英比色皿中加入檸檬酸-磷酸氫二鈉緩沖溶液(25 mmol/L,2 mL),接著依次加入Hg2+(1×10-4 mol/L,20μL),20μL(1.0×10-3 mol/L)上述金屬離子,Ag+(4.0μmol/L,20μL),H2O2(0.1 mol/L,20μL)和TMB(1 m mol/L,20μL),反應5 min后分別測定反應液652nm處的吸光度如圖3所示。從圖3中可以看出,本發明方法對Ag+具有很好的選擇性。
4、抗干擾實驗
分別制備與選擇性實驗中相同的16種金屬離子溶液,在石英比色皿中依次加入檸檬酸-磷酸氫二鈉緩沖溶液(25 mmol/L,2 mL),接著依次加入Hg2+(1×10-4 mol/L,20μL),20μL 干擾離子中的一種或者20μL 干擾離子中的一種和Ag+(4.0μmol/L,20μL),H2O2(0.1 mol/L,20μL)和TMB(1 mM,20μL),反應5 min后分別測定反應液652nm處的吸光度如圖4所示。從圖4中可以看出,未加Ag+時反應液在652nm處有較弱的吸收,而加入Ag+后反應液在652nm處具有很強的吸收,表明采用本發明方法檢測Ag+時對其他16種金屬離子具有很好的抗干擾性。
5、本發明的具體檢測過程:
(1)建立Ag+的可視化半定量或定量檢測標準:
在石英比色皿中加入檸檬酸-磷酸氫二鈉緩沖溶液(25 mmol/L,2 mL),接著依次加入Hg2+(1×10-4 mol/L,20μL), Ag+(1×10-3,2,5,7,10,13,15,17,20,23,25,28,30,35,37和40 μmol/L,20μL),H2O2(0.1 mol/L,20μL)和TMB(1 m mol/L,20μL),分別記錄顏色比較圖像,并測定反應液652nm處的吸光度,以吸光度(A)為縱坐標,銀離子濃度(C,μmol/L)為橫坐標得到線性回歸方程如圖5所示,線性方程為:A=0.01197C+0.00627,R2=0.9921,線性范圍為:1×10-3 - 40μmol/L。
在最佳實驗條件下,以未加入Ag+的反應液為空白溶液,按上述實驗方法平行測定16組空白溶液在652 nm下的吸光度值,按3б/k計算(б為16次空白溶液的標準偏差,k為線性方程的斜率)得本發明方法檢測限為1×10-4μmol/L。
(2)檢測樣品溶液中的Ag+:
按照(1)中方法對3個含Ag+樣品溶液進行檢測,記錄反應液顏色,然后與(1)中顏色比較圖像對照,確定Ag+濃度范圍,從而對含Ag+樣品溶液進行可視化半定量檢測;若想進一步實現定量檢測,則測定3個含Ag+樣品溶液在652 nm下的吸光度值分別為0.128,0.251和0.457,根據線性方程A=0.01197C+0.00627得到待測樣品溶液中Ag+的濃度分別為10 μmol/L,20 μmol/L和37 μmol/L 。
另外,若樣品溶液的濃度超出本發明方法的檢測范圍,可對樣品溶液進行一定程度的稀釋后進行檢測,然后根據稀釋倍數反推出樣品溶液中Ag+的濃度。
- 還沒有人留言評論。精彩留言會獲得點贊!