一種基于高內涵技術定量分析焦油致細胞DNA損傷的方法與流程
本發明屬于dna損傷體外檢測技術領域,更具體而言,本發明涉及焦油致細胞dna損傷的體外定量分析方法。
背景技術:
卷煙煙氣可按照物質的狀態分成兩相,一種為氣相,一種為粒相,粒相物質即為焦油。卷煙焦油中含有多種有毒物質,如超氧陰離子o·-,過氧化氫等活性氧類物質,醛類,苯并芘等。焦油可以誘發多種癌癥和呼吸道疾病,其中的活性自由基和有毒物質可以誘導dna產生氧化性損傷、dna鏈斷裂、微核、基因突變等。所以,準確檢測焦油對細胞dna的損傷對于焦油的遺傳毒性和危害性評價具有重要的意義。
dna雙鏈斷裂是dna最嚴重的一種損傷形式,如果這種損傷不能被正確或者及時修復就可能會導致染色體畸變或者細胞凋亡等。作為dna雙鏈斷裂的一種生物標志物,磷酸化組蛋白γh2ax已經被廣泛地應用于臨床醫藥學、放射學及毒理學等研究方面。包括很多單體化合物和混合物通過γh2ax實驗對其遺傳毒性進行了測定和評價。例如,tanaka等利用γh2ax實驗對卷煙煙氣冷凝物的遺傳毒性進行了檢測和評價;smart等采用γh2ax實驗對依托泊苷、米托蒽醌及甲基亞硝脲的dna雙鏈斷裂的劑量-效應關系進行了研究。該實驗因其靈敏性高、結合其他儀器檢測技術可以進行大規模分析檢測,擁有其他遺傳毒性檢測技術并不具備的多種優點,目前已經被廣泛地應用于化合物和有毒物質的遺傳毒性篩選和評價。
目前對γh2ax進行分析檢測的主要方法有流式細胞儀、elisa(酶聯免疫吸附試驗)、westernblot(蛋白質印跡)、顯微鏡技術等。流式細胞儀和westernblot操作繁瑣,檢測前需要將貼壁細胞酶解成單細胞懸液,破壞了細胞的結構和功能完整性,且檢測通量較低。elisa不能提供細胞內熒光焦點的分布情況且需要額外添加其他檢測蛋白對結果進行校正,而顯微鏡技術的檢測通量低,且人為計數的誤差較大。
技術實現要素:
針對上述問題,本發明的目的是提供一種無需破壞細胞、簡單、有效且靈敏度高的焦油致dna損傷的定量分析方法,該方法的檢測結果準確并且可視化,以克服現有技術的缺陷。
本發明的目的通過將高內涵技術和γh2ax的定量分析相結合而實現。具體而言,本發明的目的是通過以下技術方案來實現的:
一種基于高內涵技術定量分析焦油致細胞dna損傷的方法,所述方法包括以下步驟:
1)細胞培養:將細胞接種在細胞培養液中進行細胞培養;
2)細胞染毒:吸棄所述細胞培養液,加入細胞染毒液繼續培養,所述細胞染毒液包含焦油和細胞培養液;
3)免疫熒光標記:吸棄所述細胞染毒液,進行細胞中γh2ax的免疫熒光標記與細胞核的dapi染色;
4)高內涵技術定量分析:分別進行所述細胞的細胞核和γh2ax的熒光測定,以所識別的有效細胞的有效細胞核內檢測到的平均熒光強度來表征γh2ax的含量。
優選地,所述步驟1)中,所述細胞為貼壁生長細胞;更優選地,接種時,所述細胞處于對數生長期,以單細胞懸液接種于細胞培養液中;
更優選地,細胞接種后將細胞在細胞培養液中于37℃,5%co2條件下培養24h。
優選地,所述步驟2)中,所述焦油通過以下方法制備:標準卷煙樣品于溫度(22±1)℃和相對濕度60%±3%下平衡48-72后,抽吸該卷煙樣品,收集總粒相物,然后加入dmso(二甲基亞砜)配制成濃度為8-100mg/ml的煙氣粒相物溶液(焦油),-80℃下保存備用。根據本發明的具體實施方式,所述標準卷煙樣品為3r4f。
優選地,所述細胞染毒液中焦油的濃度為0-500μg/ml,優選>0且≤500μg/ml,更優選為3.91-500μg/ml;
根據本發明的具體實施方式,所述細胞染毒液中焦油的濃度可以是0、3.91、7.81、15.63、31.25、62.5、125、250或500μg/ml。
優選地,在所述細胞染毒液中培養細胞1-24h、優選24h。
優選地,所述步驟3)包括:
3-1)吸棄所述細胞染毒液,洗滌細胞,加入多聚甲醛進行細胞固定;
3-2)洗滌細胞,然后加入triton-100x以使細胞通透;
3-3)洗滌細胞,然后加入血清白蛋白封閉,之后加入一抗即抗γh2ax抗體進行孵育;
3-4)洗滌細胞,然后加入免疫熒光標記的二抗進行孵育;
3-5)洗滌細胞,加入dapi(4',6-二脒基-2-苯基吲哚)進行染色;
3-6)洗滌細胞,保存。
優選地,所述步驟4)中,所述細胞的細胞核和γh2ax的熒光測定分別在兩組不同的激發波長和發射波長下進行;
優選地,所述步驟3-4)中,免疫熒光標記的二抗為alexafluor488標記的二抗,并且所述步驟4)中,在通道一中以激發波長358nm和發射波長461nm進行細胞核的熒光測定,在通道二中以激發波長495nm和發射波長519nm進行γh2ax的熒光測定,以獲得通道一所識別的有效細胞的有效細胞核內通道二所檢測的平均熒光強度,由此表征γh2ax的含量;
更優選地,在兩個通道中,測量倍數為200倍,每孔分析和測定9個視野。
根據本發明的具體實施方式,步驟4)采用高內涵細胞分析系統進行,例如購自thermoscientific的型號為arrayscanvti600的高內涵細胞分析系統。
任選地,本發明的方法還包括,設置在步驟3-3)中沒有加入一抗、僅在步驟3-4)中加入二抗的空白對照組,從而在步驟4)中得到由非特異吸附引起的空白信號,由此從檢測到的熒光測定信號中扣除空白信號。
本發明的方法還可包括劑量-效應曲線的繪制。即,通過在步驟2)中設置多種包含不同濃度的焦油的細胞染毒液,進行所述方法,最后根據γh2ax的平均熒光強度和焦油的濃度繪制劑量-效應曲線。
或者,本發明的方法還可包括時間-效應曲線的繪制。即,通過在步驟2)中將細胞在包含相同濃度的焦油的細胞染毒液中培養不同時間,進行所述方法,最后根據γh2ax的平均熒光強度和培養時間繪制時間-效應曲線。
根據本發明的具體實施方式,當細胞為人肺癌細胞株a549時,可以如下進行本發明的方法:
1)細胞培養:采用含10%fbs和2mmol/ll-谷氨酰胺的rpmi-1640培養液于37℃、5%co2條件下在培養箱中培養人肺癌細胞株a549,當細胞匯合率達到70-80%時,采用0.25%的胰蛋白酶進行消化后獲得單細胞懸液,然后以每孔100μl濃度為105個細胞/ml的接種量接種于96孔細胞培養板,在含10%fbs和2mmol/ll-谷氨酰胺的rpmi-1640培養液中于37℃,5%co2條件下培養24h。
2)細胞染毒:吸棄培養24h后的細胞培養液,加入細胞染毒液繼續培養,所述細胞染毒液為分別包含0、3.91、7.81、15.63、31.25、62.5、125、250及500μg/ml焦油的步驟1)中的細胞培養液。濃度組至少設置兩組空白對照,空白對照組僅添加含10%fbs和2mmol/ll-谷氨酰胺的rpmi-1640培養液,于37℃,5%co2的條件下培養24h。
3)免疫熒光標記:
3-1)吸棄細胞染毒液,每孔加入100μlpbs(磷酸鹽緩沖液,ph7.2~7.4;全文同)洗滌細胞兩次,每次至少5min;然后每孔加入50μl4%的多聚甲醛溶液在室溫下固定15min;
3-2)固定好的細胞再用pbs洗滌兩次,每次至少5min;然后加入50μl0.5%的triton-100x溶液(在pbs中)于室溫下通透15min;
3-3)通透后的細胞再用pbs洗滌兩次,每次至少5min;然后每孔加入3%bsa封閉液(在pbs中)于37℃下封閉1h,之后加入50μl含有小鼠抗人γh2ax抗體溶液(1:200,v/v),一組空白孔中僅加入50μl1%bsa作為陰性對照孔,另一組空白孔加入50μl含有小鼠抗人γh2ax抗體溶液作為空白對照孔,孵育條件為:37℃下恒溫孵育2h或者4℃過夜;
3-4)一抗孵育后的細胞再用pbs洗滌三次,每次至少5min;然后每孔加入50μlalexafluro488標記的山羊抗小鼠抗體溶液(1:200,v/v)于37℃下避光孵育2h;
3-5)二抗孵育后的細胞再用pbs洗滌三次,每次至少5min;然后加入50μl1μg/ml的dapi(在pbs中)在室溫下染核10min;
3-6)pbs洗滌三次后,每孔加入100μlpbs,4℃避光保存,待測。
4)高內涵技術定量分析:通道一(細胞核熒光測定)設置激發波長和發射波長分別為358nm和461nm,通道二(目標物γh2ax的熒光測定)設置激發波長和發射波長分別為495nm和519nm,測量倍數為200,每孔分析和測定9個視野,以通道一所識別的有效細胞的有效細胞核內通道二所檢測的平均熒光強度表征γh2ax的含量。
5)數據處理:設置在步驟3-3)中沒有加入一抗、僅在步驟3-4)中加入二抗的空白對照組,在步驟4)中所檢測信號即為由非特異吸附引起的空白信號,從所有樣品測試孔的檢測信號中扣除空白信號;最后根據目標物γh2ax的熒光強度和焦油的濃度繪制劑量-效應曲線。
參見圖1,本發明提供了一種基于高內涵技術來定量分析焦油致細胞dna損傷的方法,克服了現有焦油體外染毒和dna損傷檢測方法的不足。具體而言,本發明提供了一種評估染毒毒物為焦油時所導致的dna雙鏈斷裂情況的方法,其中磷酸化組蛋白γh2ax作為焦油誘導的dna雙鏈斷裂的生物標志物,并且采用高內涵技術對γh2ax進行檢測,提高了檢測效率和靈敏度。在本發明的方法中,細胞在暴露焦油后,通過細胞免疫熒光染色γh2ax和高內涵自動成像與分析實現了細胞樣本的直接、高通量檢測。
與現有技術相比,本發明的方法還具有如下優良效果:
1)本發明的方法可以在細胞培養板中進行,例如96孔板,因此所需細胞量和樣品量少,可同時對96個樣本進行檢測,檢測通量更高;
2)檢測前無需破壞細胞,也無需酶解制備單細胞懸液或提取蛋白,所以樣本處理更為簡單和快捷;
3)高內涵技術具有高分辨率的成像獲取功能,因此γh2ax在細胞核內的分布可直接觀測,且圖像資料也便于存儲以備再分析;
4)通過細胞核識別,可對每個細胞核內熒光標記的γh2ax進行定量分析,所以檢測結果更為靈敏和準確。
附圖說明
以下,結合附圖來詳細說明本發明的實施方案,其中:
圖1示出了本發明方法的流程圖。
圖2示出了焦油誘導a549細胞產生γh2ax的劑量-效應曲線,其中細胞染毒液中沒有添加代謝活化系統大鼠肝s9。
圖3示出了焦油誘導a549細胞產生γh2ax的劑量-效應曲線,其中細胞染毒液中添加代謝活化系統大鼠肝s9。
圖4示出了焦油誘導a549細胞產生γh2ax的時間-效應曲線。
具體實施方式
以下參照具體的實施例來說明本發明。本領域技術人員能夠理解,這些實施例僅用于說明本發明,其不以任何方式限制本發明的范圍。
下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的藥品原料、試劑材料等,如無特殊說明,均為市售購買產品。
一抗:小鼠抗人γh2ax抗體,購自biolegend,貨號613402;
使用時配制成溶液:取100μl小鼠抗人γh2ax抗體加入1%的bsa溶液中,1:200(v/v)稀釋,充分混勻。
二抗:alexafluro488標記的山羊抗小鼠抗體,購自武漢珈源量子點公司,貨號ym002;
使用時配制成溶液:取100μlalexafluro488標記的山羊抗小鼠抗體加入pbs溶液中,1:200(v/v)稀釋,充分混勻。
大鼠肝s9溶液:購自moltox,貨號11-101.1。
使用時配制成10%s9混合物:由4體積溶液a、60體積溶液b、16體積溶液c、10體積溶液d與10體積大鼠肝s9溶液混合而成,其中溶液a含有0.2mol/l的mgcl2和0.825mol/l的kcl;溶液b含有0.176mol/l的na2h2po4和0.024mol/l的nah2po4;溶液c含有0.025mol/l的nadp。溶液d含有0.05mol/l的葡萄糖-6-磷酸鹽;溶液a-d均采用去離子水配制。
焦油的制備:標準卷煙樣品3r4f于溫度(22±1)℃和相對濕度60%±3%下平衡48h后,再用轉盤式吸煙機抽吸卷煙,采用劍橋濾片收集總粒相物,然后加入一定量的dmso(二甲基亞砜)配制成濃度為100mg/ml的煙氣粒相物溶液(焦油),-80℃下保存備用。
高內涵細胞分析系統,購自thermoscientific,型號arrayscanvti600。
實施例1
在細胞染毒液中沒有添加代謝活化系統大鼠肝s9時,測定焦油暴露24h后誘導的γh2ax。
收集處于對數生長期的a549細胞,以每孔10000個細胞種植于96孔板,在含10%fbs和2mmol/ll-谷氨酰胺的rpmi-1640培養液中于37℃,5%co2培養箱孵育24h。
吸棄培養24h后的細胞培養液,用分別含有0、3.91、7.81、15.63、31.25、62.5、125、250及500μg/ml焦油的細胞培養液(同樣是含10%fbs和2mmol/ll-谷氨酰胺的rpmi-1640培養液)作為細胞染毒液,繼續培養細胞24h。
染毒結束后吸棄細胞染毒液,每孔加入100μlpbs洗滌兩次,每次至少5min;然后每孔加入50μl4%的多聚甲醛溶液在室溫下固定15min;固定好的細胞用pbs緩沖液洗滌兩次,每次至少5min;然后每孔加入50μl0.5%的triton-100x溶液室溫下通透15min;通透后的細胞用pbs洗滌兩次,每次至少5min;然后每孔加入3%bsa封閉液(在pbs中)于37℃下封閉1h,之后每個樣品孔加入50μl含有小鼠抗人γh2ax抗體溶液(1:200,v/v),一組空白孔中僅加入50μl1%bsa作為陰性對照孔,另一組空白孔加入50μl含有小鼠抗人γh2ax抗體溶液作為空白對照孔。孵育條件為:37℃下恒溫孵育2h或者4℃過夜;一抗孵育后的細胞用pbs洗滌三次,每次至少5min;然后每孔加入50μlalexafluro488標記的山羊抗小鼠抗體溶液(1:200,v/v)于37℃下避光孵育2h;二抗孵育后的細胞再用pbs洗滌三次,每次至少5min;然后每孔加入50μl1μg/ml的dapi(在pbs中)在室溫下避光染核10min;pbs洗滌三次后,每孔加入100μlpbs,4℃避光保存。
自動聚焦后,設置高內涵細胞分析系統的通道一(細胞核熒光測定)的激發波長和發射波長分別為358nm和461nm,設置通道二(目標物γh2ax的熒光測定)的激發波長和發射波長分別為495nm和519nm,測量倍數為200倍,每孔分析和測定9個視野,γh2ax以通道一所識別的有效細胞的有效細胞核內通道二所測定的平均熒光強度進行表征。
試驗中設置空白對照組,即沒有加入一抗,僅加入熒光標記的二抗抗體,所檢測信號即為由非特異吸附引起的空白信號;所有樣品測試孔的檢測信號應扣除空白信號;最后根據目標物γh2ax的熒光強度和焦油的濃度繪制劑量-效應曲線。
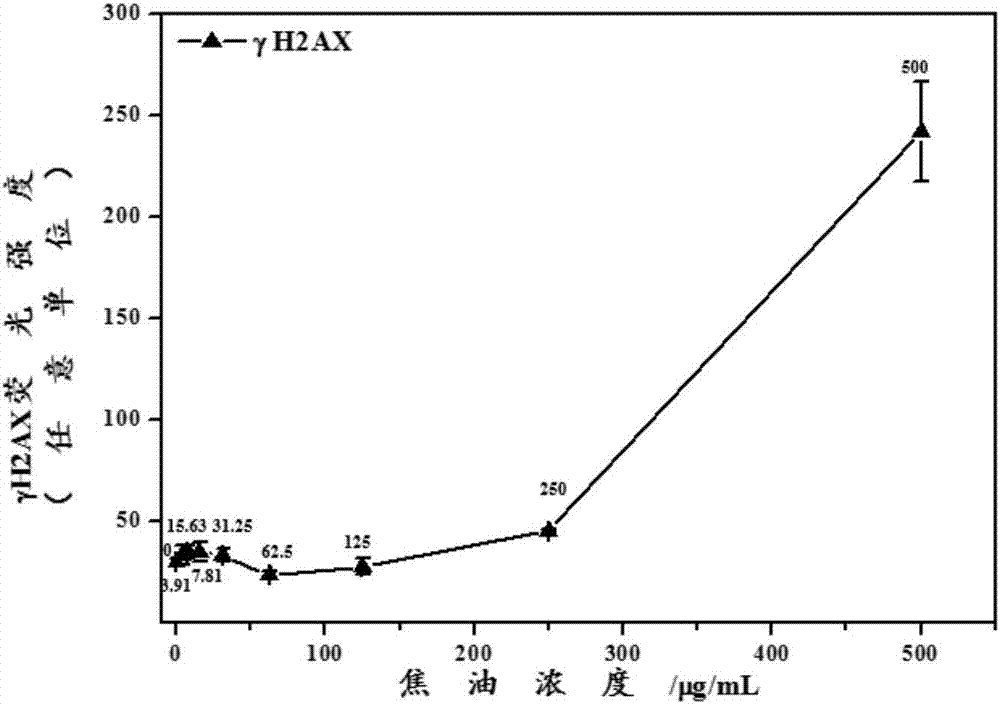
圖2所示為不同濃度的焦油在染毒24h后誘導a549細胞產生的γh2ax的劑量-效應關系曲線。由圖可知,隨著焦油濃度的升高,a549細胞產生的γh2ax逐漸升高,具有明顯的劑量-效應關系。當焦油染毒濃度為250μg/ml時,細胞內產生的γh2ax超過正常組(即焦油濃度為0時)的1.5倍。
實施例2
在細胞染毒液中添加代謝活化系統大鼠肝s9時,測定焦油暴露24h后誘導的γh2ax。
實驗過程按照實施例1所述進行,唯一的區別是,細胞染毒液除包含細胞培養液與焦油之外,與10%s9混合物混合,使得細胞染毒液中含有1%s9混合物。
圖3所示為細胞染毒液中添加1%s9后,不同濃度的焦油在染毒24h后誘導a549細胞產生的γh2ax的劑量-效應關系曲線。如圖可知,隨著染毒濃度的增大,細胞內產生的γh2ax不斷逐漸升高,呈現出顯著的劑量-效應關系。當焦油的濃度為250μg/ml時,細胞內產生的γh2ax超過正常組的1.5倍。
細胞染毒液中添加s9可以增強焦油在體外的代謝轉化,因此添加體外代謝活化系統s9可以避免體外測試中由于細胞代謝能力的不足而導致的測試結果為假陰性的可能。因此,通過添加和不添加s9可以更準確地了解焦油在體外對細胞dna損傷的誘導,并由此證明了本發明的方法是客觀、可用的。
實施例3
在細胞染毒液中沒有添加代謝活化系統大鼠肝s9時,測定250μg/ml焦油分別暴露1、2、4、8、12和24h后誘導的γh2ax。
實驗過程按照實施例1所述進行,唯一的區別是,焦油在細胞染毒液中的濃度固定在濃度250μg/ml,染毒時間分別為1、2、4、8、12和24h。
圖4所示為250μg/ml的焦油在染毒1、2、4、8、12和24h后誘導a549細胞產生的γh2ax的時間-效應關系曲線。由圖可知,隨著染毒時間增加,a549細胞產生的γh2ax逐漸增多,呈現出顯著的時間-效應關系。
以上對本發明具體實施方式的描述并不限制本發明,本領域技術人員可以根據本發明作出各種改變或變形,只要不脫離本發明的精神,均應屬于本發明所附權利要求的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!