檢測端粒酶的亞甲基藍、上轉換納米粒修飾纖維化紙傳感器及其制備方法與流程
本發明屬于生物技術及臨床醫學診斷領域,涉及一種基于亞甲基藍、上轉換納米粒的修飾纖維化紙傳感器的制備方法,主要用于對腫瘤標志物-端粒酶的檢測,利用纖維化紙的毛細作用承載待測液進行生物反應,分別應用功能化介導的亞甲基藍與上轉換納米粒子表征細胞內端粒酶活性,從而實現對癌癥腫瘤疾病的早期診斷。
背景技術:
端粒是一種特殊的核酸復合物,以其內在rna為模板,通過逆轉錄的方式,催化人類染色體3’端重復序列(ttaggg)n的生成,防止染色體dna的重組、融合、損失。端粒酶可以調控端粒的長短,進而控制細胞生命活動。研究發現,端粒酶的活性在人類正常體細胞內受到抑制,而在絕大多數癌變細胞(85-90%)中被重新激活,從而賦予腫瘤細胞無限增殖的能力。由于細胞的癌變與發生、發展都與端粒酶活性有關,端粒酶已成為最常見的腫瘤標志物之一,此外,端粒酶和端粒結構在其他疾病、細胞的衰老、基因調控和哺乳動物的克隆中也起到關鍵作用。因此,準確而靈敏的端粒酶活性檢測技術的建立對于基于端粒酶的癌癥診斷與治療來說至關重要。
過去的幾十年里,許多端粒酶活性檢測技術建立了起來,其中最常用的檢測方式為基于聚合酶鏈反應(pcr)的端粒重復序列擴增協議法(trap)。[參見:j.p.jakupciak,w.wang,p.e.barker,s.srivastava,d.h.atha.journalofmoleculardiagnostics.2004,6,157-165.]但是,此法存在許多缺點,包括昂貴的儀器與試劑、耗時費力、聚合酶限制。[參見:g.krupp,k.kuhne,s.tamm,w.klapper,k.heidom,a.rott,r.parwaresch.nucleicacidsres.1997,25,919-921.]為了克服這些缺陷,眾多非pcr協議法發展起來,如光學傳感器法、表面等離子體共振法、熒光法、電化學發光法等。[參見:(a)p.m.schmidt,etal,biol.chem.2002,383,1659.(b)c.maesawa,etal.nucleicacidsres.2003,31.(c)c.ding,x.li,y.ge,s,zhang.anal.chem.2010,82,2850.(d)v.pavlov,etal.anal.chem.2004,76,2152.]近年來,改性金納米粒子傳感器和基于場效應的硅納米線也被應用于端粒酶檢測中。[參見:(a)y.xiao,k.y.dane,t.uzawa,a.csordas,j.qian,h.t.soh,p.s.daugherty,e.t.lagally,a.j.heeger,k.w.plaxco.j.am.chem.soc.2010,132,15299.(b)g.zhang,w.l.daniel,c.a.mirkin.j.am.chem.soc.2008,130,9644.(c)g.f.zheng,f.patolsky,y.cui,w.u.wang,c.m.lieber.nat.biotechnol.2005,23,1294.]盡管這些方法設計巧妙并且有些彌補了pcr技術的不足,但是這些新方法大多仍舊存在著檢測步驟繁多、需要復雜儀器設備以及費時問題,更重要的是,這些研究大多集中于液相的反應體系,通常是不穩定的,并且在實驗室外進行也是不切實際的。因此,上述檢測方法不適用于針對嚴重疾病進行現場醫療即時(poc)診斷。[參見:k.pardee,a.a.green,d.e.cameron,a.d.keyser,p.yin,j.j.collins.cell.2014,159,940-954.]
近年來,擴增技術已被應用至腫瘤細胞內微核糖核酸原位成像的熒光增強中和藥物的腫瘤特異性交付中。[參見:(a)r.deng,l.tang,q.tian,y.wang,l.lin,j.li.angew.chem.int.ed.2014,53,2389-2393.(b)j.ge,l.zhang,s.liu,r.yu,x.chu.anal.chem.2014,86,1808-1815.(c)j.h.kim,m.jang,y.kim,h.j.ahn.j.med.chem.2015,58,7863-7873.]纖維化紙與液相體系相比具有良好的穩定性、可視性與便捷性,適用于許多生物檢測,如電化學檢測、血糖監測等。[參見:(a)r.f.carvalhal,m.s.kfouri,m.h.o.piazetta,a.l.gobbi,l.t.kubota.anal.chem.2010,82,1162-1165.(b)y.song,p.gyarmati,a.c.araujo,j.lundeberg,h.brnmer,p.l.stahl.anal.chem.2014,86,1575-1582.]
技術實現要素:
為了克服上述現有技術的不足,本發明提供了一種檢測端粒酶的亞甲基藍、上轉換納米粒修飾纖維化紙傳感器,采用端粒延長滾換擴增技術,實現對端粒酶活性的檢測。
采用的技術方案:
一種基于亞甲基藍、上轉換納米粒修飾的纖維化紙傳感器,所述的纖維化紙規格為15*15mm,厚度為0.54mm,通過兩片正中開有直徑5mm圓孔,15*15mm大小,厚度為2mm的亞克力板材進行夾持固定成紙基板。
制備所述的纖維化紙傳感器,按以下步驟進行:
(1)、纖維化紙的預處理:將纖維化紙裁剪成15*15mm大小,浸于100~200mlnaio4和licl混合溶液中,50~80℃水浴條件下加熱30~90分鐘,反應完成后,用蒸餾水洗滌纖維化紙,30~60℃下干燥,得干燥后的纖維化紙。
(2)、纖維化紙基板的制備:將步驟(1)所制得的纖維化紙用兩片正中開有直徑3~7mm圓孔,15*15mm大小,厚度為2mm的亞克力板材進行夾持固定成紙基板,將制成的紙基板于紫外線下滅菌30~90min。隨后進行纖維化紙基板修飾。
所述的修飾纖維化紙傳感器的制備方法為:
在纖維化紙基板中央凹槽滴加10~40μl含氨基修飾的適配體(ts-nh2)3-8μm)和nacnbh3(20~80mm)的hepes緩沖液溶液,20~40℃下培育30~90分鐘,培育結束后,先后用pbs緩沖液和蒸餾水洗滌,凍干備用。適配體序列為:ts-nh2:5’-nh2(ch2)6ttttttaatccgtcgagcagagtt-3’;擴增適配體(te):5’-sh(ch2)6tt(ttaggg)9-3’;捕捉適配體(tc-nh2):5’-ccctaaccctaaaaaa(ch2)3nh2-3’。
所述的基于亞甲基藍、上轉換納米粒修飾的纖維化紙傳感器檢測腫瘤標志物-端粒酶活性的方法步驟包括:
取5~10μl1×trap緩沖液,3~8μldntps(10mm)溶液,2~3μl核苷酸酶抑制劑(rnaseinhibitor),10~40μl擴增適配體te(3-8μm)和4~10μl細胞提取溶液于紙基板中央凹槽,在20~40℃條件下孵育60分鐘擴增反應,反應結束后先用ph8.0的tris-hcl輕輕洗滌三次,再用蒸餾水輕輕洗滌三次,然后滴加10~30μl備好的tc-ucnps或tc-亞甲基藍溶液于紙基板凹槽中,在37℃條件下孵育20~60分鐘,后用trap緩沖溶液輕輕地充分洗滌,37℃下干燥,然后分別進行上轉換熒光強度分析和顏色色度分析。
與現有的標準分析方法pcr-trap法以及相繼發展的非pcr技術的熒光法、電化學發光法等相比,本發明所提供的基于亞甲基藍、上轉換納米粒的修飾纖維化紙傳感器具有以下優點:
(1)、無需復雜的儀器設備,試劑用量少,檢測成本低。而pcr-trap法需要用到凝膠電泳、密度測定儀等儀器,一些非pcr技術如熒光法等需要昂貴的熒光染料,試劑價格昂貴。
(2)、檢測時間短,在2小時內就可完成。而pcr-trap法需要27~72小時。
(3)、穩定性好,可以長時間保存,檢測結果肉眼可見。而pcr-trap法及其他眾多非pcr法均為液相檢測體系,不穩定,難以長時間保存。
在完成發明的過程中,選擇人hela宮頸癌細胞、鼠腸上皮細胞iec-18作為檢測目標物,對所述的基于亞甲基藍、上轉換納米粒修飾纖維化紙傳感器進行測試。結果表明,制備得到的亞甲基藍、上轉換納米粒修飾纖維化紙傳感器對于hela宮頸癌細胞有陽性結果顯示,而對于鼠腸上皮細胞iec-18陰性結果顯示,檢測癌細胞在0-100cells/μl范圍內呈現良好的線性關系(r=0.99)。
附圖說明
圖1為上轉換納米粒子ucnps的tem、hrtem圖;
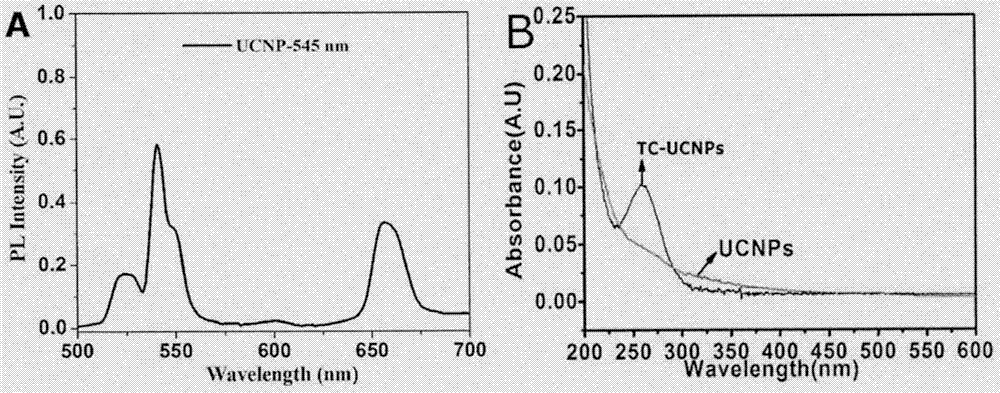
圖2為上轉換納米粒子ucnps修飾捕捉適配體(te)后的紫外-吸收圖及上轉換熒光圖;
圖3為基于亞甲基藍、上轉換納米粒修飾的纖維化紙傳感器對人hela宮頸癌細胞、鼠腸上皮細胞iec-18檢測結果圖;
圖4為基于亞甲基藍、上轉換納米粒修飾的纖維化紙傳感器對人hela宮頸癌細胞檢測結果線性關系圖;
具體實施方式
以下通過實施例形式,對本發明的上述內容再作進一步的詳細說明,但不應將此理解為本發明上述主題的范圍僅限于以下的實例,凡基于本發明上述內容所實現的技術均屬于本發明的范圍。
下面結合附圖,通過具體實施例對本發明進一步詳述。
實施例1:修飾纖維化紙傳感器的制備
實驗材料:普通纖維化濾紙,標準gb/t1914-2007,泰州金奧濾紙公司;無水氯化鋰(licl),批號為f20130906,上海埃彼化學試劑有限公司;高碘酸鈉(naio4),批號sb0875,生工生物工程(上海)股份有限公司;適配體序列為:ts-nh2:5’-nh2(ch2)6ttttttaatccgtcgagcagagtt-3’,生工生物工程(上海)股份有限公司。
實驗儀器及設備:kq-500de超聲波清洗器、dhg-9143bs電熱鼓風干燥箱、ay120電子分析天平、tgl-16c離心機。
實驗過程:
(1)纖維化紙的預處理
在250ml燒杯中,將0.4glicl和1.0gnaio4充分溶解于200ml蒸餾水中,將纖維化紙裁剪成15*15mm大小浸泡于燒杯中,在60℃下水浴加熱60分鐘,取出紙片,用蒸餾水反復洗滌三次后,置于烘箱50℃下干燥,即得氧化、干燥的纖維化紙。
(2)纖維化紙傳感器基板的制備
將厚度為2mm的亞克力板材加工成15*15mm,中央開有孔徑為5mm圓孔的薄片,將一片步驟(1)所得氧化的纖維化紙放入兩片亞克力板材中固定,于紫外線下滅菌30分鐘,即得纖維化紙傳感器基板。
(3)纖維化紙傳感器基板的修飾
將20μl濃度為50mm,ph為8.0含有5μmts-nh2溶液和50mmnacnbh3溶液的hepes緩沖溶液,少量多次滴加于步驟(2)所得的纖維化紙基板中央凹槽中,然后在37℃下培育60分鐘,培育結束后,先用pbs緩沖溶液輕輕洗滌三次,再用蒸餾水輕輕洗滌三次,凍干備用,即得修飾后的纖維化紙傳感器基板。
實施例2:端粒互補寡核苷酸(tc-nh2)修飾上轉換納米粒
實驗材料:牛血清白蛋白,批號為140318,上海阿拉丁試劑有限公司;1-乙基-(3-二甲基氨基丙基)碳二亞胺鹽酸鹽(edc),批號090m14531v,上海阿拉丁試劑有限公司;琥珀酰亞胺(nhs),批號mkbg7914v,上海阿拉丁試劑有限公司;乙醇,批號為:14021710247,購自南京化學試劑有限公司。捕捉適配體序列為:tc-nh2:捕捉適配體(tc-nh2):5’-ccctaaccctaaaaaa(ch2)3nh2-3’,生工生物工程(上海)股份有限公司。
實驗儀器及設備:kq-500de超聲波清洗器、dhg-9143bs電熱鼓風干燥箱、ay120電子分析天平、tgl-16c離心機。
實驗過程:將1ml濃度為1mg/ml的羧基化上轉換納米粒子(ucnps)用25mm,ph為6的mes緩沖溶液洗滌兩次后離心,取上清液,滴加100μl濃度為5mg/ml的edc溶液與100μl濃度為5mg/ml的nhs溶液,室溫下緩慢振搖60分鐘后,滴加78μl濃度為100μm的端粒互補寡核苷酸(捕捉適配體tc-nh2),室溫下孵育18小時。孵育結束后,用50000分子量超濾管超濾,取上層用tris-hcl緩沖液稀釋后離心,重復兩次,棄液體,用含0.1%bsa的ph為7.4的pbs緩沖液洗滌三次,即得胺基化的端粒互補寡核苷酸修飾上轉換納米粒子溶液。進行tem、hrtem以及紫外、熒光表征。如圖1,圖2所示。
實施例3:選擇人宮頸癌細胞(hela細胞)為研究目標物,對所述的基于亞甲基藍、上轉換納米粒修飾纖維化紙傳感器進行測試
實驗材料:乙醇,批號為:14021710247,購自南京化學試劑有限公司。hepes緩沖液,批號為:e607018,購自上海生工生物試劑有限公司;5′-三磷酸腺苷二鈉鹽三水(atp),批號為:a600020,購自上海生工生物試劑有限公司;
實驗儀器及設備:kq-500de超聲波清洗器、dhg-9143bs電熱鼓風干燥箱、ay120電子分析天平、tgl-16c離心機。
實驗過程:
(1)人宮頸癌細胞端粒酶的提取
取指數生長期的宮頸癌細胞于10ml離心管,用冰預冷的pbs緩沖液洗滌兩次,用血球計數板進行計數,將1ml濃度為0cell/μl、20cell/μl、40cell/μl、60cell/μl、80cell/μl、100cell/μl的宮頸癌細胞pbs緩沖液分別裝于六支1.5ml離心管中,在4℃,10000g的條件下離心1分鐘,棄去上清液。在每支離心管中滴加200μl冰預冷的細胞端粒酶裂解液,在0℃,450轉/分鐘的條件下于自動勻漿機中培育25分鐘后在4℃,16000g的條件下離心20分鐘,移取160μl上清液分裝于六支新的1.5ml離心管中立即使用或者在-80℃條件下凍存備用。
(2)基于亞甲基藍的修飾纖維化紙傳感器對端粒酶活性的檢測
將5μl1×trap緩沖液(含20mm,ph8.3tris-hcl緩沖液,1.5mm氯化鎂溶液,63mm氯化鉀溶液,0.005%吐溫20,1mmegta溶液,0.1mg/mlbsa溶液),5μl濃度為10mm的dntps溶液,20μl擴增適配體te(5μm),1μl核苷酸酶抑制劑,5μl步驟(1)六個不同濃度的樣品溶液分別滴加于6個所述的修飾纖維化紙基板中央凹槽,在37℃條件下孵育60分鐘,孵育結束后,先用20mmph8.0的tris-hcl緩沖液輕輕洗滌三次,再用蒸餾水輕輕洗滌三次,37℃下干燥后,分別滴加20μl捕捉適配體(tc-亞甲基藍)溶液于凹槽中,在37℃條件下孵育30分鐘,孵育結束后,用trap緩沖液輕輕地充分洗滌,37℃條件下干燥,用數碼相機拍攝6個紙基板中央凹槽的圖片,利用色度分析軟件進行分析。
(3)基于上轉換納米粒的修飾纖維化紙基板對端粒酶活性的檢測
將5μl1×trap緩沖液(含20mm,ph8.3tris-hcl緩沖液,1.5mm氯化鎂溶液,63mm氯化鉀溶液,0.005%吐溫20,1mmegta溶液,0.1mg/mlbsa溶液),5μl濃度為10mm的dntps溶液,1μl核苷酸酶抑制劑,20μl擴增適配體te(5μm)和5μl步驟(1)六個不同濃度的樣品溶液分別滴加于6個所述的修飾纖維化紙基板中央凹槽,在37℃條件下孵育60分鐘,孵育結束后,先用20mm,ph8.0的tris-hcl緩沖液輕輕洗滌三次,再用蒸餾水輕輕洗滌三次,37℃下干燥后,分別滴加20μl實施例2中的捕捉適配體(tc-上轉換納米粒)溶液于凹槽中,在37℃條件下孵育30分鐘,孵育結束后,用trap緩沖液輕輕地充分洗滌,37℃條件下干燥,用數碼相機拍攝下近紅外光照射中央凹槽處的熒光圖片,進行分析。試驗結果如圖3所示。
實施例4:選擇鼠腸上皮細胞iec-18細胞為研究目標物,對所述的基于亞甲基藍、上轉換納米粒的修飾纖維化紙傳感器進行測試
實驗材料:乙醇,批號為:14021710247,購自南京化學試劑有限公司。hepes緩沖液,批號為:e607018,購自上海生工生物試劑有限公司;5′-三磷酸腺苷二鈉鹽三水(atp),批號為:a600020,購自上海生工生物試劑有限公司;
實驗儀器及設備:kq-500de超聲波清洗器、dhg-9143bs電熱鼓風干燥箱、ay120電子分析天平、tgl-16c離心機。
實驗過程:
(1)人宮頸癌細胞端粒酶的提取
取指數生長期的鼠腸上皮細胞iec-18細胞于10ml離心管,用冰預冷的pbs緩沖液洗滌兩次,用血球計數板進行計數,將1ml濃度為0cell/μl、20cell/μl、40cell/μl、60cell/μl、80cell/μl、100cell/μl的鼠腸上皮細胞iec-18細胞pbs緩沖液分別裝于六支1.5ml離心管中,在4℃,10000g的條件下離心1分鐘,棄去上清液。在每支離心管中滴加200μl冰預冷的細胞端粒酶裂解液,在0℃,450轉/分鐘的條件下于自動勻漿機中培育25分鐘后在4℃,16000g的條件下離心20分鐘,移取160μl上清液分裝于六支新的1.5ml離心管中立即使用或者在-80℃條件下凍存備用。
(2)基于亞甲基藍的修飾纖維化紙傳感器對端粒酶活性的檢測
將5μl1×trap緩沖液(含20mm,ph8.3tris-hcl緩沖液,1.5mm氯化鎂溶液,63mm氯化鉀溶液,0.005%吐溫20,1mmegta溶液,0.1mg/mlbsa溶液),5μl濃度為10mm的dntps溶液,20μl擴增適配體te(5μm),1μl核苷酸酶抑制劑,5μl步驟(1)六個不同濃度的樣品溶液分別滴加于6個所述的修飾纖維化紙基板中央凹槽,在37℃條件下孵育60分鐘,孵育結束后,先用20mmph8.0的tris-hcl緩沖液輕輕洗滌三次,再用蒸餾水輕輕洗滌三次,37℃下干燥后,分別滴加20μl捕捉適配體(tc-亞甲基藍)溶液于凹槽中,在37℃條件下孵育30分鐘,孵育結束后,用trap緩沖液輕輕地充分洗滌,37℃條件下干燥,用數碼相機拍攝6個紙基板中央凹槽的圖片,利用色度分析軟件進行分析。
(3)基于上轉換納米粒的修飾纖維化紙基板對端粒酶活性的檢測
將5μl1×trap緩沖液(含20mm,ph8.3tris-hcl緩沖液,1.5mm氯化鎂溶液,63mm氯化鉀溶液,0.005%吐溫20,1mmegta溶液,0.1mg/mlbsa溶液),5μl濃度為10mm的dntps溶液,1μl核苷酸酶抑制劑,20μl擴增適配體te(5μm)和5μl步驟(1)六個不同濃度的樣品溶液分別滴加于6個所述的修飾纖維化紙基板中央凹槽,在37℃條件下孵育60分鐘,孵育結束后,先用20mm,ph8.0的tris-hcl緩沖液輕輕洗滌三次,再用蒸餾水輕輕洗滌三次,37℃下干燥后,分別滴加20μl實施例2中的捕捉適配體(tc-上轉換納米粒)溶液于凹槽中,在37℃條件下孵育30分鐘,孵育結束后,用trap緩沖液輕輕地充分洗滌,37℃條件下干燥,用數碼相機拍攝下近紅外光照射中央凹槽處的熒光圖片,進行分析。試驗結果如圖3,圖4所示。
以上實施例僅用于說明本發明的優選實施方式,但本發明并不限于上述實施方式,在所述領域普通技術人員所具備的知識范圍內,本發明的精神和原則之內所作的任何修改、等同替代和改進等,其均應在本發明請求保護的技術方案范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種磁性納米粒子與超濾膜結合處理廢棄乳化液的方法與流程
- 一種多肽修飾納米粒子在制備治療急性肺損傷的藥物中的應用的制作方法與工藝
- 一種金納米花修飾的離子液體功能化石墨烯紙電極、其制備方法和應用與流程
- 一種新型的透明質酸修飾的多級納米顆粒及其制備與應用的制作方法與工藝
- 一種核殼結構的磁性納米粒子及其制備與應用的制作方法與工藝
- 一種室溫固相反應制備的納米鐵修飾的鐵基氨合成催化劑及其制備方法和應用與流程
- 一種丁氧基修飾的TiO2單晶空心四方納米錐材料、制備方法及其應用與流程
- 一種改性粒子修飾的有機無機雜化聚合物涂料的制作方法與工藝
- 一種表面修飾片狀納米銅及含有該納米銅的復合潤滑油的制備方法與流程
- 一種用于簡便修飾磁性納米粒子的手性拆分添加劑的制備和應用的制作方法與工藝
- 使用經修飾的核苷酸和納米孔檢測的DNA邊合成邊測序的制作方法與工藝
- 一種離子液體修飾的硫化鋅納米極壓抗磨劑的制備及含有該抗磨劑的節能抗磨液壓油的制作方法與工藝
- 一種Ag修飾的ZnO納米棒基底的自清潔傳感器及制備方法和用途與流程
- 一種Pt納米粒修飾ZnSnO3納米片氣敏材料的制備方法與流程
- 一種載有阿霉素的適配體修飾DNA納米籠及其制備方法與流程
- 使用經修飾的核苷酸和納米孔檢測的DNA邊合成邊測序的制造方法與工藝
- 一種鞋面填充上光修飾劑及其制備方法與流程
- 一種以碳納米點界面修飾的鈣鈦礦太陽能電池及其制備方法與流程
- 一種通過熒光分子修飾的銀溶膠檢測Cd2+、Pb2+離子的方法與流程
- 釓修飾硫化鉍納米診療劑的制備方法與制造工藝
- 一種表面修飾片狀納米銅及含有該納米銅的復合潤滑油的制備方法與流程
- 多肽修飾的納米粒子及其制備方法和控制細胞中基因表達的方法與流程
- 一種表面修飾片狀納米銅及含有該表面修飾片狀納米銅的潤滑油的制作方法與工藝
- 一種山核桃仁鞣質葉酸修飾納米粒的制備方法與流程
- 一種SiO2修飾TiO2單晶粒子光催化劑的合成方法與流程
- 一種用β-PbO2粒子修飾碳纖維的方法及其應用與流程
- 一種Ag修飾的ZnO納米棒基底的自清潔傳感器及制備方法和用途與流程
- 抗生素修飾的磁性納米粒子快速富集分離單增李斯特菌的方法與流程
- 一種水溶性透明質酸修飾的金納米粒子聚集體HA?Cys?AuNPs及制備方法與流程
- 一種多維度納米粒子修飾的超疏水吸油泡沫材料及其制備方法與流程