4’,5’?二溴熒光素及其衍生物在蛋白檢測中的應用的制作方法
本發明涉及蛋白質負染檢測技術,具體地說,涉及蛋白質檢測的一種新的負染染料。
背景技術:
在蛋白質組學研究中,凝膠蛋白質染色技術是銜接二維電泳和下游質譜分析的關鍵技術。當前先進的質譜儀已能夠分析pg級別的痕量蛋白。常規的凝膠蛋白質染色技術有考馬斯亮藍染色、銀染、熒光染色等。考馬斯亮藍染色法靈敏度低,銀染法操作復雜、質譜兼容性差,熒光染色法價格昂貴。這些因素嚴重地制約了高通量蛋白質組學的發展。雖然,近年來開發了不少新的染色技術,但仍存在著如下一個或幾個缺點:靈敏度低、重現性差、毒性大、質譜兼容性差、價格昂貴、操作繁瑣等。尋找新的染色方法以適應當前先進的質譜分析技術已成為后基因組時代推動蛋白質組學發展的當務之急。4′,5′-二溴熒光素為凝膠蛋白染色提供了一種快速、靈敏的方法,其靈敏度達0.025ng/band,可以和銀染相媲美。而且4′,5′-二溴熒光素負染方法是對凝膠背景進行著色,對蛋白質的結構沒有修飾或破壞作用,有良好的質譜兼容性,彌補了銀染法質譜兼容性差的缺陷。4′,5′-二溴熒光素負染將很好地銜接二維電泳和下游質譜分析,推動蛋白質組學的快速發展。
技術實現要素:
本發明的目的在于提供4′,5′-二溴熒光素及其衍生物在蛋白質檢測中的應用。
本發明所述的相關化合物是指以4′,5′-二溴熒光素陰離子為母核的鈉鹽、鉀鹽和銨鹽等。
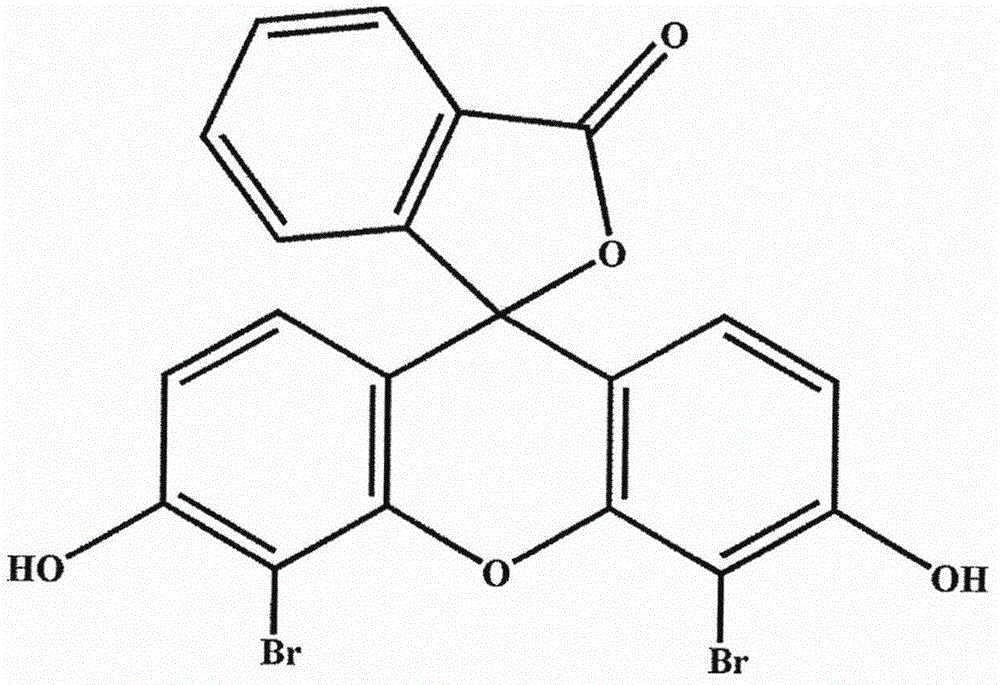
4′,5′-二溴熒光素母核為:
為實現本發明的目的,本發明提供了一種電泳凝膠上蛋白質負染的方法,包括如下步驟:
1)將經SDS-PAGE電泳后的蛋白質樣品置于染色液中染色5~15min,其中染色液為含重量體積比0.05~0.5%的4′,5′-二溴熒光素或其衍生物、按摩爾濃度比20~100μM的氯化鋅、按溶液體積比5~20%的甘油及按溶液體積比30%~70%的甲醇水溶液;優選的染色時間為8min,優選的4′,5′-二溴熒光素及其衍生物的濃度為0.3%,優選的氯化鋅濃度為50μM,優選的甘油濃度為10%,優選的碳酸優選的甲醇濃度為40%。
2)棄去染色液,加入顯影液顯影1~5min,其中顯影液為按摩爾濃度比100mM的醋酸鈉-醋酸緩沖液,pH=4.6。優選的顯影時間為2min。
3)檢測,凝膠染色后,可放在黑色背景下直接肉眼觀察;或在愛普生V700掃描儀下,反向掃描模式掃描,其靈敏度更高。
前期研究表明該技術有如下優點:
1)靈敏度高:4′,5′-二溴熒光素負染靈敏度高于考馬斯亮藍染色法數百倍,和銀染法靈敏度相當;
2)操作簡單迅速:操作步驟少,可在10min內完成;
3)重現性好:受溫度、搖床擺動頻率等外部條件影響小;
4)可逆性好:容易脫色;
5)質譜兼容性好:由于4′,5′-二溴熒光素負染是對凝膠背景進行染色,不和凝膠上的蛋白質結合,蛋白質結構完全不受影響,所以可與LC-MS等質譜儀高度兼容;
6)使用安全:采用毒性低的染料,提高實驗操作的安全性,對環境污染小;
7)成本低。
附圖說明:
圖1. 4′,5′-二溴熒光素的化學結構。
圖2. 4′,5′-二溴熒光素負染法染色和顯影條件的優化。(A)染色液中4′,5′-二溴熒光素濃度的篩選;(B)染色液中甲醇濃度的篩選;(C)染色液中甘油濃度的篩選;(D)染色液中氯化鋅濃度的篩選;(E)染色時間的篩選;(F)顯影液中pH值的篩選。
圖3.在一向SDS-PAGE上,(A,E,I)4′,5′-二溴熒光素負染法;(B,F,J)曙紅負染法;(C,G,K)SYPRO Ruby熒光染色法;(D,H,L)鋅咪唑負染法。(A-D)為Sigma公司的蛋白標準品,(E-H)為小鼠腦總蛋白,(I-L)為大腸桿菌Escherichia coli BL21總蛋白。蛋白標準品上樣量如下(A-D):帶1,12.8ng;帶2,6.4ng;帶3,3.2ng;帶4,1.6ng;帶5,0.8ng;帶6,0.4ng;帶7,0.2ng;帶8,0.1ng;帶9,0.05ng;帶10,0.025ng。小鼠腦總蛋白和大腸桿菌Escherichia coli BL21總蛋白上樣量(E-L)從左至右倍倍稀釋。
圖4.在二向SDS-PAGE膠上,(A)4′,5′-二溴熒光素負染法和(B)鋅咪唑負染法靈敏度的比較。分離樣品小鼠腦總蛋白;IPG膠條長13厘米,pH4-7;分離膠濃度為11.4%;樣品上樣量為100微克/膠條。(C)4′,5′-二溴熒光素負染法和鋅咪唑負染法檢測到的蛋白斑點數統計。
具體實施方式
下面結合具體地實施例來進一步闡述本發明。應當理解,這些實施例僅用于說明本發明,而不能限制本發明的保護范圍。
實施例1 4′,5′-二溴熒光素負染染色
圖1是4′,5′-二溴熒光素的化學結構式。
圖2~4的4′,5′-二溴熒光素蛋白質負染實驗采用下述步驟進行:
1)將電泳后的凝膠置于0.3%4′,5′-二溴熒光素/40%甲醇/10%甘油/50μM氯化鋅染色液中染色8min。
2)棄去染色液,在100mM的醋酸鈉-醋酸緩沖液(pH=4.6)中顯影2min。
3)凝膠染色后,在愛普生V700掃描儀下,反向掃描模式掃描。
按照上述方法分別用4′,5′-二溴熒光素的鈉鹽、鉀鹽、銨鹽進行蛋白質染色,結果表明用這些衍生物均能夠得到類似于4′,5′-二溴熒光素的檢測結果。
圖2是4′,5′-二溴熒光素負染法染色法條件優化的過程。分別對染色液中4′,5′-二溴熒光素濃度、甲醇濃度、甘油濃度、氯化鋅濃度、染色時間及顯影液中pH進行了篩選。結果顯示最佳的染色液條件為0.3%4′,5′-二溴熒光素/40%甲醇/10%甘油/50μM氯化鋅,最佳染色時間為8min,顯影液最佳pH值為4.6。
圖3是說明在一向SDS-PAGE上,4′,5′-二溴熒光素負染法與其它染色法效果的對比,采用的是蛋白標準品,小鼠腦總蛋白和大腸桿菌Escherichia coli BL21總蛋白。
按照實施例1的方法,采用不同的方法進行染色,(A,E,I)4′,5′-二溴熒光素負染法;(B,F,J)曙紅負染法;(C,G,K)SYPRO Ruby熒光染色法;(D,H,L)鋅咪唑負染法靈敏度的比較。曙紅負染法、SYPRO Ruby熒光染色法和鋅咪唑負染法均按照文獻記載。蛋白標準品上樣量如下(A-D):帶1,12.8ng;帶2,6.4ng;帶3,3.2ng;帶4,1.6ng;帶5,0.8ng;帶6,0.4ng;帶7,0.2ng;帶8,0.1ng;帶9,0.05ng;帶10,0.025ng。小鼠腦總蛋白和大腸桿菌Escherichia coli BL21總蛋白上樣量(E-L)從左至右倍倍稀釋。結果如圖3所示,4′,5′-二溴熒光素負染法靈敏度最高。
小鼠腦總蛋白提取方法如下:用4℃的PBS溶液清洗小鼠腦組織,一共清洗3次。之后用液氮進行組織研磨,將研磨所得的粉末裝入事先稱重的EP管中。向EP管中加入裂解液(9.5M urea,0.1DTT,2%CHAPS,0.8%pharmalyte pH3-10)至終濃度為1mg/mL。將樣品超聲破碎3次,每次1分鐘,完畢之后15000rpm 4℃高速離心30min,取上清液。大腸桿菌總蛋白的提取方法如下:取Escherichia coli BL21菌液,12000rpm離心收集菌群,加入0.02mol/L的磷酸鹽緩沖液(pH=7.0)重懸菌體。利用超聲破碎儀破碎細胞。18000rpm離心30min,收集上清,即得Escherichia coli BL21總蛋白質提取液(粗蛋白制品)。
圖4是說明在二向SDS-PAGE上,4′,5′-二溴熒光素負染法與鋅咪唑負染法效果的對比,采用是小鼠腦總蛋白。
用4′,5′-二溴熒光素負染法和鋅咪唑負染法對經二向凝膠電泳分離的小鼠腦總蛋白進行染色,結果如圖4所示。結果表明,相比較鋅咪唑負染法而言,4′,5′-二溴熒光素負染法可檢測到更多的蛋白質斑點,具有更高的靈敏度。
圖2~4中的其它染色方法及相關文獻
曙紅負染法操作方法參考文獻:Cong WT,Hwang SY,Jin LT,He HZ,Choi JK.High-throughput negative detection of SDS-PAGE separated proteins and its application for proteomics.Electrophoresis 2010,3,411-420.
SYPRO Ruby熒光染色法參考文獻:Berggren K,Chernokalskaya E,Steinberg TH,Kemper C,Lopez MF,Diwu Z,Haugland RP,PattonWF.Background-free,high sensitivity staining of proteins in one-and two-dimensional sodium dodecyl sulfate-polyacrylamide gels using a luminescent ruthenium complex.Electrophoresis 2000,21,2509-2521.
鋅咪唑負染法操作方法參考文獻:Castellanos-Serra L,Proenza W,Huerta V,Moritz RL,Simpson RJ.Proteome analysis of polyacrylamide gel-separated proteins visualized by reversible negative staining using imidazole-zinc salts.Electrophoresis 1999,20,732-737。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種基于咔唑衍生物的雙羥基熒光擴鏈劑及其制備與應用的制作方法與工藝
- 基于苯基苯并咪唑單極熱激發延遲熒光主體、電子傳輸材料的制備方法及應用與流程
- 基于2?(2’?羥基苯基)苯并噻唑衍生物的pH熒光探針及其制備方法和應用與流程
- 取代的5?羥基?2?雜芳基?3?苯基戊腈衍生物、其制備方法及其作為除草劑和/或植物生長調節劑的用途與流程
- 1?[(2?溴苯基)磺酰基]?5?甲氧基?3?[(4?甲基?1?哌嗪基)甲基]?1H?吲哚二甲磺酸鹽一水合物的活性代謝物和活性代謝物的二甲磺酸二水合物鹽的制作方法與工藝
- 一種3?正丁胺基?4?溴?N?苯基馬來酰亞胺的制備方法與流程
- 2,5?二溴?1,4?苯二氧基二乙酸鋅配合物單晶與應用的制作方法與工藝
- 三羥基咪唑?熒光素pH熒光探針及其制備方法與流程
- 6?羥甲基?1?苯基吡啶?2?酮及其制備方法與應用與流程
- 一種合成2?(2,4?二羥基苯基)?4,6?二苯基?1,3,5?均三嗪的方法與流程