聚多巴胺修飾n型半導體材料在構建光電免疫傳感器中的應用的制作方法
本發明屬于生物傳感器技術領域,具體涉及聚多巴胺修飾n型半導體材料在構建光電免疫傳感器中的應用。
背景技術:
光電免疫傳感是一種利用光電流來檢測生物分子的方法,其基本原理是發生在光電極表面的抗原-抗體結合反應阻礙光電流的產生,通過檢測抗原抗體反應前后同一光電極上的電流響應,就能對抗原進行直接定量檢測,且無需任何標記抗體。一般而言光電極上除了需要集成光電轉化所需的半導體-敏化染料等外,還需要提供溫和友好的界面用于探針抗體的固定,所以構建步驟繁瑣,且器件的穩定性和可重復性欠佳,因此,急需一種制備簡單,性能可靠的光電免疫傳感。
技術實現要素:
有鑒于此,本發明的目的在于提供一種聚多巴胺修飾n型半導體材料在構建光電免疫傳感器中的應用。
為達到上述目的,本發明提供如下技術方案:
1、聚多巴胺修飾n型半導體材料在構建光電免疫傳感器中的應用。
進一步,所述光電免疫傳感器的制作方法為:
(1)在FTO玻璃片上生長n型半導體材料:首先,將清洗后的FTO玻璃片導電面朝下斜靠于裝有生長液的燒杯壁上,然后,將所述燒杯放入65-95℃水浴鍋中0.5-4h,最后,取出所述玻璃片沖洗后吹干,制得n型半導體材料/FTO電極;
(2)在n型半導體材料/FTO電極上生長聚多巴胺薄膜:將步驟(1)中制得n型半導體材料/FTO電極浸沒在多巴胺溶液中2-24h,取出所述n型半導體材料/FTO電極沖洗后吹干,制得PDA/n型半導體材料/FTO電極;
(3)在PDA/n型半導體材料/FTO電極上固定抗體分子:將步驟(2)中制得的PDA/n型半導體材料/FTO電極浸沒在抗體溶液中0.5-24h,取出所述PDA/n型半導體材料/FTO電極沖洗后再將其浸沒在牛血清蛋白溶液中0.25-24h,取出所述PDA/n型半導體材料/FTO電極沖洗后制得光電免疫傳感器。
進一步,步驟(1)中,所述n型半導體材料為氧化鋅納米棒或二氧化鈦納米線中的一種。
進一步,所述光電免疫傳感器的制作方法為:
(1)在FTO玻璃片上生長氧化鋅納米棒:首先,將清洗后的FTO玻璃片導電面朝下斜靠于裝有生長液的燒杯壁上,然后,將所述燒杯放入75℃水浴鍋中2h,最后,取出所述玻璃片沖洗后吹干,制得ZnO/FTO電極;
(2)在ZnO/FTO電極上生長聚多巴胺薄膜:將步驟(1)中制得ZnO/FTO電極浸沒在多巴胺溶液中3h,取出所述ZnO/FTO電極沖洗后吹干,制得PDA/ZnO/FTO電極;
(3)在PDA/ZnO/FTO電極上固定抗體分子:將步驟(2)中制得的PDA/ZnO/FTO電極浸沒在抗體溶液中1h,取出所述PDA/ZnO/FTO電極沖洗后再將其浸沒在牛血清蛋白溶液中15min,取出所述PDA/ZnO/FTO電極沖洗后制得光電免疫傳感器。
進一步,步驟(1)中,所述生長液的配制方法為將2.97g六水合硝酸鋅、3mL氨水、1mL乙二胺依次加入100mL水中。
進一步,步驟(1)中,所述清洗為依次經過丙酮、無水乙醇、水超聲處理,所述超聲處理為每種清洗液中超聲清洗三次,每次5min。
進一步,步驟(1)和步驟(2)中,所述沖洗為經水沖洗。
進一步,步驟(2)中,所述多巴胺溶液的濃度為2mg/mL,配制方法為將巴胺溶于pH=8.5的三羥甲基氨基甲烷-鹽酸緩沖溶液中。
進一步,步驟(3)中,所述沖洗為經過TBS洗液、水依次沖洗;所述TBS洗液的配置方法為將6g三羥甲基氨基甲烷-鹽酸鹽、8g氯化鈉、0.2g氯化鉀溶于1L水中,調pH至8后再加入500μL吐溫20。
進一步,步驟(3)中,所述牛血清蛋白溶液的濃度為2mg/mL,配制方法為將牛血清蛋白溶于0.01M的PBS緩沖液中。
本發明的有益效果在于:本發明提供了聚多巴胺修飾n型半導體材料在構建光電免疫傳感器中的應用,利用聚多巴胺薄膜修飾n型半導體材料來構建光電免疫傳感器,其中,聚多巴胺具有吸收可見光的能力,能夠作為一種有效的光敏劑拆分電荷、轉移電子,因此可以增加傳感器的光電流響應,同時,聚多巴胺的分子結構中具有鄰苯二羥基的結構,此功能團可以與蛋白質中的氨基發生反應從而可以固定生物探針分子而不需要額外的中間介質,使得光電免疫傳感器的結構更加簡單,保證了該光電免疫傳感器的穩定性以其構建的光電免疫傳感器具有較高的靈敏度。將其修飾于半導體氧化鋅納米棒上構建的光電免疫傳感器用于人癌胚抗原的檢測,其最低檢測線為10pg/mL,在人癌胚抗原濃度為100pg/mL-500ng/mL范圍內呈線性分布;將其修飾于半導體氧化鋅納米棒上構建的光電免疫傳感器用于小鼠IgG的檢測,其最低檢測線為100pg/mL,在小鼠IgG濃度為100pg/mL-5000ng/mL范圍內呈線性分布具有很好的特異性和穩定性。本發明中聚多巴胺修飾n型半導體材料在構建的光電免疫傳感器適用于所有的蛋白質的檢測,還可以用于其他生物分子如DNA、細胞等的檢測。
附圖說明
為了使本發明的目的、技術方案和有益效果更加清楚,本發明提供如下附圖進行說明:
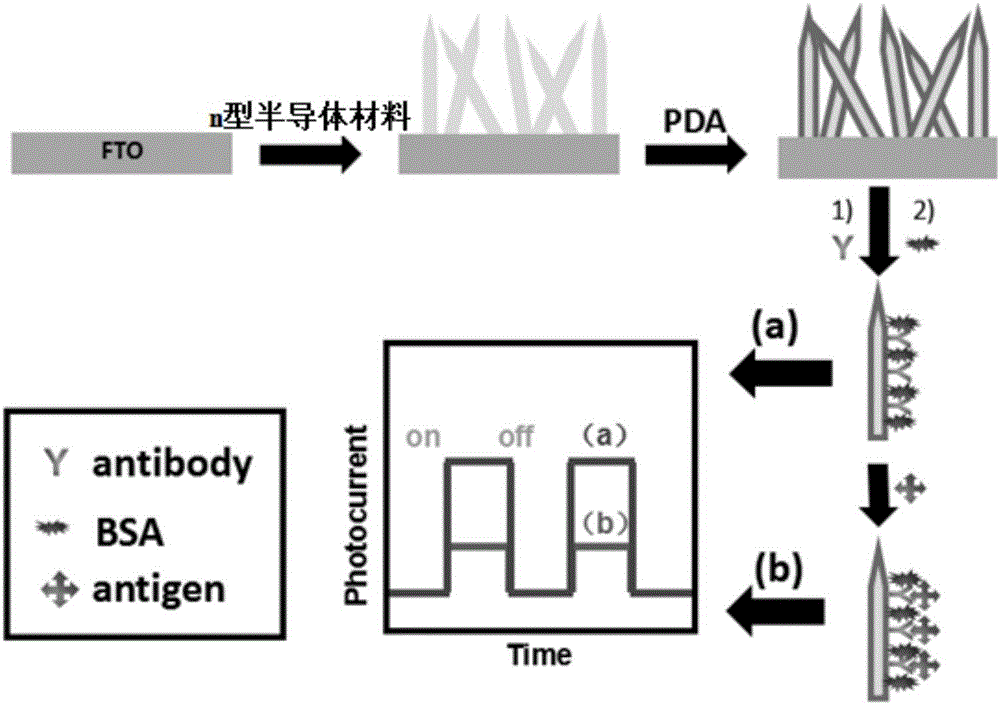
圖1為光電免疫傳感器構建的原理示意圖;
圖2為ZnO/FTO電極上氧化鋅納米棒的掃描電鏡圖;
圖3為ZnO/FTO電極上氧化鋅納米棒的X射線衍射圖;
圖4為PDA/ZnO/FTO電極上聚多巴胺-氧化鋅納米棒的掃描電鏡圖和透射電鏡圖;
圖5為PDA/ZnO/FTO電極經過20次暗態-亮態循環后的瞬態電流響應圖;
圖6為PDA/ZnO/FTO電極上聚多巴胺-氧化鋅納米棒電極在抗壞血酸溶液中的電子轉移原理圖;
圖7為PDA/ZnO/FTO電極在依次連接不同的蛋白質后的瞬態電流曲線;
圖8為光電免疫傳感器(BSA/鼠抗人癌胚抗原單克隆抗體/PDA/ZnO/FTO電極)與不同濃度的人癌胚抗原反應后的光電流響應圖;
圖9為光電免疫傳感器(BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極)與不同濃度的小鼠IgG反應后的光電流響應圖。
具體實施方式
下面將結合附圖,對本發明的優選實施例進行詳細的描述。
圖1為光電免疫傳感器構建的原理示意圖,由圖1可知,該光電免疫傳感器的構建過程如下:在FTO玻璃上生長n型半導體材料后再生長一層聚多巴胺薄膜,最后在聚多巴胺上固定抗體探針分子,并利用牛血清蛋白進行封閉。在進行目標蛋白質檢測前后,分別記錄該傳感器的光電流,通過前后光電流的變化對目標蛋白質進行定量。
實施例1
聚多巴胺修飾半導體氧化鋅棒構建光電免疫傳感器,具體步驟如下:
(1)在FTO玻璃片上生長氧化鋅納米棒:首先,將依次經丙酮、無水酒精、二次水超聲清洗后的FTO玻璃片導電面朝下斜靠于裝有生長液的燒杯壁上,其中,每種清洗液超聲清洗3次,每次5min;然后,將所述燒杯放入75℃水浴鍋中2h;最后,取出所述玻璃片經二次水沖洗后氮氣吹干,制得ZnO/FTO電極,所述生長液的配制方法為將2.97g六水合硝酸鋅、3mL氨水、1mL乙二胺依次加入100mL二次水中;
(2)在ZnO/FTO電極上生長聚多巴胺薄膜:將步驟(1)中制得ZnO/FTO電極浸沒在多巴胺溶液中3h,取出所述ZnO/FTO電極經二次水沖洗后氮氣吹干,制得PDA/ZnO/FTO電極,所述多巴胺溶液的濃度為2mg/mL,配制方法為將巴胺溶于pH=8.5的三羥甲基氨基甲烷-鹽酸緩沖溶液中;
(3)在PDA/ZnO/FTO電極上固定山羊抗小鼠IgG單克隆抗體:將步驟(2)中制得的PDA/ZnO/FTO電極浸沒在山羊抗小鼠IgG單克隆抗體溶液中1h,取出所述PDA/ZnO/FTO電極依次經TBS洗液、二次水沖洗后制得山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極,再將山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極浸沒在牛血清蛋白溶液中15min,取出所述山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極再依次經TBS洗液、二次水沖洗后制得光電免疫傳感器(BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極),所述牛血清蛋白溶液的濃度為2mg/mL,配制方法為將牛血清蛋白溶于0.01M的PBS緩沖液中;所述TBS洗液的配置方法為將6g三羥甲基氨基甲烷-鹽酸鹽、8g氯化鈉、0.2g氯化鉀溶于1L二次水中,調pH至8后再加入500μL吐溫20。
(4)在PDA/ZnO/FTO電極上固定鼠抗人癌胚抗原單克隆抗體:實驗步驟參照實驗(3),僅將其中山羊抗小鼠IgG單克隆抗體溶液替換為鼠抗人癌胚抗原單克隆抗體溶液,制得光電免疫傳感器(BSA/鼠抗人癌胚抗原單克隆抗體/PDA/ZnO/FTO電極)
圖2為ZnO/FTO電極上氧化鋅納米棒的掃描電鏡圖,由圖中可以看出,氧化鋅納米棒為FTO表面生長良好,形貌規整,取向隨機,密度均勻。
圖3為ZnO/FTO電極上氧化鋅納米棒的X射線衍射圖,由圖中可以看出,該氧化鋅納米棒結晶程度高,有利于電子的傳輸。
圖4中A、B分別為PDA/ZnO/FTO電極上聚多巴胺-氧化鋅納米棒的掃描電鏡圖和透射電鏡圖,由圖中可以看出,短時間的聚多巴胺生長過程不會對氧化鋅納米棒造成腐蝕,并且聚多巴胺能夠在氧化鋅納米棒的表面形成連續、厚度均勻的一層薄膜
實施例2
以實施例1中制得的PDA/ZnO/FTO電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流曲線,所得結果如圖5所示,由圖5可知,在經過20次暗態-亮態循環后,其光電流的衰減小于5%,表明該電極具有良好的穩定性。其中,PDA/ZnO/FTO電極上聚多巴胺-氧化鋅納米棒電極在抗壞血酸溶液中的電子轉移原理如圖6所示,由圖6可知,在光照條件下,聚多巴胺中具有的共軛大環結構有效吸收光子能量,其中的π電子被激發,并轉移到n型半導體氧化鋅上,由此產生外電流。而失去電子的聚多巴胺被氧化,由氫醌轉變為醌式結構,后者又被溶液中的抗壞血酸還原再生為氫醌結構,因此可以在外電路得到持續穩定的光電流。
實施例3
1、以實施例1中制得的PDA/ZnO/FTO電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流曲線,結果如圖7(a);
2、以實施例1中制得的山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流曲線,結果如圖7(b);
3、以實施例1中制得的BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流曲線,結果如圖7(c);
4、將實施例1中制得的BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極浸沒在小鼠IgG溶液中1h,取出所述BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極依次經TBS洗液、二次水沖洗,制得小鼠IgG/BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極,以該電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流曲線,結果如圖7(d);
由圖7中(a)、(b)、(c)、(d)可知,電極在逐步連接蛋白質后,其光電流是逐步下降的,表明PDA/ZnO/FTO電極自身能夠連接蛋白質,且蛋白質的特異性結合會影響光電流的產生,表明其可以作為光電免疫傳感器來檢測蛋白質。
實施例4
以實施例1中制得的BSA/鼠抗人癌胚抗原單克隆抗體/PDA/ZnO/FTO電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流I0;
再將實施例1中制得BSA/鼠抗人癌胚抗原單克隆抗體/PDA/ZnO/FTO電極分別浸泡于濃度為0pg/mL、0.01pg/mL、0.1pg/mL、1pg/mL、10pg/mL、100pg/mL、500pg/mL、1000pg/mL、5000pg/m的人癌胚抗原溶液中,反應1h后TBS洗液、二次水依次沖洗后再次記錄瞬態電流I,對兩次瞬態電流曲線中的光電流的減少比值即(I0-I)/I0進行比較分析,結果如圖8所示,由圖8可知,該光電免疫傳感器對人癌胚抗原的最低檢測線為10pg/mL,在抗體濃度為100pg/mL-500ng/mL范圍內呈線性分布。
實施例5
以實施例1中制得的BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極作為工作電極,鉑片和飽和甘汞電極分別為對電極和參比電極,0.1M PBS中添加1mM抗壞血酸作為電解質,外加電壓為0V,氙燈(功率為500W,功率密度為100mW/cm2)為光源,記錄瞬態電流I0;
再將實施例1中制得BSA/山羊抗小鼠IgG單克隆抗體/PDA/ZnO/FTO電極分別浸泡于濃度為0pg/mL、0.01pg/mL、0.1pg/mL、1pg/mL、10pg/mL、100pg/mL、500pg/mL、1000pg/mL、5000pg/m的小鼠IgG溶液中,反應1h后TBS洗液、二次水依次沖洗后再次記錄瞬態電流I,對兩次瞬態電流曲線中的光電流的減少比值即(I0-I)/I0進行比較分析,結果如圖9所示,由圖9可知,該光電免疫傳感器對小鼠IgG的最低檢測線為100pg/mL,在抗體濃度為100pg/mL-5000ng/mL范圍內呈線性分布。
本發明中的光電免疫傳感器不僅可以用于蛋白質的檢測,還可以用于他生物分子如DNA、細胞等的檢測。
最后說明的是,以上優選實施例僅用以說明本發明的技術方案而非限制,盡管通過上述優選實施例已經對本發明進行了詳細的描述,但本領域技術人員應當理解,可以在形式上和細節上對其作出各種各樣的改變,而不偏離本發明權利要求書所限定的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種石墨烯電極的制備方法與流程
- 電摻雜有機半導體材料和包含它的有機發光器件的制造方法與工藝
- 一類高熒光量子效率芴基給受體H型分子材料及其制備方法和應用與制造工藝
- 聚多巴胺修飾n型半導體材料在構建光電免疫傳感器中的應用的制造方法與工藝
- 高分子化合物和使用該高分子化合物的有機半導體元件的制造方法與工藝
- EDOT官能化的共軛聚合物和包含其的光電探測器的制造方法與工藝
- 擴展的非線性并苯衍生物和它們作為有機半導體的用途的制造方法與工藝
- 苉衍生物、光電轉換材料及光電轉換元件的制造方法與工藝
- 基于二苯并呋喃基團n?型熱激發延遲熒光芳香膦氧主體材料、合成方法及其應用與制造工藝
- 一種4?溴螺環[芴?9,9’?氧雜蒽]的合成方法與制造工藝