一種煙草染色體顯微切割技術的制作方法
本發明涉及一種煙草染色體顯微切割技術,屬于生物技術領域。
背景技術:
植物根尖細胞有絲分裂及染色體制片技術:植物生長旺盛的分生組織如根尖、莖尖、幼葉等都在進行著有絲分裂。取這些組織為材料,經過固定后迅速殺死細胞,并使細胞內的物質和生活狀態得以保持,再經過解離、染色、壓片等過程,可以迅速地將細胞分散附著于載玻片和蓋玻片之間,在顯微鏡下就可以看到大量處于有絲分裂各個時期的細胞,并進行染色體觀察。分裂中期,各染色體的著絲粒排列在赤道面上,兩臂伸向赤道面的兩旁。紡錘體完全形成,其一端與染色體的著絲粒相連接,另一端集中于細胞的極處。中期染色體高度濃縮,具有各物種染色體的典型形態,是染色體觀察的最好時期。
植物染色體顯微切割技術:植物染色體顯微切割技術就是在顯微鏡下,主要采用微細玻璃針或激光對特定的染色體或染色體片段進行切割、分離,然后利用切割產物為模板進行外擴增,從而構建染色體或染色體區段特異性的DNA文庫,其優點是可以根據研究者的需要,分離到任意一條染色體或染色體片段,快速地建立相應的DNA文庫。
煙草根尖細胞壓片法染色體制片技術:取種子在室溫25℃條件下,搖床上水培振蕩萌發,待幼根長至1-3 mm時,轉移進行預處理,一般在材料進行有絲分裂高峰期前2-3 h,即8:30-11:30之間處理。預處理液一般有5種:對二氯苯飽和液;0.2%的秋水仙素;0.002 mol/L濃度的8-羥基喹啉溶液;5%的風油精溶液;20%的風油精溶液。預處理時間均為2 h,溫度20-25℃。棄處理液后,用乙醇、冰乙酸(3:1)固定材料24 h,在轉移至70%酒精溶液中,于0-4℃條件下儲存備用。制片材料取根尖分生組織部分,用60℃ 1mol/L HCl恒溫解離4-8 min,常規壓片法制片,鏡檢。
由于煙草染色體微小,細胞壁難以充分解離,該技術難以得到分裂相多、分散度高的制片,難以對染色體的數目和形態特征進行定量、定性表述,影響染色體切割。
玉米單染色體的分離:(1)染色體標本制備。取玉米種子于培養皿內25℃ 培養生根,待根長至1-2cm 時加少許自來水于培養皿內,沒過根尖,放于4℃冰箱內處理24 h。取根于95%乙醇中固定,置于-20℃過夜,然后換入70%乙醇中在-20℃保存待用。制備染色體標本時,取根尖于2%果膠酶與2%纖維素酶1:l混合液中37℃處理2.5h,常規壓片,卡寶品紅染色,液氮冰凍去蓋片,稍氣干后在無水乙醇中脫水2-5 min,立即用于顯微分離染色體。(2)染色體顯微分離。染色體制片在Olympus倒置顯微15×(目鏡)×40×(物鏡)明視野內找到目標染色體后,在該處加1滴無菌水,用自制的微細玻璃針挑取目的染色體。將粘在微細玻璃針尖上的染色體及針尖一同折斷于0.5ml Eppendorf管中,高速離心數秒,-20℃保存待用。
王百合單條染色體和染色體片段的分離:(1)染色體標本制備。取百合種子25℃下萌發。待約10 天后長出1-2cm根時,用0.017%的秋水仙素處理23 h,卡諾固定液(95%乙醇3:冰乙酸1)固定10min后轉入70%乙醇中4℃保存待用。取根于2% 果膠酶與2%纖維素酶1:1比率的混合液中37℃酶解3h,蒸餾水洗凈后取根尖分生組織少許,卡寶品紅染色、壓片。鏡檢后于液氮中速凍,用刀片揭掉蓋片。將含有材料的載片放人70%乙醇中脫水5 min,氣干后用于顯微操作。(2)染色體的切割。用自制的直徑1-2mm的玻棒,在Leitz拉針儀上或酒精燈微火上拉制尖端直徑1-3μm的微細玻璃針,并將其下彎約1 20°(指針尖與操縱桿之間的角度)。在Leitz顯微操作器( Code-No.93114)幫助下,于Leitz Laborlux 2 顯微鏡下10×(目鏡)×10×(物鏡)明視野內前后移動玻璃針尖切割百合染色體。(3)染色體和染色體片段的分離。在含有染色體和染色體片段的載片上滴加一小滴無菌水,用上述微細玻璃針輕輕觸動染色體和染色體片段。待染色體和染色體片段脫離載片后使其吸附在玻璃針尖上, 輕輕移動玻璃針尖出液面。將玻璃針尖折斷并將其及其上的染色體一起放人0.5ml的含有蛋白酶K反應液的Eppendorf管中,4℃保存備用。
水稻單染色體微分離:(1) 染色體標本制備。采用日本晴為背景的粳稻( O. sativa L. ssp. japonica)為材料。盆栽種植,待抽穗期葉耳間距為0cm左右時,取整穗在改良的卡諾固定液中(無水乙醇:冰醋酸=9:1)固定10min后轉入70%乙醇中4℃保存。取固定的小穗先在蒸餾水中低滲處理約10min,剝出花藥,先用一枚以卡寶品紅染色壓片。在顯微鏡下觀察是否處于減數分裂終變期或中期I,若處于此時期則把其余花藥也進行壓片,每個載玻片壓一枚花藥。制片過程中所用染色液及制片用具均經嚴格滅菌處理。(2)染色體的顯微分離。將制好的染色體標本用液氮冰凍后去掉蓋片,于無菌室中放置,待其氣干后在倒置顯微鏡(Olympus 1M )下用手工拉制的玻璃針(尖部直徑1- 3μm,向下彎曲120°)借助Leitz顯微操作器(Code-No. 933114)對識別的目的染色體進行前后左右的劃動,輕輕刮取。最后將粘有目標染色體的玻璃針尖折斷于含有20μl蛋白酶K (5 ng/μl,Sigma公司),1×T4 DNA連接酶緩沖液(Promega公司)配制的0.5 ml Eppendorf管中,12000 r/min離心數秒,-20℃保存待用。
現有的染色體切割技術主要采用ACAS570UVC紫外激光掃描共焦顯微系統、流式染色體分級器和玻璃針進行染色體切割、分離和收集研究,但這三種技術體系存在設備操作復雜、技術難度大、污染較重、被分離的目標染色體難以完全回收等重要問題。
技術實現要素:
本發明要解決的技術問題是:建立易于操作、目標染色體完全回收且無污染的,基于染色體去壁低滲法制片技術的煙草高效準確的激光顯微切割技術。
本發明的技術方案是:一種煙草染色體顯微切割技術,包含以下步驟:(1)染色體標本制備:煙草成熟飽滿種子在蒸餾水浸泡后,播種在潮濕濾紙上,放置于培養皿內萌發;待根長至0.5-1 cm時,于上午9:00-11:00間剪取新鮮根尖,將其置入飽和α-溴奈溶液室溫預處理;蒸餾水清洗,經卡諾I氏固定液固定過夜;蒸餾水清洗后,置入蒸餾水低滲1h,用3%纖維素-果膠酶混合酶液在37℃條件下處理2.5 h,清洗,置入蒸餾水低滲60min;剪取1-2mm根尖分生組織于潔凈玻片上,滴加卡諾I氏固定液,將材料壓碎涂布并除去大組織殘渣,然后加卡諾I氏固定液,微烤至干;Giemsa染液染色,然后沖洗去除染色液,鏡檢良好中期相標記,激光顯微切割備用;(2)染色體顯微切割:將制備好的染色體標本片放在激光顯微切割系統載物臺上,分別在10倍、20倍、40倍和100倍物鏡下選擇目標染色體后,設置目標染色體的切割路線,將具黏性管蓋的離心管安裝在激光顯微切割系統自動回收裝置上;設置切割激光的能量、切割速度、回收彈射激光的能量,進行染色體切割;切割后的目標染色體被回收彈射激光彈射至回收離心管的黏性管蓋上;向捕獲目標染色體的離心管中加入蛋白酶K反應液,置于37℃水浴中溫浴4h,然后75℃20min使蛋白酶K失活,-20℃存放備用。
所述的卡諾I氏固定液組分為乙醇︰冰醋酸=3:1。
所述的培養皿底鋪上濾紙。
所述的煙草成熟飽滿種子在40-50℃進行浸泡40-50min。
所述的切割激光的能量設置為40-50,切割速度設置為70-80,回收激光能量設置為50-60。
本發明的有益效果:
1. 采用去壁低滲法獲得的煙草染色體制片,中期分裂相多、分散度高,中期染色體清晰;
2.用3%纖維素-果膠酶混合酶液在37℃條件下處理2.5 h,并在酶解處理前后經蒸餾水低滲處理;這一處理讓細胞充分吸脹大,有利于良好的染色體標本制備,成功切割。向捕獲目標染色體的離心管中加入蛋白酶K反應液,置于37℃水浴中溫浴4h,充分消化去蛋白。
3. 染色體切割回收采用了PALM公司的LMPC(激光彈射收集)技術,對樣本進行主動收集。先切割目標,然后發射一個激光脈沖,把目標向上彈射,克服重力,進入收集裝置;
4. 染色體切割回收整個過程簡單,沒有任何機械接觸,無污染、無熱損傷,不需要特殊耗材;
5. 染色體可在熒光環境進行切割。
附圖說明
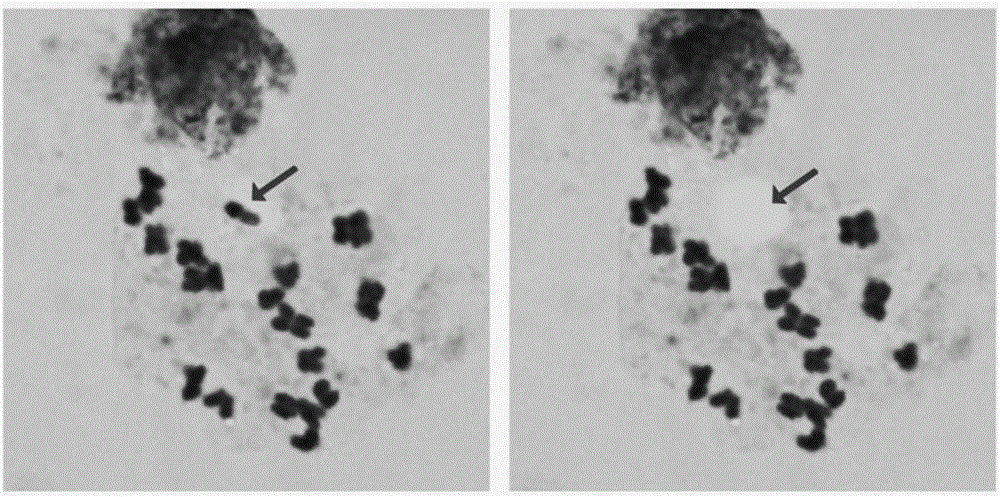
圖1為煙草(N. alata)中期染色體細胞相單染色體顯微切割前后;
圖2為Zeiss PALM MicroBeam激光顯微切割回收原理。
具體實施方式
實施例1:
(1)染色體標本制備:煙草成熟飽滿種子在40℃蒸餾水浸泡50min后,播種在潮濕濾紙上,放置于培養皿內(培養皿底鋪上一張濾紙,保持濕潤),于26℃條件下萌發。待根長至0.5-1 cm時,于上午9:00-11:00間剪取新鮮根尖,將其置入飽和α-溴奈溶液室溫預處理5h。蒸餾水清洗3次,經卡諾I氏固定液(乙醇︰冰醋酸=3:1)固定過夜。蒸餾水清洗3次后,置入蒸餾水前低滲1h,用3%纖維素-果膠酶混合酶液在37℃條件下處理2.5 h,清洗3次后,置入蒸餾水后低滲60 min。剪取1-2mm根尖分生組織于潔凈玻片上,滴加1滴固定液,用鑷子迅速將材料壓碎涂布并除去大組織殘渣。然后加固定液,將玻片的一端抬起使懸液迅速擴散,在酒精燈上微烤至干。Giemsa染液染色30mins,然后經自來水沖洗去除染色液,鏡檢良好中期相標記,激光顯微切割備用。
(2)染色體顯微切割:將制備好的染色體標本片放在Zeiss PALM MicroBeam激光顯微切割系統載物臺上,分別在10倍、20倍、40倍和100倍物鏡下選擇目標染色體后,PALM RoboSoftware 4.5軟件圖畫工具(Graphic Tools)設置目標染色體的切割路線,將具黏性管蓋的離心管安裝在激光顯微切割系統自動回收裝置上(PALM RoboMover CapMover)。切割(Cut)激光的能量、切割速度(Cut Speed)、回收彈射(LPC)激光的能量、拍照、保存等均通過PALM RoboSoftware 4.5軟件設置完成。切割激光的能量設置為40,切割速度設置為80,回收激光能量設置為60。切割回收染色體后的黏性離心管加入蛋白酶K反應液,置于37℃水浴中溫浴4h,以便蛋白酶K充分消化去蛋白,然后75℃20min使蛋白酶K失活,-20℃存放備用。
- 還沒有人留言評論。精彩留言會獲得點贊!