檢測三聚氰胺殘留的熒光微球免疫層析試紙條及其制備方法和應用與流程
本發明屬于食品安全中非法添加物檢測領域,具體涉及一種檢測樣品中三聚氰胺殘留的熒光微球免疫層析試紙條及其制備方法和應用。
技術背景
三聚氰胺簡稱三胺,化學名1,3,5-三嗪-2,4,6-三氨,分子式為C3N6H6,相對分子質量為126.12,是一種低毒無味的純白色單斜棱晶體,廣泛應用于涂料、建材、造紙、皮革、紡織等行業中。由于三聚氰胺的含氮量高達66%,是蛋白質平均含氮量的4倍,而常用的凱氏定氮法測定樣品中的蛋白質含量時卻不能區分這種非蛋白氮,因此被不法商販利用添加在飼料和食品中以提高食品和飼料中粗蛋白質檢測數值。動物實驗表明,三聚氰胺對于哺乳動物屬于微毒、低毒類化學物質,長期飼喂可能造成生殖、泌尿系統的損害,膀胱、腎部出現結石,并可進一步誘發膀胱癌。聯合國負責食品安全標準的機構國際食品法典委員會2010年7月6日表示,該委員會已就食品中三聚氰胺的允許含量設立了新標準。新標準規定,每千克嬰兒配方奶粉中的三聚氰胺含量不能超過1mg,而每千克其他食品或動物飼料中的三聚氰胺含量不能超過2.5mg。因此,加強對三聚氰胺檢測技術的研究和快速檢測技術的發展是非常有必要的。
目前,檢測三聚氰胺比較經典的方法有高效液相色譜法(HPLC)、液相色譜-質譜/質譜法(LC-MS/MS)、氣相色譜-質譜聯用法(GC-MS)等,這些都是比較傳統的方法,也是目前的確證方法。另外,目前常用的還有酶聯免疫法(ELISA)。但由于以上方法均需先進檢測儀器,檢測費用昂貴、步驟繁瑣耗時,且對操作人員專業性要求較高,不適用于基層企事業單位的大通量快速篩查檢測。膠體金免疫層析法具有檢測速度快、價格便宜、操作簡單等優點,是目前國內外檢測三聚氰胺的主要監控方法,但仍存在一些缺陷,如穩定性較差、靈敏度較低、無法實現定量檢測、基質效應明顯背景干擾大,且顏色單一,難以實現多檢和聯檢。
熒光微球免疫層析技術是繼膠體金免疫層析技術后,在熒光染料標記技術上發展起來的,作為一種免疫學檢測方法,它是免疫親和技術、免疫標記技術、免疫層析技術的結合,與膠體金免疫層析技術一樣具有快速、操作簡便等優點。但是相比膠體金等傳統標記物,熒光微球的發光強度可以隨激發光的強度增強而增強,所以熒光微球標記有望提高免疫層析技術的檢測限;而在微球殼結構的作用下,熒光微球具有相對穩定的形態結構,粒度均一、單分散性好、穩定性好、發光效率高、重復性好,有較好的生物相容性;且形成微球后染料熒光猝滅大大減少,發射強而穩定,且基本不受外界環境介質變化的影響。因此相比上述檢測方法,熒光微球免疫層析技術同時具有檢測靈敏度高、操作簡便的優點。
技術實現要素:
本發明的一個目的是針對上述現有技術的缺陷,提供一種靈敏度高、操作簡便、檢測快速、價格低廉的檢測三聚氰胺殘留的熒光微球免疫層析試紙條;本發明的另一個目的是提供上述試紙條的制備方法;本發明的再一個目的是提供上述試紙條在檢測三聚氰胺中的應用。
為了實現上述目的,本發明采取的一個技術方案是:
提供一種檢測三聚氰胺殘留的熒光微球免疫層析試紙條,它包括底板及在底板上依次搭接粘貼的樣品結合墊、硝酸纖維素膜和吸水墊,所述樣品結合墊上包埋有熒光微球標記的抗三聚氰胺單克隆抗體,所述硝酸纖維素膜上固定有檢測區和質控區,檢測區噴涂有三聚氰胺半抗原-載體蛋白偶聯物,質控區噴涂有羊抗鼠抗抗體。
所述三聚氰胺半抗原-載體蛋白偶聯物是由三聚氰胺半抗原與載體蛋白偶聯得到,所述載體蛋白為牛血清白蛋白、卵清白蛋白、血藍蛋白、甲狀腺蛋白或人血清白蛋白,所述三聚氰胺半抗原是由三聚氰胺與琥珀酰亞胺基丙醛反應得到,分子結構式為:
所述熒光微球是直徑為100~300nm的用聚苯乙烯包裹熒光物質的微球,其表面連接有—COOH基團,所述熒光物質為異硫氰酸熒光素。
本發明采取的另一個技術方案是提供一種制備上述檢測三聚氰胺殘留的熒光微球免疫層析試紙條的方法,它包括如下步驟:
1)樣品結合墊的制備:用市售的熒光微球標記抗三聚氰胺單克隆抗體,并將其以特定緩沖體系稀釋后,將樣品結合墊浸泡于稀釋緩沖液中,經真空冷凍干燥后制備;
2)硝酸纖維素膜的制備:將三聚氰胺半抗原-載體蛋白偶聯物噴涂到硝酸纖維素膜上的檢測區范圍,制成檢測區;將羊抗鼠抗抗體噴涂到硝酸纖維素膜上的質控區范圍,制成質控區;
3)組裝和剪切:在底板上依次搭接地粘貼包埋有熒光微球標記抗三聚氰胺單克隆抗體的樣品結合墊、固定有檢測區和質控區的硝酸纖維素膜及吸水墊,并剪切成所需的寬度即為熒光微球免疫層析試紙條。
具體地說,步驟包括:
1)將三聚氰胺與琥珀酰亞胺基丙醛反應,制備三聚氰胺半抗原;
2)將三聚氰胺半抗原與載體蛋白偶聯,制備三聚氰胺半抗原-載體蛋白偶聯物;
3)用三聚氰胺半抗原-載體蛋白偶聯物免疫小鼠,將小鼠脾細胞和小鼠骨髓瘤細胞通過融合、篩選,得到分泌三聚氰胺單克隆抗體的雜交瘤細胞株;
4)提取小鼠IgG免疫健康山羊,得到羊抗鼠抗抗體;
5)分別將三聚氰胺半抗原-載體蛋白偶聯物和羊抗鼠抗抗體噴涂到硝酸纖維素膜的檢測區范圍(T)和質控區范圍(C);
6)將樣品結合墊用含牛血清白蛋白(牛血清白蛋白在緩沖體系中的終濃度為0.5%體積百分含量)、pH7.2、0.1mol/L的磷酸鹽緩沖液均勻浸泡2h,37℃下烘干2h;
7)用市售的熒光微球標記抗三聚氰胺單克隆抗體,并將其以特定緩沖體系稀釋后,將6)處理過的樣品結合墊浸泡于稀釋緩沖液中,經真空冷凍干燥后備用;
8)在底板上依次搭接地粘貼包埋有熒光微球標記抗三聚氰胺單克隆抗體的樣品結合墊、固定有檢測區和質控區的硝酸纖維素膜及吸水墊,并剪切成所需的寬度即為熒光微球免疫層析試紙條。
本發明采取的另一個技術方案是提供一種上述檢測三聚氰胺殘留的熒光微球免疫層析試紙條在檢測三聚氰胺中的應用,它包括如下步驟:
1)樣品前處理;
2)用所述的檢測三聚氰胺殘留的熒光微球免疫層析試紙條進行檢測;
3)用熒光檢測儀分析檢測結果。
與現有技術相比,本發明具有以下有益效果:
(1)特異性強、靈敏度高:本試紙條采用將熒光微球標記的抗三聚氰胺單克隆抗體包埋在樣品結合墊上,具有親水性佳、可大容量吸附抗體偶聯物、迅速重濕潤、抗體結合物釋放充分、性能好、釋放快、形態好等優勢,從而減少誤差,降低成本,增加整個體系的反應靈敏度;
(2)熒光微球表面包裹了聚苯乙烯,實現了對熒光物質異硫氰酸熒光素的保護,減少了外界環境的干擾,增加了熒光微球的穩定性及熒光壽命;
(3)熒光微球表面修飾活性基團—COOH,采用化學偶聯的方法來標記抗體,形成抗體與微球的穩定結合。
附圖說明
圖1為熒光微球免疫層析試紙條剖面結構示意圖;
圖2為熒光微球免疫層析試紙條俯視圖;
圖3為三聚氰胺半抗原合成路線圖;
圖4為三聚氰胺半抗原核磁共振氫譜圖。
具體實施方式
下面結合實施例及附圖對本發明做進一步詳細的描述,但本發明的實施方式不限于此。
實施例1檢測三聚氰胺殘留的熒光微球免疫層析試紙條的構成
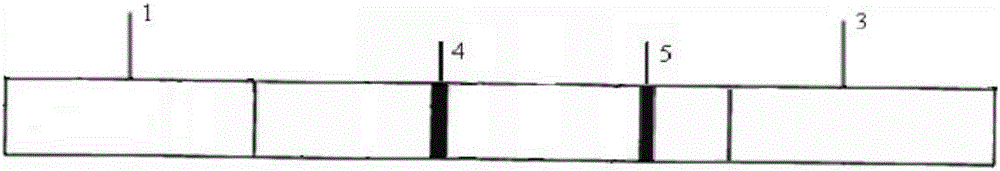
所述試紙條(圖1、圖2)是由底板、樣品結合墊、硝酸纖維素膜和吸水墊組成;
所述樣品結合墊1、硝酸纖維素膜2和吸水墊3依次按順序搭接粘貼在底板6上,樣品結合墊的末端與硝酸纖維素膜的始端相連,硝酸纖維素膜的末端與吸水墊的始端相連,樣品結合墊的始端與底板的始端對齊,吸水墊的末端與底板的末端對齊;
所述硝酸纖維素膜上固定有檢測區4和質控區5,檢測區噴涂有三聚氰胺半抗原-載體蛋白偶聯物(三聚氰胺半抗原-卵清白蛋白偶聯物),質控區噴涂有羊抗鼠抗抗體;
所述底板為PVC底板;所述樣品結合墊為玻璃棉;所述吸水墊為吸水紙。
實施例2檢測三聚氰胺殘留的熒光微球免疫層析試紙條的制備
檢測三聚氰胺殘留的熒光微球免疫層析試紙條的制備方法主要包括以下步驟:
1)樣品結合墊的制備:用市售的熒光微球標記抗三聚氰胺單克隆抗體,并將其以特定緩沖體系稀釋后,將樣品結合墊浸泡于稀釋緩沖液中,經真空冷凍干燥后制備;
2)硝酸纖維素膜的制備:將三聚氰胺半抗原-載體蛋白偶聯物噴涂到硝酸纖維素膜上的檢測區范圍,制成檢測區;將羊抗鼠抗抗體噴涂到硝酸纖維素膜上的質控區范圍,制成質控區;
3)組裝和剪切:在底板上依次搭接地粘貼包埋有熒光微球標記抗三聚氰胺單克隆抗體的樣品結合墊、固定有檢測區和質控區的硝酸纖維素膜及吸水墊,并剪切成所需的寬度即為熒光微球免疫層析試紙條。
下面分步詳細敘述:
(一)各部件的制備
1、三聚氰胺半抗原-載體蛋白偶聯物的合成與鑒定
三聚氰胺是小分子物質,只有免疫反應性,沒有免疫原性,不能誘發機體產生免疫應答,必須與大分子載體蛋白偶聯后才具有免疫原性。
(1)三聚氰胺半抗原的制備(圖3)
取三聚氰胺0.5g,加乙醇80mL溶解,加琥珀酰亞胺基丙醛0.67g,加三乙胺0.1mL,60℃油浴加熱,攪拌反應4h。停止反應冷卻到室溫,轉入0~5℃低溫下平衡溫度30min,攪拌,加硼氫化鈉0.3g,繼續攪拌2h。停止反應,旋蒸,除去乙醇,加水,乙酸乙酯,萃取,無水硫酸鈉干燥蒸干,上硅膠柱進行層析純化,洗脫液二氯甲烷/甲醇(v/v,10/1)洗脫分離,得到半抗原產物0.91g,收率87.19%。1H NMR(CDCl3,300MHz)δ:6.99(4H,s),6.94(2H,s),4.40(2H,t),4.0(1H,s),3.35(2H,t,J=7.500),1.83(1H,m,J=7.017)。
取上述產物經核磁共振氫譜測定,如圖4所示,圖譜中化學位移δ=4.40、3.35、1.83的為半抗原間隔臂上亞甲基氫共振吸收峰,δ=6.94的為間隔臂上雙鍵氫的共振吸收峰,這些峰的存在,證明半抗原合成成功。。
(2)免疫原的制備
取牛血清白蛋白(BSA)50mg,加pH值為4.5的醋酸鹽緩沖液5mL,溶解,加50mmol/L二硫蘇糖醇(DTT)0.2mL,室溫攪拌過夜,用1mol/L NaOH溶液調節pH到7.4,得到蛋白活化液A液;取4mg三聚氰胺半抗原產物,加甲醇0.2mL溶解澄清,得到B液;將B液逐滴加到A液中,繼續攪拌5h,停止反應,0.02mol/L PBS緩沖液透析純化3d,每天換液3次,得到免疫原,分裝,-20℃保存備用。
(3)包被原的制備
取卵清白蛋白(OVA)50mg,加0.05mol/L的磷酸鹽緩沖液5mL,溶解,加50mmol/L DTT 0.2mL,室溫攪拌過夜,得到蛋白活化液A液;取3mg三聚氰胺半抗原產物,加乙醇100μL溶解,得到B液;將B液滴加到A液中,室溫攪拌5h,0.02mol/L PBS緩沖液透析純化3d,每天換液3次,得到包被原,分裝,-20℃保存備用。
(4)三聚氰胺半抗原-載體蛋白偶聯物的鑒定
將三聚氰胺半抗原、載體蛋白、三聚氰胺半抗原-載體蛋白偶聯物用pH7.4的PBS緩沖液配成0.5mg/mL的溶液,以0.01mol/L pH7.4的PBS緩沖液調零,用紫外分光光度計在波長200~800nm范圍內掃描,得到三聚氰胺半抗原、載體蛋白、三聚氰胺半抗原-載體蛋白偶聯物的吸收曲線。三者出現不同的吸收曲線,表明三聚氰胺半抗原與載體蛋白偶聯成功。
2、三聚氰胺單克隆抗體的制備
(1)動物免疫
將步驟1得到的免疫原注入Balb/c小鼠體內,免疫劑量為150μg/只,使其產生抗血清。
(2)細胞融合和克隆化
取產生特異性抗體的Balb/c小鼠脾細胞與骨髓瘤細胞SP20融合,采用間接競爭酶聯免疫分析方法測定細胞上清液,篩選陽性孔。利用有限稀釋法對陽性孔進行克隆化,得到并建立產單克隆抗體的雜交瘤細胞株。
(3)細胞凍存和復蘇
取處于對數生長期的雜交瘤細胞用凍存液制成細胞懸液,分裝于凍存管,在液氮中長期保存。復蘇時取出凍存管,立即放入37℃水浴中速融,離心去除凍存液后,移入培養瓶內培養。
(4)單克隆抗體的制備與純化
采用體內誘生法,將Balb/c小鼠(8周齡)腹腔注入滅菌石蠟油,7~14天后腹腔注射雜交瘤細胞,7~10天后采集腹水。經辛酸-飽和硫酸銨法進行腹水純化,純度經SDS-PAGE電泳鑒定,小瓶分裝,-20℃保存。
3、羊抗鼠抗抗體的制備
以羊作為免疫動物,以鼠源抗體為免疫原對無病原體羊進行免疫,得到羊抗鼠抗抗體。
4、熒光微球標記抗三聚氰胺單克隆抗體的制備
(1)活化:取市售的內部包埋熒光染料、表面修飾有羧基官能團的微球懸液100μL混懸于900μL活化緩沖液中,于4℃10000r/min離心10min后棄上清,重懸微球于1mL活化緩沖液中,以此法洗滌微球2次,加入適量活化劑,混勻后室溫震蕩活化10min;
(2)偶聯:將(1)所述混懸液于4℃10000r/min離心10min后棄上清,重懸于偶聯緩沖液中,以此法洗滌微球2次,加入10~20μL抗三聚氰胺單克隆抗體溶液(蛋白濃度1mg/mL),混勻后室溫震蕩偶聯120min;
(3)封閉:將(2)所述混懸液于4℃10000r/min離心10min后棄上清,重懸于封閉緩沖液中,以此法洗滌微球1次,混勻后室溫震蕩封閉30min;
(4)貯存:將(3)所述混懸液于4℃10000r/min離心10min后棄上清,重懸于貯存緩沖液中,以此法洗滌微球1次,混勻后于4℃避光保存。
所述活化緩沖液為pH 5.5~6.5、0.05mol/L的2-(N-嗎啡啉)乙磺酸(MES)緩沖液。
所述活化劑為水溶性碳二亞胺,其中摩爾質量比EDC∶NHS∶COOH=(1.5~3)∶(8~20)∶1,臨用前用活化緩沖液稀釋至所需濃度。
所述偶聯緩沖液為pH 7.5~8.5、0.05mol/L的硼酸鹽緩沖液(避免使用存在游離胺的溶劑)。
所述封閉緩沖液為含0.1~0.4mol/L伯胺(鹽酸羥胺、乙醇胺或氨基乙醇)、1%~10%BSA的pH 7.4的PB緩沖液。
所述貯存緩沖液為含0.01%NaN3、0.1%BSA的pH 7.4的PB緩沖液。
5、樣品結合墊的制備
(1)將樣品結合墊用含牛血清白蛋白(BSA在緩沖體系中的終濃度為0.5%體積百分含量)、pH7.2、0.1mol/L的磷酸鹽緩沖液均勻浸泡2h,37℃下烘干2h;
(2)將貯存的熒光微球標記的抗三聚氰胺單克隆抗體以貯存緩沖液稀釋后,將(1)處理過的樣品結合墊浸泡于稀釋緩沖液中,經真空冷凍干燥后備用。
6、硝酸纖維素(NC)膜的制備
用0.05mol/L、pH7.2的PBS緩沖液將三聚氰胺半抗原-卵清白蛋白偶聯物稀釋到100μg/mL,用Isoflow點膜儀將其噴涂于NC膜上的檢測區(T),噴膜量為1.0μL/cm;用0.01mol/L、pH7.4的PBS緩沖液將羊抗鼠抗抗體稀釋到200μg/mL,用Isoflow點膜儀將其噴涂于NC膜上的質控區(C),噴膜量為1.0μL/cm。將制備好的NC膜置于37℃條件下干燥2h,備用。
(二)試紙條的組裝
將樣品結合墊、硝酸纖維素膜、吸水墊從左至右依次搭接粘貼固定在底板上,樣品結合墊的末端與硝酸纖維素膜的始端相連,硝酸纖維素膜的末端與吸水墊的始端相連,樣品結合墊的始端與底板的始端對齊,吸水墊的末端與底板的末端對齊,然后用機器切成3.96mm寬的小條,裝在特制的塑料制卡中,形成試紙卡。三聚氰胺熒光微球免疫層析試紙卡在2~8℃陰涼避光干燥保存,有效期為12個月。
實施例3檢測三聚氰胺殘留的熒光微球免疫層析試紙條的應用
1、樣品前處理
將待檢牛奶樣品置于60~70℃水浴5min,取出,待檢。
2、用試紙條檢測
吸取100μL待檢樣本溶液垂直滴加于試紙卡加樣孔中,液體流動時開始計時,反應10min;將試紙卡插入KFT-100A型熒光檢測儀的承載器中,通過觸摸顯示屏選擇待檢項目,按下“開始檢測”按鍵,熒光檢測儀將自動對試紙卡進行掃描測試;通過儀器的顯示屏幕上讀取或打印檢測結果。
3、檢測結果分析
測試完成后,儀器將根據檢測得到的熒光信號的強弱,自動計算出牛奶樣本中三聚氰胺的濃度值,并根據預設的閾值給出陰陽性判斷。
陰性(-):若熒光檢測儀的顯示屏幕上結果顯示為陰性,表示樣本中不含有三聚氰胺或其濃度低于檢測限。
陽性(+):若熒光檢測儀的顯示屏幕上結果顯示為陽性,表示樣本中三聚氰胺濃度等于或高于檢測限。
無效:若質控區未檢出熒光信號強度,表明不正確的操作過程或試紙卡已失效。
實施例4檢測三聚氰胺殘留的熒光微球免疫層析試紙條技術參數的確定
1、檢測限試驗
向空白牛奶樣品中分別添加三聚氰胺標準品至終濃度為0、5.0、10、20μg/L,用試紙條進行檢測,結果為:當三聚氰胺標準品濃度為0、5.0μg/L時,熒光檢測儀結果顯示為陰性;當三聚氰胺標準品濃度為10、20μg/L時,熒光檢測儀結果顯示為陽性,表明本試紙條對牛奶樣品中三聚氰胺的檢測限為10μg/L。
2、假陽性率、假陰性率試驗
取已知三聚氰胺含量大于10μg/L的陽性牛奶樣本和三聚氰胺含量小于10μg/L的陰性牛奶樣本各20份,用3個批次生產的熒光微球免疫層析試紙條分別進行檢測,計算其陰陽性率。結果見表1。
表1檢測陽性、陰性樣本結果
結果表明:用3個批次生產的試紙條檢測陽性樣本時,結果全為陽性,可知陽性符合率為100%,假陰性率為0;檢測陰性樣本時,結果全為陰性,可知陰性符合率為100%,假陽性率為0。說明本發明的檢測三聚氰胺殘留的熒光微球免疫層析試紙條可以對牛奶樣品中三聚氰胺殘留進行快速檢測。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 基于量子點的CA15?3免疫層析試紙條的制備方法與制造工藝
- 肌紅蛋白熒光免疫層析試紙條用活化熒光乳膠微球及應用的制造方法與工藝
- 鐵蛋白熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 全程C?反應蛋白熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 一種微流控芯片上基于熒光量子點磁性富集并分離結核分枝桿菌TB的方法及裝置與制造工藝
- 25?羥基維生素D熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 25?羥基維生素D3熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 降鈣素原熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 一種改變量子點熒光色的方法與制造工藝
- 一種基于熒光免疫層析技術的定量檢測計算方法與制造工藝
- 一種基于碳量子點的熒光面料及其制備方法與制造工藝
- 基于量子點的CA15?3免疫層析試紙條的制備方法與制造工藝
- 肌紅蛋白熒光免疫層析試紙條用活化熒光乳膠微球及應用的制造方法與工藝
- 鐵蛋白熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 全程C?反應蛋白熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 一種微流控芯片上基于熒光量子點磁性富集并分離結核分枝桿菌TB的方法及裝置與制造工藝
- 25?羥基維生素D熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 25?羥基維生素D3熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 降鈣素原熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 一種改變量子點熒光色的方法與制造工藝