一種復合型納米結構拉曼增強基底、制備方法及應用與流程
本發明涉及一種多層復合型納米結構拉曼增強基底、制備方法及應用于對1,4-苯二甲硫醇、孔雀石綠等進行定量檢測,屬于納米結構基底的制備及檢測應用技術領域。
背景技術:
1974年,英國南安普頓大學Fleischmann等通過電化學氧化還原法對銀電極進行粗糙化處理,獲得了吡啶分子吸附在粗糙銀電極表面高質量的拉曼光譜。后經Van Duyne和Creighton等人通過詳細的實驗和理論研究,將此現象定義為表面增強拉曼散射(Surface enhanced Raman scattering, SERS)效應。自該現象被發現40多年以來,隨著納米技術、激光技術、檢測技術、儀器結構優化等各方面的進步,SERS已經在分析檢測、界面科學、環境監測、生物醫學等領域獲得了廣泛的應用。其SERS基底,也已經從傳統的金、銀、銅等貴金屬拓展到過渡金屬、金屬氧化物等;納米基底的維度包括零維、一維、二維;納米基底的形貌包括球形、立方體、長方體、棒狀、八面體、三棱錐等;納米基底的結構也發展了核殼、合金、超組裝結構等。SERS的檢測對象囊括了固體、液體、氣體,檢測體系包括常溫常壓、高溫高壓,甚至是超高真空體系。因此,SERS已經引起了化學家、物理學家、甚至是生物及醫藥研究者們的極大興趣,使眾多科學領域的實驗和理論研究空前活躍。
可以發現,目前對SERS的很多研究僅僅限定在定性或半定量分析,在定量分析方面的獲得成功的工作較少,這與SERS技術本身的特點有關。一般認為,SERS極高的增強效應得益于基底表面的熱點(hot spots),若分子處在該熱點區域內,分子的散射信號將被放大幾個甚至十幾個數量級。因此,熱點在基底上的均勻性分布顯得尤為重要。但是由于納米結構的復雜性,導致基底的不同區域采集到的信號存在很大的差異,有時能達到幾個數量級,這些技術上的局限性使SERS的定量應用受到限制。
也有一些科學家在SERS的定量化研究中做了較多的工作(參見文獻:Bell S.E.J., Sirimuthu N.M.S. Chem. Soc. Rev., 2008, 37, 1012–1024)。主要集中在均勻基底的制備、內標標識等方面。在均勻基底制備方面,Gwo課題組采用烷基硫醇作為修飾劑,形成了六方密堆積的銀納米粒子膜。該膜具有面積大,高度的均一性及高增強信號的特點,檢測限甚至可達單分子級別,他們以結晶紫為探針分子,結果表明,在一定的濃度范圍內,信號與濃度呈線性的響應(參見文獻:Chen H.Y., Lin M.H., et.al J. Am. Chem. Soc.2015, 137, 13698?13705)。Yao課題組利用吸附有聚乙烯吡咯烷酮的金納米粒子在氣液兩相成膜形成了大尺寸的金單層膜,可達厘米級。結果表明,該金膜的SERS活性、均勻性及穩定性均十分理想。(參見文獻:Guo Q.H., Xu M.M., Gu R.A., Yao J.L. Langmuir 2016, 32, 4530?4537)。Lei等利用納米印刷技術制備了大面積的聚苯乙烯小球陣列,在銀溶膠體系中采用電泳技術在聚苯乙烯小球陣列上涂覆上一層銀,形成銀納米殼層結構。該結構的直徑、表面粗糙度、間隙可控可調。(參見文獻:Yang S.K., Cai W.P., Kong L.C., Lei Y. Adv. Funct. Mater. 2010, 20, 2527?2533)。
內標法是分析化學中進行定量分析的常用方法。在待分析的體系中,加入一定量的內標物質,計算被分析的物質與內標物質之間的關系,以SERS為例,通常是兩種物質的SERS峰相對強度的大小,能推算出被分析物的濃度。Schultz 課題組結合了液相色譜的分離功能與SERS的高靈敏度的特點,利用乙腈作為內標分子實現了維生素B1,維生素B2與葉酸的在線分離與檢測。(參見文獻:Nguyen A., Schultz Z. D., Analyst 2016, 141, 3630?3635)。而Lu課題組則巧妙的利用牛奶自身的拉曼信號作為內標,利用SERS檢測牛奶中殘留的雙氰胺,結果表明其線性范圍為10-4~10-3 g·mL-1。(參見文獻:Nguyen A., Schultz Z. D., Analyst 2016, 141, 3630?3635)。
由此可見,即使存在SERS技術本身的難點,科學家們通過采用各種方法,依然鍥而不舍的追求如何使SERS技術在定量方面實現突破,以期能使SERS在更廣泛的科研領域及民用領域獲得進一步的應用。
技術實現要素:
本發明針對現有SERS技術在定量檢測方面存在的不足,提供一種具有良好的基底均勻性及內標物穩定性的復合型納米結構拉曼增強基底、制備方法及其應用。
實現本發明目的的技術方案是提供一種復合型納米結構拉曼增強基底的制備方法,利用現有技術,先在含有金納米粒子的金溶膠的氣液界面制備金納米粒子單層膜,再進行如下步驟的操作:
(1)采用垂直提拉法將金納米粒子單層膜轉移至單晶硅片上,在單晶硅片的表面覆蓋Au納米粒子單層膜;
(2)將Au納米粒子單層膜覆蓋的單晶硅片浸泡在濃度為10-2 ~10-3 mol·dm-3 的1,4-苯二硫醇(記作1,4-BDT)的乙醇溶液中,在Au納米粒子單層膜表面得到由1,4-苯二硫醇修飾的覆蓋膜;
(3)采用垂直提拉法,將步驟(2)得到的單晶硅片的表面再覆蓋一層Au納米粒子單層膜,形成以1,4-苯二硫醇單層膜為中間層,內、外層均為Au單層膜的“三明治”結構修飾的單晶硅片;
(4)采用真空熱蒸鍍儀在步驟(3)的“三明治”結構表面蒸鍍一層厚度為2~4 nm的三氧化鉬層,用于隔絕內層金屬與被檢測分子的直接接觸,防止發生內標分子與待測分子之間的競爭吸附,得到一種復合型納米結構拉曼增強基底。
本發明技術方案還涉及按上述制備方法得到的一種復合型納米結構拉曼增強基底。
本發明技術方案還包括所述復合型納米結構拉曼增強基底的應用,以1,4-苯二硫醇為內標物,其拉曼信號用于標定待測分子的濃度,將基底用于對待測分子的定量檢測。
所述復合型納米結構拉曼增強基底的具體應用包括:
(1)建立1,4-苯二甲硫醇(記作1,4-BDMT)濃度從10-6~10-3 mol·dm-3的濃度對數-信號相對強度的標準曲線,將基底用于對1,4-苯二甲硫醇的定量檢測。
(2)建立孔雀石綠(記作MG)濃度從10-9~10-6 mol·dm-3的濃度對數-信號相對強度的標準曲線,將基底用于對孔雀石綠的定量檢測。
中國發明專利CN103590037B公開了一種金納米粒子單層膜的制備方法及其裝置;包括金溶膠的制備、單層膜的形成、轉移和優化等步驟,先在含有金納米粒子的金溶膠的氣液界面制備金納米粒子單層膜,再運用垂直提拉法將金納米粒子單層膜轉移至固相基底上。該項發明通過調控金溶膠的單分散性,溶劑的揮發,設計界面單層膜的轉移等,獲得所需的金納米粒子單層膜。本發明利用氣液兩相法制備的單層金納米粒子膜具有均勻性好、易轉移至固相基底等優點,以較為穩定的常用SERS探針,1,4-BDT為內標分子,通過采用Au膜-1,4-BDT-Au膜-Au膜的“三明治”方式,實現了內標分子的固定;同時,在外層金膜表面進行可控蒸鍍超薄氧化層,杜絕分子之間的相互干擾,尤其是競爭吸附。經測試,該種復合型基底可同時獲得內標與被檢測分子的特征光譜信號,在一定的濃度范圍內,其特征峰相對強度的大小與濃度的對數呈線性關系。采用本發明技術方案可利用SERS進行定量化檢測。
本發明的原理是:通過設計一種復合型納米結構拉曼增強基底,選擇合理的內標分子,使其固定在兩層致密、均勻的金單層膜之間,利用內標分子的特征峰與被測分子的特征峰之間的相對強度關系,在一定的濃度范圍內,建立了待測分子SERS相對信號強度與濃度對數之間的關系曲線,可應用于具有較強吸附能力的分子的定量檢測,如對1,4-BDMT的可檢測范圍為10-6~10-3 mol·dm-3,MG分子的檢測范圍為10-9~10-6 mol·dm-3。
本發明與現有技術相比,具有如下優點:
1、本發明采用兩層金單層膜固定內標分子,使內標分子在待測分子吸附時不脫附;采用超薄氧化物層隔絕內標分子與被測分子,使兩種分子不發生競爭吸附,從而保證內標分子的穩定性。
2、本發明結合了均勻基底及固定內標這兩種定量化實驗的技術手段,發揮了基底均勻性及內標穩定性的各自優勢,可實現SERS的定量化檢測。
3、本發明所提供的制備增強拉曼基底的方法、工藝流程及操作步驟比較簡單,涉及的反應及檢測條件溫和。基底的制作成本低廉,可批量制作,具有推廣應用前景。
附圖說明
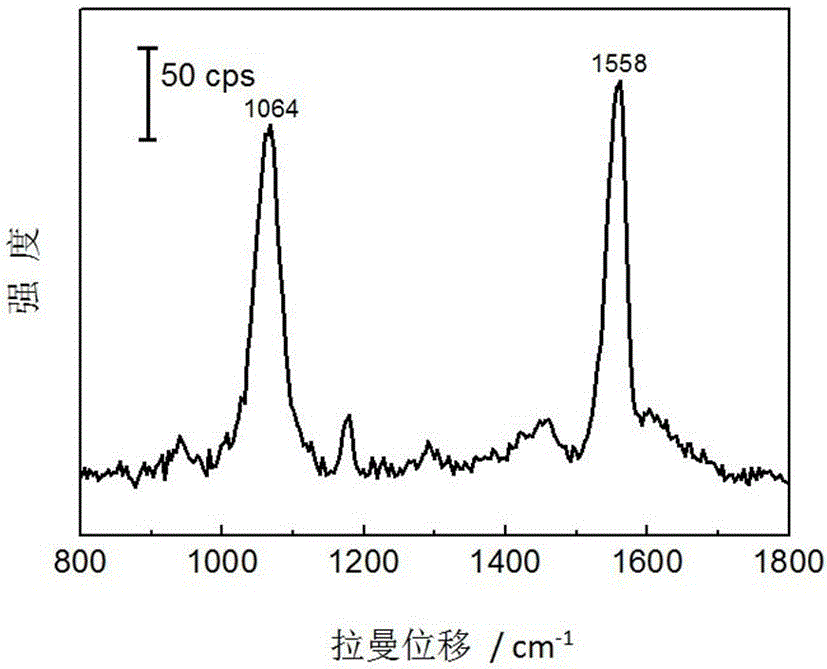
圖1為復合型納米結構拉曼增強基底中內標分子1,4-BDT的SERS光譜圖,分子組裝濃度為10-3 mol·dm-3。
圖2為本發明實施例1提供的內標1,4-BDT與不同濃度被測分子1,4-BDMT的混合SERS光譜圖。
圖3 為本發明實施例1中1603 cm-1 與1064 cm-1相對強度與分子溶液濃度對數的關系圖。
圖4為本發明實施例2提供的內標1,4-BDT與不同濃度被測分子MG的混合SERS光譜圖。
圖5 為本發明實施例2中1615 cm-1 與1064 cm-1相對強度與分子溶液濃度對數的關系圖。
具體實施方式
實施例1
1、Au單層膜的制備及轉移
本實施例按中國發明專利CN103590037B提供的裝置和方法,先在含有金納米粒子的金溶膠的氣液界面制備金納米粒子單層膜,再運用垂直提拉法將金納米粒子單層膜轉移至固相基底上,具體步驟如下:
(1)Au納米粒子膜的制備:三頸燒瓶中加入100 mL(0.25 mmol·dm-3)氯金酸溶液,加熱至沸,加入2 mL(0.01 g·mL-1)檸檬酸鈉溶液,保持沸騰15 min,得到15 nm金溶膠。取該溶膠25 mL,分別加入1 mL(0.01 g·mL)檸檬酸鈉溶液,1 mL(0.01 g·mL)PVP溶液和20 mL (2.5 mmol·dm-3)鹽酸羥胺溶液;攪拌下用注射泵以1 mL·min-1的速度滴加(2.5 mmol·dm-3)的氯金酸溶液20 mL,得到50 nm金溶膠。將該溶膠于40 ℃下放置10 h,可觀察到漂浮在氣液界面,致密光亮的金納米粒子單層膜。
(2)Au納米粒子膜的轉移:采用0.4 cm×0.4 cm的潔凈硅片垂直插入氣液界面,然后緩慢垂直提拉,即可將金納米粒子單層膜附著于硅片表面,隨著硅片逐漸離開氣液界面,可將整片硅片表面覆蓋上金膜。
2、內標分子的修飾
將按上述制備方法所得到的覆蓋有金膜的硅片浸泡在1,4-BDT的乙醇溶液中,形成1,4-BDT修飾的Au納米粒子單層膜覆蓋的單晶硅片。
3、二次轉移Au納米粒子膜
在步驟2修飾1,4-BDT后,采用與步驟1相同的提拉法,再次附上一層金膜,形成兩層金膜包夾1,4-BDT的“三明治”結構。
4、真空熱蒸鍍隔絕氧化層
采用熱蒸鍍儀在步驟3制備得到的“三明治”結構表面蒸鍍上一層厚度為2~4 nm的三氧化鉬層,可從物理上直接隔絕內外兩種分子可能發生的競爭吸附,從而保證內標分子的穩定性。至此,復合型納米結構拉曼增強基底制備完成。
5、內標分子的SERS檢測
對上述未添加被檢測分子的基底進行SERS檢測,可獲得內標1,4-BDT的信號。參見附圖1,為復合型納米結構拉曼增強基底中內標分子1,4-BDT的SERS光譜圖,分子組裝濃度為10-3mol·dm-3;如圖1所示,位于1064 cm-1處的為苯環的呼吸振動,本實施例中,將以此為特征峰,與被測分子的特征峰進行比較。
6、1,4-BDMT的SERS檢測及標準曲線的建立
本實施例提供一種對1,4-BDMT的檢測及標準曲線的建立方法,步驟如下:
(1)配制不同濃度的1,4-BDMT溶液:稱取1,4-BDMT 0.017 克,加乙醇10 mL溶解,形成濃度為10-2 mol·dm-3的乙醇溶液。從上述10 mL溶液中取出1 mL,用乙醇稀釋至10 mL, 形成10-3 mol·dm-3的乙醇溶液。從10 mL 10-3 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀釋至10 mL, 形成10-4 mol·dm-3的乙醇溶液。從10 mL 10-4 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀釋至10 mL, 形成10-5 mol·dm-3的乙醇溶液。從10 mL 10-5 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀釋至10 mL, 形成10-6 mol·dm-3的水溶液。從10 mL 10-6 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀釋至10 mL, 形成10-7 mol·dm-3的乙醇溶液。
(2)采用本實施例提供的復合基底,將上述配制的各種濃度的1,4-BDMT溶液濃度由低到高依次吸附,然后分別進行SERS檢測,獲得不同濃度1,4-BDMT溶液在該復合基底上SERS光譜,參見附圖2,為內標1,4-BDT與不同濃度被測分子1,4-BDMT的混合SERS光譜圖,圖中曲線(a)~(e)分別對應為1,4-BDMT的不同濃度:(a)為10-6 mol·dm-3、(b)為10-5 mol·dm-3、(c)為10-4 mol·dm-3、(d)為10-2 mol·dm-3和(e)為10-2 mol·dm-3。由于10-7 mol·dm-3的1,4-BDMT乙醇溶液中無法檢測到該分子的特征信號,因此,圖2中未包含該濃度以下的光譜;其中,位于1603 cm-1為1,4-BDMT分子苯環的碳碳伸縮振動峰,將1,4-BDT的1064 cm-1與1,4-BDMT的1603 cm-1相比較,建立了1,4-BDMT濃度的對數與兩特征峰相對強度之間的關系,參見附圖3,1,4-BDMT在10-6~10-3 mol·dm-3范圍內,其特征峰相對強度的大小與濃度的對數呈線性關系。
實施例2
1、Au單層膜的制備及轉移
(1)Au納米粒子膜的制備:三頸燒瓶中加入100 mL(0.25 mmol·dm-3)氯金酸溶液,加熱至沸,加入2 mL(0.01 g·mL-1)檸檬酸鈉溶液,保持沸騰15 min,得到15 nm金溶膠。取該溶膠25 mL,分別加入1 mL(0.01 g·mL)檸檬酸鈉溶液,1 mL(0.01 g·mL)PVP溶液和20 mL (2.5 mmol·dm-3)鹽酸羥胺溶液;攪拌下用注射泵以1 mL·min-1的速度滴加(2.5 mmol·dm-3)的氯金酸溶液20 mL,得到50 nm金溶膠。將該溶膠于40 ℃下放置10 h,可觀察到漂浮在氣液界面,致密光亮的金納米粒子單層膜。
(2)Au納米粒子膜的轉移:采用0.4 cm×0.4 cm的潔凈硅片垂直插入氣液界面,然后緩慢垂直提拉,即可將金納米粒子單層膜附著于硅片表面,隨著硅片逐漸離開氣液界面,可將整片硅片表面覆蓋上金膜。
2、內標分子的修飾
將步驟1所得到的覆蓋有金膜的硅片浸泡在1,4-BDT的乙醇溶液中,形成1,4-BDT修飾的Au納米粒子單層膜覆蓋的單晶硅片。
3、二次轉移Au納米粒子膜
在步驟2修飾1,4-BDT完成后,采用步驟1中相同的提拉法,再次附上一層金膜,形成兩層金膜包夾1,4-BDT的“三明治”結構。
4、真空熱蒸鍍隔絕氧化層
采用熱蒸鍍儀在步驟3的“三明治”結構表面蒸鍍上一層2~4 nm的三氧化鉬層,可從物理上直接隔絕內外兩種分子可能發生的競爭吸附,從而保證內標分子的穩定性。至此,復合型納米結構拉曼增強基底制備完成。
5、內標分子的SERS檢測
對按上述制備方法得到的基底在未添加被檢測分子的條件下進行SERS檢測,可獲得內標1,4-BDT的信號,如附圖1所示,位于1064 cm-1處的為苯環的呼吸振動,本實施例將以此為特征峰,與被測分子的特征峰進行比較。
6、MG的SERS檢測及標準曲線的建立
本實施例提供一種對MG的檢測及標準曲線的建立方法,步驟如下:
(1)不同濃度MG分子溶液的配制:稱取MG 0.0365 克,加水10 mL溶解,形成濃度為10-2mol·dm-3的水溶液。從上述10 mL溶液中取出10 μL,用水稀釋至10 mL, 形成10-5 mol·dm-3的水溶液。從10 mL 10-5 mol·dm-3的水溶液中吸取1 mL,用水稀釋至10 mL, 形成10-6mol?dm-3的水溶液。從10 mL 10-6 mol?dm-3的水溶液中吸取1 mL,用水稀釋至10 mL, 形成10-7 mol·dm-3的水溶液。從10 mL 10-7 mol·dm-3的水溶液中吸取1 mL,用水稀釋至10 mL, 形成10-8 mol·dm-3的水溶液。從10 mL 10-8 mol·dm-3的水溶液中吸取1 mL,用水稀釋至10 mL, 形成10-9 mol·dm-3的水溶液。
根據國標GB/T 19857-2005《水產品中孔雀石綠和結晶紫殘留量的測定》,其要求的檢測濃度為1 ppb,而經過濃度換算,10-9 mol·dm-3為0.364 ppb,已經低于國標,因此配制10-9 mol·dm-3為最低的截止濃度。
(2)采用該復合基底,將上述配制的各種濃度的MG溶液濃度由低到高依次吸附,然后分別進行SERS檢測,獲得不同濃度MG溶液在該復合基底上SERS光譜,參見附圖4,圖中,曲線(a)~(e)分別為不同濃度,對應為(a)10-9 mol·dm-3、(b)10-8 mol·dm-3、(c)10-7 mol·dm-3、(d)10-6 mol·dm-3和(e)10-5 mol·dm-3。其中,位于1615 cm-1為MG分子碳碳伸縮振動峰,將1,4-BDT的1064 cm-1與MG的1615 cm-1相比較,建立了MG濃度對數與兩特征峰相對強度之間的關系,參見附圖5,MG在10-9~10-6 mol·dm-3范圍內,其特征峰相對強度的大小與濃度對數呈線性關系。
- 還沒有人留言評論。精彩留言會獲得點贊!