一種用于測試動物A型口蹄疫的膠體金試紙及其制備方法與流程
本發明涉及血清學檢測技術領域,具體涉及一種用于測試動物A型口蹄疫的膠體金試紙及其制備方法。
背景技術:
FMD(foot and mouth disease,口蹄疫)是由FMDV(foot and mouth disease virus,口蹄疫病毒)感染偶蹄類動物后引起的一種急性、熱性、高度接觸性傳染病,家畜中的牛、豬、山羊、綿羊等均為易感動物,口蹄疫一旦爆發往往造成大流行,不易控制和消滅,給疾病流行國家和地區的畜牧業帶來嚴重的經濟損失。因此,世界動物衛生組織(OIE)將該病列在15個A類動物疫病之首,我國政府也將口蹄疫排在14個一類動物傳染病的第一位。
口蹄疫病毒病毒的基因組RNA全長約8.5kb,依次為5’UTR、ORF和3’UTR組成,起重ORF約6.5kb長,由L基因、P1結構蛋白基因、P2和P3非結構蛋白基因以及其始密碼子和終止密碼子組成。
口蹄疫病毒病毒的外殼為對稱的20面體,由衣殼蛋白VP1,VP2,VP3和VP4組成,這些衣殼蛋白決定了病毒的抗原性、免疫性和血清學反應能力。
目前已知的口蹄疫病毒病毒有7個血清型:O型、A型、C型、南非1型、南非2型、南非3型和Asia1型,同時,還包括65個以上的亞型。其中,A型口蹄疫病毒流行較為廣泛,是僅次于O型口蹄疫的主要流行毒株。
近年來,口蹄疫疫情頻繁發生且呈全球化流行的態勢,且A型口蹄疫多在我國周邊國家發生和流行,這不僅對世界畜產品經濟構成了巨大的威脅,而且引發了人們對食品安全等社會公共衛生問題的擔憂,造成發生疫情的國家及地區的畜產品貿易損失慘重。
目前口蹄疫抗體的檢測方法主要包括CFT(補體結合試驗)、VNT(人玻連蛋白)、凝集試驗、免疫擴散和ELISA(酶聯免疫吸附測定法)等,但是這些方法容易受到外部環境的干擾,需要在條件穩定的實驗室中進行檢測,檢測周期長,無法在現場進行實時快速的測定。
許多病毒的結構蛋白在不同的培養系統中具有組裝成重復序列或者病毒樣顆粒(virus-like particles,VLPs)的能力,這種VLPs不攜帶遺傳物質,因此不具有感染性,VLPs能夠重復并且高密度的展示抗原位點,能引起強烈的免疫反應。同時,一些病毒的VLPs與病毒的亞病毒粒子(subviral particles,SVPs)相似,能夠VLPs直接作為疫苗使用,除此之外,VLPs還能作為載體,插入外源的抗原位點形成嵌合型的VLPs,基于VLPs的上訴特征,口蹄疫病毒的VLPs成為目前口蹄疫檢測研究的熱點之一。
大腸桿菌表達系統具有易于培養,設備簡單且安全性高的優點,成為目前應用最為廣泛的基因工程表達系統之一,被廣泛應用于生物制藥行業中,但是,在大腸桿菌中采用單獨表達口蹄疫病毒外殼蛋白、或用不同質粒共轉染大腸桿菌獲得的基因工程菌的方法所表達的口蹄疫病毒外殼蛋白,不僅表達量非常低,而且常常不可溶,不能用于大規模商業應用,因此,采用傳統的大腸桿菌表達系統制備A型口蹄疫病毒的VLPs以用于檢測難以實現。
技術實現要素:
針對現有技術中存在的缺陷,本發明的目的在于提供一種用于測試動物A型口蹄疫的膠體金試紙及其制備方法,能夠縮短檢測周期,實現現場進行實時快速的測定。
為達到以上目的,本發明采取的技術方案是:
一種用于測試動物A型口蹄疫的膠體金試紙,包括底板,底板的頂部設置有檢測層,檢測層包括檢測線和對照線,檢測層的頂部靠近對照線的一側設置有吸收層,靠近檢測線的一側設置有免疫金標墊,免疫金標墊的頂部設置有樣品墊;
免疫金標墊上涂覆有膠體金顆粒,該膠體金顆粒上結合有SPA標記物,檢測線上涂覆/浸潤有A型口蹄疫病毒樣顆粒,對照線上涂覆/浸潤有兔IgG。
在上述技術方案的基礎上,所述免疫金標墊上膠體金與SPA的比例為2×104:1~2。
在上述技術方案的基礎上,所述免疫金標墊上膠體金與SPA的比例為2×104:1.3。
在上述技術方案的基礎上,所述免疫金標墊的吸附比例為10~50μL/cm。
在上述技術方案的基礎上,所述檢測線上涂覆/浸潤有濃度為0.5~1mg/mL的A型口蹄疫病毒樣顆粒。
在上述技術方案的基礎上,所述對照線上涂覆/浸潤有濃度為0.8~1.5mg/mL的免疫兔血清IgG。
一種用于測試動物A型口蹄疫的膠體金試紙的制備方法,包括以下步驟:
A、制備LgG,制備并純化膠體金,將膠體金與SPA按質量比為2×104:1~1.5反應,得到免疫膠體金,將濃度為1~1.2g/ml的免疫膠體金按吸附比為10~50μL/cm吸附在玻璃膜上,得到免疫金標墊;
B、使用硝酸纖維膜作為檢測層基材,在檢測線上噴涂濃度為0.5~1mg/mL的A型口蹄疫病毒樣顆粒,在對照線上噴涂濃度為0.8~1.5mg/mL的免疫兔血清IgG;
在檢測層的中部距檢測線0.3~1cm處,噴涂對照線,噴膜量為5~15μl/1cm進行噴膜,噴膜后干燥得到檢測層;
C、在底板1的頂部設置檢測層,并將檢測層;壓平,將吸收層一部分固定在底板上,一部分固定在檢測層;上靠近對照線的部分,將免疫金標墊的一側固定在底板上,另一側固定在檢測層;靠近檢測線的一側,樣品墊的一側固定在底板上,樣品墊的一側固定在底板上,另一側固定在免疫金標墊上。
在上述技術方案的基礎上,免疫金標墊的制備方法為:使用濃度為0.1M的K2CO3調整膠體金的pH值為5.9,按質量比為2×104::1~1.5將相應的SPA溶液加入膠體金中放置30min后,在轉速為10000r/min、溫度為4℃的條件下離心30min,將沉淀溶于重懸液中混合均勻,用玻璃膜吸附后晾干。
在上述技術方案的基礎上,所述檢測線上A型口蹄疫病毒樣顆粒的濃度為0.8mg/mL,所述對這線上免疫兔血清IgG的濃度為1mg/mL。
與現有技術相比,本發明的優點在于:
(1)本發明的一種用于測試動物A型口蹄疫的膠體金試紙,由于檢測層上設置有檢測線和對比線,且檢測線上涂覆/浸潤有濃度為0.5~1mg/mLA型口蹄疫病毒樣顆粒,對照線上涂覆/浸潤有濃度為0.8~1.5mg/mL兔IgG,在使用時,直接將血液樣品稀釋后在現場(溫度在0~35°均可)進行檢測,如果血液樣品中含有A型口蹄疫抗體,血液樣品中的抗體與免疫金標墊中SPA修飾的膠體金結合形成復合物,與檢測線上A型口蹄疫病毒樣顆粒結合形成紫紅色線條,繼續前行,未與抗原結合的抗體攜帶重組蛋白SPA與對照線中的IgG抗體形成紫紅色線條。
將檢測結果與常規的CFT、VNT凝集試驗、免疫擴散和ELISA進行比較,結果基本一致,且本發明的血液未經過純化,說明本發明的準確度較高,且檢測條件不高,穩定性較好,具有操作簡單、檢測快速、結果清楚,易于判斷和保存,且無需大型儀器設備,成本較低,能夠用于臨床快速實時檢測,快速檢測流行病,便于快速采取相應措施,避免疾病大規模爆發。
附圖說明
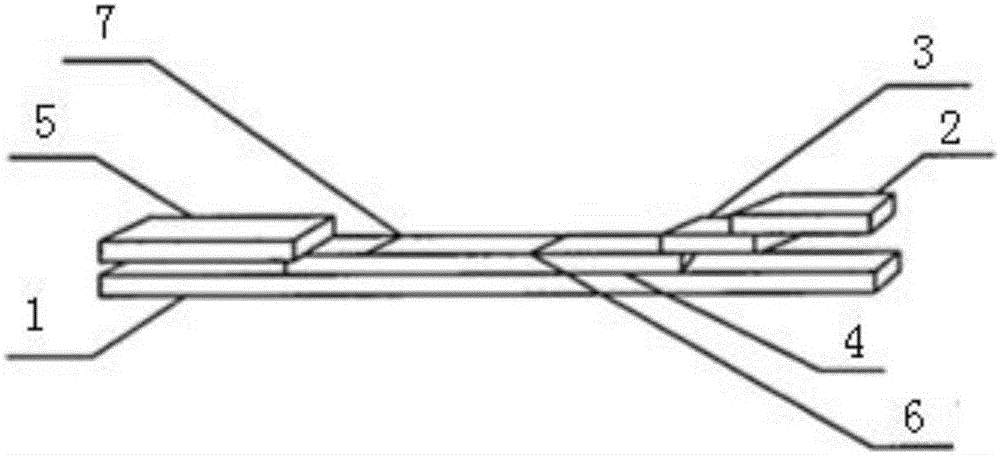
圖1為本發明實施例中用于測試動物A型口蹄疫的膠體金試紙的結構示意圖。
圖2為本發明實施例中體外組裝的病毒樣顆粒電鏡圖。
圖中:1-底板,2-樣品墊,3-免疫金標墊,4-檢測層,5-吸收層,6-檢測線,7-對照線。
具體實施方式
以下結合附圖及實施例對本發明作進一步詳細說明。
參見圖1所示,本發明實施例提供一種用于測試動物A型口蹄疫的膠體金試紙,包括采用PVC制成的底板1,底板1的頂部設置有檢測層4,檢測層4包括檢測線6和對照線7,檢測線6上設置有檢測線6和對照線7,檢測層4的頂部靠近對照線7的一側設置有吸收層5,靠近檢測線6的一側設置有免疫金標墊3,免疫金標墊3的頂部設置有樣品墊2。
免疫金標墊3包括膠體金顆粒,該膠體金顆粒上結合有SPA(金黃色葡萄球菌A蛋白)標記物,檢測線6涂覆/浸潤有A型口蹄疫病毒樣顆粒,對照線7上涂覆/浸潤有兔IgG。
本實施例中,免疫金標墊3上膠體金與SPA的比例為2×104:1~2最優比例為2×104:1.3,免疫金標墊3的吸附比例為10~50μL/cm。
檢測線6上涂覆/浸潤有濃度為0.5~1mg/mL的A型口蹄疫病毒樣顆粒,對照線7上涂覆/浸潤有濃度為0.8~1.5mg/mL的免疫兔血清IgG。
本發明還提供一種用于測試動物A型口蹄疫的膠體金試紙的制備方法,包括以下步驟:
S1、制備IgG:
a、采集2只陰性家兔全血,放入4℃冰箱過夜沉淀,將沉淀的全血在轉速為4000r/min的條件下離心10min,取上清即為血清。將20ml血清中加入20ml生理鹽水中,再加入10ml飽和(NH4)2SO4溶液,混合均勻后靜置30min,然后在轉速為3000r/min的條件下離心20min,棄去沉淀除去纖維蛋白,取上清液。
b、在上清液中加入30ml(NH4)2SO4飽和溶液,混合均勻后靜置30min,在轉速為3000r/min的條件下離心20min,棄上清液,取沉淀物,向沉淀物中加20ml生理鹽水,10ml(NH4)2SO4飽和溶液,混合均勻后靜置30min,3000r/min離心20min,棄上清。
重復b步驟2~3次后,向純化后的沉淀中加入10ml生理鹽水并透析,先放入純水中透析過夜除鹽,然后放入生理鹽水中在4℃下透析24h,透析期間每2~3h換液一次。
檢測透析是否完全:檢測試劑為濃度為1%的BaCl2(用于檢測SO42-)或以納氏試劑(用于檢測NH4+):取3~4ml透析液,加入檢測試劑1~2滴,出現磚紅色即認為有NH4+存在),出現白色沉淀即有SO42-存在,透析至無沉淀出現后,離心去沉淀(去除雜蛋白),上清液即為純化后的兔IgG。
S2、制備膠體金:取1g氯金酸溶于100ml三蒸水中制成濃度為1%的氯金酸溶液,向100ml水中加入1ml 1%的氯金酸水溶液,加熱至沸騰,邊攪拌邊逐滴加入1.7ml濃度為1%的檸檬酸鈉三鈉水溶液,繼續煮沸5min,冷卻后加入蒸餾水至100ml,即為膠體金放置于溫度為4℃的條件下保存。
S3、判斷SPA的最小蛋白用量:取96孔板,每孔加入100μL的膠體金,將1~20μL濃度為0.05mg/ml的SPA分別加入每孔并混勻,靜置15min,每孔加入20μL濃度為10%的NaCl,放置10min,顏色保持紅色的為最小蛋白用量,在此基礎上加30%為最佳標記量,本實施例中,最小蛋白用量為10μL,即每100μL濃度為1g/100ml的膠體金至少需要10μL濃度為0.05mg/ml的SPA,膠體金與SPA的質量比為2×104:1,最佳膠體金與SPA的比例為2×104:1.3,在實際使用時,可以根據需要調整膠體金和SPA的比例。
S4、制備SPA修飾的膠體金和免疫金標墊3:使用濃度為0.1M的K2CO3調整膠體金的pH值為5.9,按質量比為2×104:1~1.5(最優為2×104:1~1.3)將相應的SPA溶液加入膠體金中放置30min后,在轉速為10000r/min、溫度為4℃的條件下離心30min,將沉淀溶于重懸液中混合均勻,得到SPA修飾的膠體金溶液,選用玻璃膜作為免疫金標墊3基材,將玻璃膜放入SPA修飾的膠體金溶液中浸潤并晾干,吸附比為10~50μL/cm,最佳吸附比為30μL/cm,得到免疫金標墊3。
S5、制備檢測層4
使用硝酸纖維膜作為檢測層4基材,在檢測層4上標記檢測線6和對照線7,檢測線6與對照線7之間的距離為0.3~1cm(最優為0.5cm),且對照線7位于纖維素膜的中段,在檢測線6上噴涂濃度為0.5~1mg/mL(最優為0.8mg/mL)的A型口蹄疫病毒樣顆粒;在對照線7上噴涂兔IgG,噴涂量為10μl/1cm。
S6、制備樣品墊2:以玻璃纖維膜作為樣品墊2的基材,將20mM的PB(磷酸鹽緩存溶液)、1%的吐溫20、1%的BSA和2.5%的蔗糖溶于100ml三蒸水中并過濾得到樣品液,把玻璃纖維膜浸泡于該樣品液中,完全浸潤后取出并晾干。
S7、在底板1的頂部設置檢測層4,并將檢測層4壓平,將吸收層5(吸水紙)一部分固定在底板1上,一部分固定在檢測層4上靠近對照線7的部分,將免疫金標墊3的一側固定在底板1上,另一側固定在檢測層4靠近檢測線6的一側,樣品墊2的一側固定在底板1上,樣品墊2的一側固定在底板1上,另一側固定在免疫金標墊3上。
本發明膠體金試紙在使用時,先將樣品稀釋,然后將膠體金試紙的樣品墊2端插入樣品中,樣品墊2上設置有液面線,樣品的液面不能沒過液面線,當吸收層5完全被液體浸潤后,取出試紙條,平放后5~15分鐘內觀察結果。
如果血液樣品中含有A型口蹄疫抗體,血液樣品中的抗體與免疫金標墊3中SPA修飾的膠體金結合形成復合物,與檢測線6上A型口蹄疫病毒樣顆粒結合形成紫紅色線條,繼續前行,未與抗原結合的抗體攜帶重組蛋白SPA與對照線7中的IgG抗體形成紫紅色線條。
如果對照線7不出現紫紅條帶則說明該試紙條失效,如果檢測血液樣品中不含有A型口蹄疫相關抗體,則檢測線6處不會出現紫紅色條帶,而對照線7處必定仍出現紫紅色條帶。
其中,A型口蹄疫病毒顆粒的制備方法包括以下步驟:
S1、制備A型口蹄疫病毒樣顆粒:
S101、小泛素樣修飾蛋白融合表達載體pSM的構建:
a、從釀酒酵母(Saccharomyces cerevisiae)菌株EGY48基因組上擴增smt3基因(GenBank登陸號:AY558174),引物序列如下:上游引物smt3F:5’GCCATGGGTCATCACCATCATCATCAC(6×His)GGGTCG GACTCAGAAGTCAATCAA 3’;
下游引物smt3F:5’GGATCCGAGACCTTAAGGTCTCAACCTCCAATCTGTTCGCGGTG3’。
b、使用經Nco I(限制性核酸內切酶)和BamH I(一種限制性內切酶)雙酶切后將smt3基因插入到用同樣內切酶處理的pET-28a載體中,所得載體為pSM1,將pSM1的卡那霉素抗性基因替換為氨芐抗性基因,得載體pSM2。
S2、重組表達載體的構建:
S201、A型口蹄疫病毒結構蛋白VP0,VP3和VP1基因的擴增:根據GenBank(基因庫)中記載的豬A型FMDV設計引物,使用Qiagen公司生產的RNaeasy Mini kit(一種試劑盒)從豬A型口蹄疫病毒中提取該病毒的RNA,反轉錄后分別擴增獲得VP0,VP3和VP1基因,反轉錄中PCR循環參數為:先在94℃下5min進行1個循環;然后依次在94℃下60s,58℃下60s,72℃下2.5min進行30個循環;最后一循環在72℃持續8min。
引物序列如下:
上游引物VP0-F BsmB I:
5’TACTTCGTCTCCGCGGATCCGGAGCCGGGCAATCCAGC;
下游引物VP0-RBamH I:
5’GCGAGTGGATCCATTAAGCTTGCCTCCTTCGAGGGGAGTTC;
上游引物VP1-F BsmB I:
5’GGACTTCGTCTCACTACTGCCACCGGGGAATC;
下游引物VP1-R BamH I:
5’GCTTATGGATCCTTACAGGAGTTGTTTTGCTGGG
上游引物VP3-F BsmB I:
5’GCACTTCGTCTCGCGATTGTCCCGGTTGCAT;
下游引物VP3-R BamH I:
5’GCGCACGGATCCTTGTGAGCGGGGGTCAATCG。
S202、將經BsmB I/BamH I(兩種限制性內切酶)雙酶切后的VP0、VP3和VP1片段分別插入經Bsa I酶切處理的pSM1,pSM2和pSM1,得到重組表達載體pSM1/VP0,pSM2/VP3和pSM1/VP1。
S3、雙表達重組載體的構建:
以pSM1/VP1為模板,以T7BamH I/VP1Xho I為引物擴增獲得含有T7啟動子等原核表達元件和VP1基因的DNA片段,經BamH I/Xho I雙酶切后插入用同樣酶切處理的pSM1/VP0中,得雙表達重組載體pSM1/VP0-VP1,引物序列如下:上游引物T7BamH I:5’GCAATTGGA CCCGTCCGGCGTAGAGGATCGA,下游引物VP1Xho I:5’GCGCACCTCGAGCTACTGTTGCCGAGCGTCCAC。
S4、蛋白表達與純化。
將測序正確的陽性重組質粒pSM2/VP3和pSM1/VP0-VP1共轉化到感受態細胞BL21-CodonPlus(DE3)-RIL中,挑取單克隆菌落接種于含有氨芐抗生素、卡納抗生素和氯霉素3種抗生素的LB培養基(一種培養基的名稱)中,在溫度為37℃、轉速為220r/min的條件下培養12h,然后將培養的表達菌以1:100比例重新接種200ml含上述3種抗生素的LB培養基中,在溫度為37℃、轉速為220r/min的條件下培養至OD600值為0.9左右,留樣1ml作為誘導前對照。
其余菌液轉入溫度為16℃、加入IPTG(異丙基硫代半乳糖)至濃度為0.5mmol/L誘導表達16h,誘導后的菌液在轉速為4750r/min的條件下離心20min后收取菌體,隨后按1:50濃縮比例將菌體懸浮于buffer A(緩沖劑,配方為:500mmol/L NaCl,20mmol/L Tris-HCl,20mmol/L Imidazole,2mmol/L DTT,0.05%TritonX-100,pH 8.4),充分混勻后在冰上超聲波處理6min,然后在溫度為4℃的條件下11500×g離心15min后收集上清,得到重組蛋白。
使用His標簽蛋白純化試劑盒(一種用于純化蛋白的試劑盒)純化重組蛋白:將重組蛋白樣品進行10%SDS-PAGE電泳,隨后采用濕轉法將重組蛋白轉移至聚偏氟乙烯雜交膜(PVDF膜)上,用封閉液(PBS,5%脫脂奶粉,pH 7.0)在37℃條件下封閉1h,然后分別用抗His一抗(摩爾比為1:3000)和抗FLAG一抗在37℃下孵育1h,使用PBST(一種緩存溶液)充分洗滌后分別用辣根過氧化物酶標記的兔抗鼠IgG(摩爾比為1:6000)和山羊抗兔IgG(摩爾比為1:4000)在37℃孵育1h,PBST充分洗滌后于暗室內加入發光底物反應3min,置于Kozak膠片下曝光,顯影及定影固定后,觀察目的蛋白的表達情況,經過觀察可知,采用本方法獲得了預期大小的蛋白,且該蛋白具有免疫活性。
S5、口蹄疫病毒樣顆粒的體外組裝:
參照invitrogen的試劑使用說明,用小泛素樣修飾融合蛋白,通過HisTrap HP除去小泛素樣修飾蛋白,收集含有VP0、VP1和VP3的液體,用透析緩沖液PBS(pH 7.5)透析組裝成目的病毒樣顆粒。
S6、使用電鏡觀察口蹄疫病毒樣顆粒:
使用PBS在溫度為4℃的條件下透析組裝病毒樣顆粒,經超濾濃縮后,將10μl含病毒樣顆粒的液體加到200目的銅網上,在室溫吸附2~3min,用濾紙吸干銅網,用濃度為3%的磷鎢酸染色,用型號為Hitachi,H-7100FA的透射電鏡觀察,其體外組裝的病毒樣顆粒電鏡觀察結果參見圖2,可見多個直徑約20nm的病毒樣顆粒,由該圖片可知,本發明成功的在原核生物體外組裝得到病毒顆粒。
本發明不局限于上述實施方式,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也視為本發明的保護范圍之內。本說明書中未作詳細描述的內容屬于本領域專業技術人員公知的現有技術。
- 還沒有人留言評論。精彩留言會獲得點贊!