兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品、制備方法及應用與流程
本發明屬于分析化學領域,涉及一種獸藥殘留的自然基體標準樣品的制備,具體地說,涉及一種兔肉中己烯雌酚、己二烯雌酚、己烷雌酚殘留基體凍干粉標準樣品及其制備方法與應用。
背景技術:
己烯雌酚(Diethylstilbestrol,DES)己烷雌酚(Hexoestrolum,HEX)和雙烯雌酚(Dienestrol,DS)均屬1,2-二苯乙烯類化合物,為非甾體類同化激素。三者均為無色結晶或白色結晶性粉末,在甲醇中易溶,在乙醇、乙醚或脂肪油中溶解,在三氯甲烷中微溶,在水中幾乎不溶;在稀氫氧化鈉溶液中溶解。具有增加蛋白質沉積和減少脂肪沉積的作用而被廣泛應用于促進畜禽生長、增加瘦肉率等,并且雙烯雌酚經實驗確證為己烯雌酚的代謝物,己烯雌酚和雙烯雌酚均具有化學結構簡單、并且通過化學合成容易獲得、合成成本較低的特點。在水產養殖中,己烯雌酚的主要用途是作為添加劑加入魚類飼料中,刺激魚類正常新陳代謝,增加魚體內氮停留,提高魚體內氨基酸合成蛋白的速度,最終達到促進魚類生長的目的。其中殘留在魚體內的己烯雌酚和雙烯雌酚通過食物鏈進入人體,破壞人體正常生理平衡,兩種物質對人類的危害也被逐漸發現,己烯雌酚與雌激素受體結合后會干擾人的內分泌,誘發生殖器病變與腫瘤,在體內的長期蓄積必然嚴重危害人和動物的健康。20世紀70~90年代,毒理學研究表明這些化合物會干擾人體正常的激素平衡,導致機體代謝紊亂,腫瘤,兒童早熟,胎兒畸形等嚴重的問題,美國和歐盟已經明令禁止使用己烯雌酚,我國農業部也于1988年6月30日發布的《獸藥管理條例實施細則》中規定“不得添加激素類藥品”。2002年,我國農業部在第193號公告中宣布停止己烯雌酚在所有食用動物中使用;并在第235號公告中規定己烯雌酚在動物性食品中不得檢出,但目前的相關法令和標準尚未制定雙烯雌酚的測定標準。
在食品安全檢測體系中,標準樣品對整個檢測質量控制體系起到核心作用。在國際上,一種獸藥殘留量的分析方法的建立需要經3種類型的樣品測試:受控組織或液體、用藥物強化至或接近最大容許水平(MRL)的樣品和本身具有藥物殘留的組織 樣品,從而保證分析方法能具有一定的樣品基質適用范圍和重復性。歐盟對獸藥殘留分析方法與結果表達的法規(2002/657/EC)中明確指出了需要采用實物標準樣品進行檢測過程控制,可見實物標準樣品在獸藥殘留檢測中的具有十分重要的意義。
目前用于非甾體類同化激素殘留檢測的主要是純標準品,檢測質量控制主要是通過向樣品中添加純的標準品后進行檢測分析,這種分析方法無法代表目標分析物在活體內真正存在的狀態,不能真實地重現藥物經過自然代謝后在動物體內的提取效率,無法反映方法的準確性。由于目標物和基體結合情形與真實檢測樣品不完全一致而導致提取、凈化等處理結果與日常分析樣本存在較大差異,從而影響結果的可靠性和有效性。另外,一般標準樣品前期制備過程中添加有維生素C等抗氧化劑,導致標準樣品在后期的相關藥物殘留檢測分析等的應用過程中對實驗結果造成干擾和影響。
技術實現要素:
為了解決現有技術中非甾體類同化激素藥物殘留檢測不能真實地重現藥物經過自然代謝后在動物體內的提取效率,無法反映方法的準確性,影響結果的可靠性和有效性,且存在抗氧化劑影響使用結果的技術問題,本發明的一個目的是提供兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品的制備方法與應用。本發明的另一個目的是提供本方法制備的兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品。
本發明為解決上述技術問題所采用的技術方案是:兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品的制備方法,其特征在于,包括以下步驟:
A)、選擇實驗用兔,人工飼喂添加己烯雌酚、己二烯雌酚和己烷雌酚的飼料,使兔體內含有己烯雌酚、己二烯雌酚和己烷雌酚;
B)、給藥結束后,宰殺、取大塊肌肉,攪碎,混勻制成肉糜,均質、真空冷凍干燥得到粗樣;
C)、研磨步驟B所述粗樣,過篩,得到兔肉凍干粉標準樣品;
D)、封裝所述標準樣品,冷藏保存;
E)、檢驗所述標準樣品的均勻性和穩定性;
F)、對所述標準樣品中的己烯雌酚、己二烯雌酚和己烷雌酚含量進行定值。
所述步驟A中實驗動物的選擇,操作為:在養兔場篩選個體健康,體重1.5-2.5kg左右的獺兔,雌雄隨機,在20℃-25℃環境下隔離,每日上午8時喂食1次,馴養3日后備用,給藥前一天禁食。
所述步驟A中藥物添加,操作為:稱取己烯雌酚、己二烯雌酚和己烷雌酚三種藥物各0.2~2.6g,同時加入到2.0kg飼料中,攪拌均勻,即配制出三種藥物濃度為0.1~1.3g/kg的飼料A。
所述步驟A中采用人工飼喂方式進行實驗,操作為:每只兔每日飼喂飼料A 87g,即投藥劑量為3.5~75.4mg/kg體重;每日給藥一次,連續給藥3-6日。
所述步驟B中的宰殺時間為最后一次給藥結束后6~12h。
所述步驟B中的真空冷凍干燥條件為:預冷凍階段:-80℃--30℃,相應預冷時間0.5-10h;真空冷凍階段:壓力控制在0.01-1.0mbar,相應時間8-15h;干燥升華階段:-10℃-30℃,相應時間2-10h。
所述步驟C過篩的目數為30~80目。
所述步驟D中所用瓶子為帶有鋁箔墊片的白色聚乙烯塑料瓶,每瓶裝10g凍干粉,電磁感應封蓋,2-8℃冷藏保存。
所述標準樣品中己烯雌酚、己二烯雌酚和己烷雌酚的含量為10~3000μg/kg。
本發明的顯著優點是:
1)給兔飼喂添有己烯雌酚、己二烯雌酚和己烷雌酚的飼料,選擇適當時機,宰殺,取肌肉部分勻漿制成肉糜,冷凍干燥,過篩,分裝密封包裝;
2)均勻性檢驗、穩定性研究和協作定值檢測,通過給藥控制和采集時機的選擇可獲得預期含量的己烯雌酚、己二烯雌酚和己烷雌酚陽性材料;
3)本發明的產品可以在常溫下運輸,保質期長,目標物和基體結合情形與真實檢測樣品一致,標準樣品為實物標準樣品,均勻穩定,無防腐劑及抗氧化劑,易保存,用于非甾體類同化激素類藥物殘留測試項目的能力驗證、檢測方法的驗證、測試儀器的校準、測試結果的質量控制與考核。
附圖說明
圖1為己烯雌酚的化學結構式。
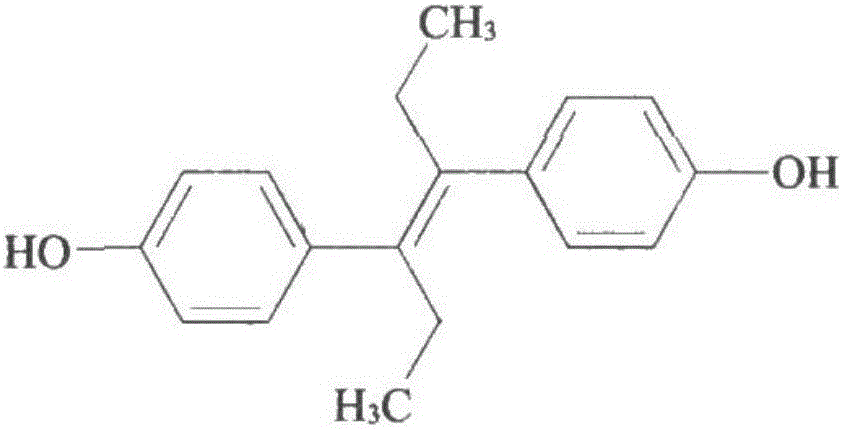
圖2為己二烯雌酚的化學結構式。
圖3為己烷雌酚的化學結構式。
圖4為本發明的標準樣品制備工藝流程圖。
圖5為本發明的標準樣品的LC-MS譜圖。
具體實施方式
如圖4所示,本發明的兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品的制備方法,包括以下步驟:A)藥物喂養;B)取樣、去雜質、勻漿;C)真空冷凍干燥;D)研磨、篩分、混樣、封裝;E)均勻性和穩定性檢驗;F)確定己烯雌酚、己二烯雌酚和己烷雌酚含量。
下面結合具體實施例,對本發明做進一步說明。應理解,以下實施例僅用于說明本發明而非用于限制本發明的范圍。下列實施例中未注明具體條件的實驗方法,通常按照常規條件,或按照制造廠商所建議的條件。
實施例1
一種兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品的制備方法,其具體步驟如下:
(1)實驗動物的選擇:在養兔場篩選個體健康,體重2kg的獺兔,雌雄隨機。在25℃環境下隔離,每日上午8時喂食1次,馴養3日后備用,給藥前一天禁食;
藥物飼養:稱取三種藥物(己烯雌酚、己二烯雌酚和己烷雌酚)各1.93g,同時加入到2.0kg飼料中,攪拌均勻,即配制出三種藥物濃度均為0.97g/kg的飼料A。每只兔每日飼喂上述飼料A 87g,即三種藥物投藥劑量均為42mg/kg體重;每日給藥一次,連續給藥5日;
(2)給藥5日后,即最后一次給藥結束8h后,宰殺后取肌肉,攪碎,混勻制成肉糜;
(3)真空冷凍干燥:采用真空冷凍干燥機(CHRiST Epsilon 2-6D)進行冷凍干燥,物料厚度2cm,-50℃預冷凍6h,0.1mbar真空冷凍10h,-10℃-30℃快速升溫干 燥8h,直至完全干燥,得到己烯雌酚、己二烯雌酚和己烷雌酚陽性凍干粗粉;
(4)研磨、過篩:凍干粉用中藥粉碎機粉碎,組織研磨機細磨,過30目篩,取篩下部分;
(5)分裝及保存:用帶有鋁箔墊片的白色聚乙烯塑料瓶分裝,每瓶裝10g凍干粉,電磁感應封蓋,4℃冷藏保存。
采用LC-MS檢測實施例1制備的樣品,結果如圖5所示,證實標準樣品中含有己烯雌酚、己二烯雌酚和己烷雌酚。
實施例2
本實施例中重復實施例1中的制備過程,不同的實驗條件為:
1)實驗動物選擇體重為2.5kg;
2)稱取己烯雌酚、己二烯雌酚和己烷雌酚各0.2g;
3)三種藥物投藥劑量均為3.5mg/kg體重;
4)連續給藥6日;
5)最后一次給藥結束6h后宰殺;
6)-80℃預冷凍0.5h,0.01mbar真空冷凍8h,快速升溫干燥2h;
7)過50目篩;
8)5℃冷藏保存。
實施例3
本實施例中重復實施例1中的制備過程,不同的實驗條件為:
1)實驗動物選擇體重為1.5kg;
2)稱取己烯雌酚、己二烯雌酚和己烷雌酚各2.0g;
3)三種藥物投藥劑量均為58mg/kg體重;
4)連續給藥3日;
5)最后一次給藥結束12h后宰殺;
6)-30℃預冷凍10h,1.0mbar真空冷凍15h,快速升溫干燥10h;
7)過80目篩;
8)8℃冷藏保存。
實施例4
對實施例1中樣品進行均勻性與穩定性檢驗:
1.均勻性檢驗
采用單因素方差分析方法進行均勻性檢驗,隨機抽取12瓶實例1制備的樣品,每瓶樣品平行測定2次。所有試料以隨機次序在重復性條件下測試,即在同一實驗室中由相同的人員使用相同的測試方法和儀器在較短時間內測試。
測試方法:稱取0.5g樣品,加4.5ml水還原15min,按SN/T 3235-2012出口動物源食品中多類禁用藥物殘留量檢測方法液相色譜-質譜/質譜法進行檢測。
采用以下單因素方差分析進行均勻性評價。
抽取i個樣品(i=1、2、3、…m),每個樣品在重復條件下測試j次(j=1、2、3、…n)。
每個樣品的測試平均值
全部樣品測試的總平均值
測試總次數
樣品間平方和均方
樣品內平方和均方
自由度f1=m-1
f2=N-m
統計量
均勻性檢測結果及評價見表1。
表1實例1制備的樣品均勻性檢測結果及統計分析
單位:μg/kg
以上結果可知:當α=0.05,f1=11,f2=12,查F分布表,F臨界值為2.72,因F統計值(2.11、1.91、2.38)<F臨界值2.72,表明樣品內及樣品間無顯著性差異,說明樣品是均勻的,能夠滿足質控等實驗要求。
采用相同方法,驗證實施例2、3制得的標準樣品的均勻性,驗證實施例2制得的標準樣品的均勻性,以己烯雌酚、己二烯雌酚、己烷雌酚分別統計,F比為2.05、1.99、2.01。驗證實施例3制得的標準樣品的均勻性,以己烯雌酚、己二烯雌酚、己烷雌酚分別統計,F比為2.02、2.18、1.94。F比均小于F臨界值2.72,表明實施例2、3制得的標準樣品樣品內及樣品間無顯著性差異,說明樣品是均勻的,能夠滿足質控等實驗要求。
2.穩定性檢驗
2.1長期穩定性檢驗
按照時間間隔前密后疏的抽樣原則,分別按下列時間隨機抽取用于穩定性測試的包裝好的實施例1制備的樣品:第0、2、4、6、9、12、18月。每次抽取3個樣品進行測試。在全部穩定性測試中,所用人員、儀器、測試方法和實驗室均與均勻性測試相同。結果及統計分析如表2所示。
用線性擬合模型評估標準樣品的穩定性,以X代表時間,Y代表標準樣品中目標藥物的含量,斜率b1用下式計算:
斜率的估計值:
截距的估計值:
直線上每點的標準偏差公示:
與斜率相關的不確定度:
當|b1|<t0.95,n-2·s(b1),表明斜率變化不顯著,即標準樣品是穩定的。
表2樣品長期穩定性檢查及統計分析
單位:μg/kg
自由度為n-2和p=0.95(95%置信水平)的分布即t0.95,(n-2)=2.57,由于|b1|<t0.95,n-2·s(b1),故斜率不顯著的,即未觀測到不穩定性,驗證實施例1制得的標準樣品的穩定性良好。
2.2短期穩定性檢驗
短期穩定性檢驗:即考察標準樣品在運輸條件下的穩定性,采用快遞方式運輸標準樣品,大部分地區3-4天都能收到樣品,極個別的地方9天之內也能送達。運輸時,將樣品放置于隔熱泡沫塑料箱中然后置冰塊一起運輸。運輸時,將樣品放置于隔熱泡沫箱中然后置冰塊一起運輸。隨機抽取冷藏保存的樣品6瓶,用特快專遞于8月中旬寄到新疆烏魯木齊,到達烏魯木齊后原封再寄回大連,同樣方式隨機抽取冷藏保存的樣品6瓶,用特快專遞于12月中旬寄到黑龍江漠河,到達漠河后原封再寄回大連。樣品寄出到寄回所有時間為10d。對寄回的樣品(運輸后樣品)采用SN/T 3235-2012方法進行檢測,并與未經運輸的樣品(運輸前樣品)作比對分析實驗。
用t檢驗法對運輸前后樣品的測定值進行一致性檢驗,檢驗公式為:
統計量t計算:
計算出t實驗,與比較,如果t實驗小于臨界值,則認為該標準樣品的特性量值沒有發生顯著性變化,否則認為有顯著性差異。結果見表3。
表3樣品短期穩定性檢驗結果及統計分析
從表3可以得出,t實驗值均小于查表值(2.228),表明該標準樣品的特性量值運輸前后的測定值具有一致性。驗證實施例1制得的標準樣品的短期穩定性良好。
采用上述相同方法,驗證實施例2、3制得的標準樣品的穩定性,斜率均不顯著,未觀測到實施例2、3制得的標準樣品不穩定性,結果表明實施例2、3制得的標準樣品穩定性良好。
實施例5
標準樣品中己烯雌酚、己二烯雌酚和己烷雌酚含量的定值:
八家實驗室采用LC-MS/MS方法對實施例1制備的標準樣品進行協同定值。對經過均勻性和穩定性檢驗合格的樣品,隨機抽取40瓶,分別分發到8家參加定值的實驗室進行檢測,結果見表4。8個實驗室的定值數據采用夏皮羅-威爾克(Shapiro-Wilk)檢驗法考察其正態性。在近似符合正態性的前提下,再經Grubb’s法檢驗確認每個實驗室數據是否存在異常值,用科克倫(Cochran)檢驗各實驗室定值數據是否等精度,結果表明所有的數據均通過檢驗,各實驗室測試精度一致。
表4合作定值實驗室測試結果
單位:μg/kg
定值結果由標準值和不確定組成。對于多家實驗室協作定值方式,標準值是多家實驗室的總平均值。標準值的總不確定主要來源于定值結果的不確定度、樣品不均勻性引起的不確定度、穩定性引起的不確定度。
假定各變量是獨立的,與CRM特性值有關的不確定度可表示為:
其中uchar是指定值過程引入的不確定度,ubb是指樣品不均勻性引入的不確定度,ults是指樣品長期穩定性引入的不確定,usts是指樣品短期穩定性引入的不確定度。
擴展不確定可由合成標準不確定度乘以包含因子,取k=2(置信區間95%),得擴展不確定:U=k×uC R M
通過統計分析,采用標準值±擴展不確定度的方式表示定值結果,最終確定實施 例1中制備的標準樣品:己烯雌酚含量(2351±87)μg/kg,k=2、己二烯雌酚含量(684±31)μg/kg,k=2、己烷雌酚含量(135±10)μg/kg,k=2。
采用上述相同方法,對實施例2、3的標準樣品的己烯雌酚、己二烯雌酚、己烷雌酚含量進行合作定值,采用標準值±擴展不確定度的方式表示實施例2制備的標準樣品:己烯雌酚含量(196±8)μg/kg,k=2、己二烯雌酚含量(59±3)μg/kg,k=2、己烷雌酚含量(12±1)μg/kg,k=2。實施例3制備的標準樣品:己烯雌酚含量(2798±99)μg/kg,k=2、己二烯雌酚含量(945±43)μg/kg,k=2、己烷雌酚含量(186±14)μg/kg,k=2。
實施例6
兔肉中己烯雌酚、己二烯雌酚、己烷雌酚標準樣品的應用:
首先將實施例1制備的標準樣品分發給相應實驗室1-3及其人員,提供標準操作指導,然后進行實驗,報告檢測結果(μg/kg表示)及測量不確定度,用En值對各實驗結果進行評價,En數由下式計算:
式中,
LAB和REF分別表示參試實驗室和標準樣品的測試結果;
ULAB和UREF分別表示貴實驗室和標準樣品測試結果的測量不確定度。
判斷標準:|En|≤1,滿意結果;En數的絕對值大于1時,為不滿意結果,實驗室應調查原因,采取進一步的糾正措施并重新進行。
如表5所示,實驗室2三個檢測項目的|En|均小于1,為滿意結果,說明實驗室2具備相應的檢測能力,實驗室1的己二烯雌酚和己烷雌酚、實驗室3己烯雌酚的|En|均大于1,為不滿意或離群的結果,說明實驗室1和3不具備相應的檢測能力。對于報告不滿意或離群結果的實驗室,應查找原因,提出相應的整改措施,提高檢測水平。結果顯示制備的標準樣品達到了試驗要求,能夠有效的保證該類獸藥殘留檢測盲樣比對測試質量控制活動。
表5樣品用于質量控制活動結果
進一步還可以將采用本發明的制備方法制備的標準樣品用于檢測方法的驗證、測試儀器的校準、測試結果的質量考核等。
上述實施方式僅用來解釋本發明,而不是對本發明進行限制,在本發明的精神和權利要求保護范圍內,對本發明做出的任何修改和改變,都落入本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!