殼聚糖/膠體金復合體系、制備方法及應用與流程
本發明涉及一種殼聚糖/膠體金復合體系,同時還涉及該復合體系的制備方法及應用,屬于材料技術領域。
背景技術:
膠體金也稱金溶膠,是把金鹽還原成金后形成的穩定、均一的納米金粒子懸液,屬于多相不均勻體系,顏色從桔紅色到紫紅色變化。膠體金粒子以一個金核(Au)為基礎,外圍包覆負離子AuCl2-,最外層為H+,分散在膠體間溶液中并維持膠體呈懸浮狀態。膠體金粒子的金核不是理想的球形核,顆粒較小的基本呈球形,而顆粒較大(直徑30nm以上)的多呈橢球形。
膠體金粒子具有熒光光譜特性,其在可見光范圍內存在單一的光吸收峰,且隨著粒徑的增大波長變長。另外,在膠體金的眾多膠體特性中,最為顯著的是對電解質的敏感性,某些大分子物質如蛋白質不僅對膠體金起到保護作用,還能提高膠體金的穩定性。一般情況下,在不破壞電解質、溶膠濃度等穩定因素時,膠體金的穩定性較好,長時間放置也不會發生凝聚現象。
目前,膠體金主要作為標記物或顯色劑用于檢測抗原抗體,作為一種新型的免疫標記技術在生物、醫藥等領域具有潛在的應用前景。由于該技術不存在內源酶干擾和放射性同位素干擾等,且采用不同顆粒大小的膠體金作為雙重或多重標記,其定位更加準確。膠體金中金粒子的尺寸在1~100nm之間,除具有納米材料的通性(如較大的比表面積、量子尺寸效應和宏觀量子隧道效應等)外,其化學性質也異常活潑,可以與親核試劑吸附生成具特殊功能的基團。例如納米金可以與氨基發生非共價鍵的靜電吸附,也可以與疏基產生較強的共價鍵作用,但結合后納米金的光學性質并不發生變化,因此可用于生物監測。近幾年,膠體金的應用主要集中在快速斑點免疫金滲濾法和膠體金快速免疫層析法。快速斑點免疫金滲濾法又叫滴金免疫法,該方法以微孔膜為固相載體,將已知的特異性抗體或抗原固定其上,并裝入充滿吸水材料的滲濾裝置中,加入待測樣本,經由濾膜的毛細管作用或滲濾作用,使標本中的抗原或抗體與膜上包被的抗體或抗原結合,最后經膠體金結合物標記而達到檢測目的。而快速免疫層析法也是以微孔膜為固相載體,其上固定已知的特異性抗體或抗原作為檢測帶,膠體金標記物在玻璃纖維質結合釋放墊上干燥,其一端與樣品墊相連,另一端與膜相連,膜的另一端連有吸水墊。當加入待測樣品后,樣品通過毛細管向前移動,并通過含有標記物的玻璃纖維,使標記物重新水化,并與膠體金標記物相互反應一起向前,至檢測線時,檢測線截獲標記物與待測物的復合物,從而出現紅色結果。
現有技術中,傳統的膠體金制備方法包括檸檬酸三鈉還原法、抗壞血酸還原法、硼氫化鈉還原法等。其中,檸檬酸三鈉還原法的操作步驟為:取50mL 0.01%氯金酸與2mL 1%檸檬酸三鈉充分混合,加熱15min,冷卻后用水補至原體積,即得。抗壞血酸還原法的操作步驟為:取50mL 0.01%氯金酸、0.75mL 0.2M K2CO3與0.5mL 0.7%抗壞血酸充分混合,加熱10min,冷卻后用水補至原體積,即得。硼氫化鈉還原法的操作步驟為:取50mL 0.01%氯金酸與0.25mL 0.2M K2CO3充分混合,分3至5次向混合溶液中滴加新鮮配制的0.5mg/mL硼氫化鈉,邊加邊振蕩使其混合均勻,直至溶液變紫,最終變為橙紅色,繼續振蕩約3min,即得。然而,上述三種方法制備出的膠體金均須于4℃下貯存。
公布號CN105665740A的發明專利公開了一種大氣壓空氣等離子體液相下合成膠體金納米顆粒的方法,包括:在絕緣材料容器中加入氯金酸與還原劑的混合液,向該混合液中通入大氣壓空氣等離子體,即得膠體金納米顆粒。該方法采用空氣替代稀有氣體作為激發氣體,2~10min即可形成均一性良好、靈敏度高且性能穩定的膠體金納米顆粒。公布號CN102430392A的發明專利也公開了一種復合納米膠體金殼聚糖載體的制備方法,包括:1)取質量濃度0.01%的氯金酸溶液加熱至沸騰,攪拌加入預熱的1%檸檬酸三鈉溶液,至氯金酸溶液由金黃色變為灰色再變為酒紅色,繼續攪拌煮沸至溶液呈透亮的紅色,得到膠體金溶液;2)殼聚糖用0.1~1%的有機弱酸溶解成質量濃度0.01~0.1%的殼聚糖溶液,過濾備用;3)按照質量比1:0.1~1將膠體金溶液與殼聚糖溶液混合均勻,緩慢滴加0.05%的碳酸鉀溶液至混合液pH值為7.0,得到復合納米膠體金殼聚糖載體混合液。其中,復合載體的粒徑分布在20~200nm之間,平均粒徑80nm,可用于免疫檢測或免疫診斷。然而,上述兩種方法在制備膠體金時均需使用還原劑,并且制得的膠體金穩定性差,需要在低溫下貯存。
技術實現要素:
本發明的目的是提供一種殼聚糖/膠體金復合體系。
同時,本發明還提供一種殼聚糖/膠體金復合體系的制備方法。
最后,本發明提供一種殼聚糖/膠體金復合體系在制備電化學生物傳感器或者檢測萊克多巴胺中的應用。
為了實現以上目的,本發明所采用的技術方案是:
殼聚糖/膠體金復合體系,是在含有氯金酸和殼聚糖的溶液中通入等離子體制備得到。
所述含有氯金酸和殼聚糖的溶液的組成為:氯金酸0.05~0.1g,殼聚糖0.1~0.2g,冰乙酸400~600μL,水20~30mL。配制溶液時,可先將殼聚糖溶于冰乙酸的水溶液中,再加入氯金酸即可。
所述等離子體為氮氣等離子體。通入等離子體的技術參數為:脈沖射頻功率源功率100~200W,通入時間5~10min。
殼聚糖/膠體金復合體系的制備方法,包括以下步驟:在含有氯金酸和殼聚糖的溶液中通入等離子體,超聲混合,至溶液呈紫紅色,得到殼聚糖/膠體金復合體系。
所述含有氯金酸和殼聚糖的溶液的組成為:氯金酸0.05~0.1g,殼聚糖0.1~0.2g,冰乙酸400~600μL,水20~30mL。
所述等離子體為氮氣等離子體。通入等離子體的技術參數為:脈沖射頻功率源功率100~200W,通入時間5~10min。制備原理為:本發明采用常溫低壓等離子體制備膠體金,其中殼聚糖作為穩定劑和還原劑,在等離子制備過程中,氮氣等離子體引發水分子產生自由基,進而對氯金酸進行還原。
殼聚糖/膠體金復合體系在制備電化學生物傳感器中的應用,具體為:將殼聚糖/膠體金復合體系滴加在電極上,干燥,得到殼聚糖/膠體金修飾的電極;將上述電極置于抗體液中,在電極表面自組裝抗體,即得電化學生物傳感器。在上述應用中,殼聚糖本身帶有氨基基團,可為后續固定抗體(如萊克多巴胺抗體)提供結合位點,提高檢測的靈敏性。
所述抗體液中含有萊克多巴胺抗體時,所得傳感器即可用于檢測萊克多巴胺。
本發明的有益效果:
本發明中殼聚糖/膠體金復合體系是在含有氯金酸和殼聚糖的溶液中通入等離子體制備得到,該體系中膠體金粒子為納米尺寸,顆粒大小在50nm左右,呈不規則形狀。該復合體系能作為敏感膜材料修飾電極,電極自組裝RAC-anti抗體后可特異性檢測RAC抗原,檢測靈敏度高,選擇性和穩定性好。
本發明采用等離子法制備殼聚糖/膠體金復合體系,可省去化學還原劑,在常溫下快速合成穩定的膠體金,是一種“綠色”的合成方法。
附圖說明
圖1為復合體系中殼聚糖/膠體金的TEM圖;
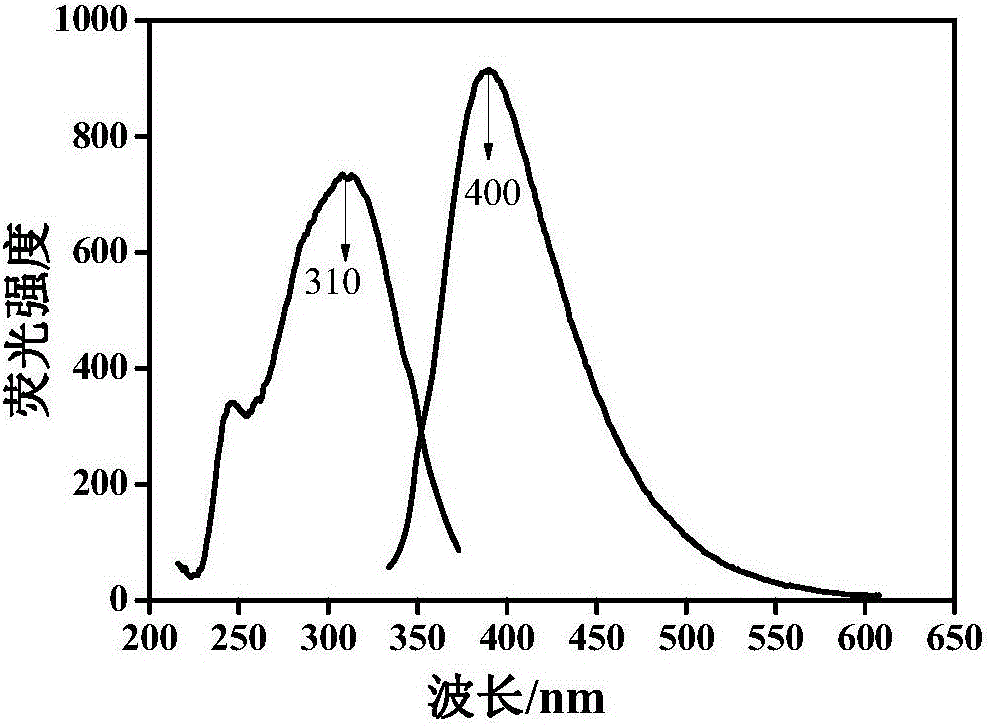
圖2為復合體系中殼聚糖/膠體金的熒光測試譜圖;
圖3為復合體系中膠體金的紫外可見光譜圖;
圖4為電化學生物傳感器的CV圖;
圖5為電化學生物傳感器構筑及檢測過程的電化學阻抗圖;
圖6為電化學生物傳感器檢測不同濃度RAC的EIS圖及擬合曲線圖;
圖7為電化學生物傳感器的選擇性測試結果;
圖8為電化學生物傳感器的穩定性測試結果。
具體實施方式
下述實施例僅對本發明作進一步詳細說明,但不構成對本發明的任何限制。
實施例1
殼聚糖/膠體金復合體系,其制備步驟如下:
1)用新鮮配制的王水清洗要使用的所有玻璃器皿,再用水徹底沖洗,干燥備用;
2)用1mL移液槍量取600μL 99%冰乙酸于25mL容量瓶中,加入20mL水稀釋成濃度3%的冰乙酸溶液;
3)稱取0.2g殼聚糖,加入到稀釋好的冰乙酸溶液中,超聲使殼聚糖完全溶解,靜置,至氣泡完全消失;
4)在去離子水中加入氯金酸至濃度100mM,再加入550μL殼聚糖溶液,在功率500W、頻率40kHz下超聲混合10min,靜置得混合液;
5)在混合液中通入氮氣等離子體,脈沖射頻功率源功率200W,時間5min,再在功率500W、頻率40kHz下超聲混合10min,至溶液變為紫紅色,得到殼聚糖/膠體金復合體系。
殼聚糖/膠體金復合體系在檢測萊克多巴胺中的應用,具體步驟如下:
1)金電極的預處理
采用0.5μm和0.3μm Al2O3的漿液在麂皮上打磨拋光金電極,至電極表面無明顯劃痕,打磨軌跡為“8”字形,然后用去離子水清洗金電極,將殘留在電極上的Al2O3洗干凈;將電極置于H2O2:H2SO4體積比3:7的混合液中,于功率500W、頻率40kHz下超聲作用15min,去離子水沖洗干凈;再將電極置于水:無水乙醇體積比1:1的混合液中,同上超聲15min,再置于去離子水中超聲15min;將清洗干凈的金電極置于0.5M H2SO4溶液中,采用循環伏安法在0.2~1.6V電壓范圍內活化2遍,再用去離子水沖洗干凈,吹干備用;
2)將上述制備的殼聚糖/膠體金復合體系稀釋至2倍體積,超聲30min使混合均勻;用10μL移液槍移取10μL稀釋體系滴加在金電極上,完全干后測試其電化學阻抗(EIS),待穩定后用去離子水沖洗干凈并吹干,得到殼聚糖/膠體金修飾的電極;將上述電極置于100ng/mL萊克多巴胺抗體(RAC-anti)液中浸泡2h,保證殼聚糖/膠體金復合材料有充足的時間與萊克多巴胺抗體自組裝,取出沖洗干凈,測試EIS,待穩定后用去離子水沖洗并吹干,即得用于檢測萊克多巴胺的電化學生物傳感器;
3)采用該傳感器對溶液中萊克多巴胺進行檢測。
實施例2
殼聚糖/膠體金復合體系,其制備步驟如下:
1)含氯金酸和殼聚糖溶液的制備
將殼聚糖溶于稀的冰乙酸溶液中,溶解完全后加入氯金酸,混勻備用;
溶液組成為:氯金酸0.05g,殼聚糖0.1g,冰乙酸400μL,水20mL;
2)在上述溶液中通入氮氣等離子體,脈沖射頻功率源功率100W,時間10min,反應至溶液變為紫紅色,得到殼聚糖/膠體金復合體系。
殼聚糖/膠體金復合體系的應用同實施例1。
實施例3
殼聚糖/膠體金復合體系,其制備步驟如下:
1)含氯金酸和殼聚糖溶液的制備
將殼聚糖溶于稀的冰乙酸溶液中,溶解完全后加入氯金酸,混勻備用;
溶液組成為:氯金酸0.1g,殼聚糖0.2g,冰乙酸600μL,水30mL;
2)在上述溶液中通入氮氣等離子體,脈沖射頻功率源功率150W,時間5min,反應至溶液變為紫紅色,得到殼聚糖/膠體金復合體系。
殼聚糖/膠體金復合體系的應用同實施例1。
實施例4
殼聚糖/膠體金復合體系,其制備步驟如下:
1)含氯金酸和殼聚糖溶液的制備
將殼聚糖溶于稀的冰乙酸溶液中,溶解完全后加入氯金酸,混勻備用;
溶液組成為:氯金酸0.075g,殼聚糖0.15g,冰乙酸500μL,水25mL;
2)在上述溶液中通入氮氣等離子體,脈沖射頻功率源功率180W,時間8min,反應至溶液變為紫紅色,得到殼聚糖/膠體金復合體系。
殼聚糖/膠體金復合體系的應用同實施例1。
試驗例
1)復合體系中膠體金的形貌與結構測試
測試方法:取實施例1中殼聚糖/膠體金復合體系,滴加在碳膜支撐的銅網上,用于TEM測試,結果見圖1,其中圖1(a)~1(c)依次為10nm、200nm、5nm標尺下的TEM圖,圖1(d)為電子選區衍射,1(e)為殼聚糖/膠體金的晶格條紋。
由圖1可知,膠體金粒子為納米尺寸,顆粒大小在50nm左右(呈紫紅色),不規則形狀,其晶格結構為對應于(310)和(400)面生長。
2)復合體系中膠體金的UV-vis和熒光測試譜圖
測試方法:取實施例1中殼聚糖/膠體金復合體系,稀釋10倍后加入到檢測用石英比色皿中,設置儀器參數,在激發波長310nm處尋找最佳發射波長,結果見圖2、3。
由圖2可知,激發波長為310nm時,膠體金在400nm處有一吸收峰。
由圖3可知,膠體金在543nm處出現紫外吸收峰,說明膠體金的粒徑在60nm左右,與TEM測試結果基本一致。
3)電化學性質分析
測試方法:取實施例1中電化學生物傳感器及一空白電極,采用上海辰華CHI600D電化學工作站,以傳統的三電極工作體系,Ag/AgCl為參比電極,Pt絲為輔助電極,電化學生物傳感器為工作電極,在開路電壓0.22V、測試范圍0.01Hz~100kHz、交流電振幅5mV條件下測試交流阻抗譜,采集數據并用Zview2處理,得到阻抗值,結果見圖4。
由圖4可知,與空白電極相比,實施例中電化學生物傳感器的循環伏安特性曲線峰值高、面積大,說明該傳感器具有較優的電化學活性。
4)電化學生物傳感器檢測萊克多巴胺分析
測試方法:首先在電極表面滴涂殼聚糖/膠體金復合材料,之后采用自組裝的方法將電極浸泡在1ng/mL萊克多巴胺抗體液中,反應4h,再浸泡于萊克多巴胺溶液中,采用電化學阻抗譜的方法測試不同反應過程中電極表面的變化,結果見圖5。
由圖5可知,在電極表面依次組裝殼聚糖/膠體金復合材料、RAC-anti和RAC后,EIS圖中電荷轉移電阻ΔRct均明顯增大,CV圖中循環伏安特性膠體金材料曲線面積明顯增大。殼聚糖/膠體金修飾后電極吸附RAC-anti和RAC后,電荷轉移電阻ΔRct增大,而循環伏安特性曲線面積變小,說明修飾后電極與RAC-anti發生非特異性吸附,而RAC-anti與RAC發生特異性吸附。
測試方法:取實施例1中電化學生物傳感器,浸泡于不同濃度的萊克多巴胺溶液中,并采用電化學阻抗法測試其阻抗值,結果見圖6,其中圖6(a)為測試不同濃度的萊克多巴胺的Nyquist圖,圖6(b)為對不同濃度對應的Rct線性擬合做出的直線關系圖。
通過測試不同濃度的萊克多巴胺,經擬合其交流阻抗值得到關于檢測萊克多巴胺的線性方程:y=200.26LogC+529.5,線性相關系數R2=0.991,電化學生物傳感器的最低檢測限為2.27pg/mL。
5)電化學生物傳感器的選擇性和穩定性測試
測試方法:取實施例1中電化學生物傳感器,分別浸泡于1μg/mL的K+、Ca2+、Na+、Mg2+、urea、UA、CLB、SAC、RAC中,測試后收集阻抗值數據,結果見圖7。
由圖7可知,實施例中電化學生物傳感器對萊克多巴胺的檢出量最高,選擇性最好。
測試方法:采用實施例1中方法制備5根相同的電化學生物傳感器,用于檢測萊克多巴胺,結果見圖8。
由圖8可知,不同批次電化學生物傳感器的穩定性良好。
- 還沒有人留言評論。精彩留言會獲得點贊!