一種檢測引起類過敏反應的物質的方法及其試劑盒與流程
本發明涉及藥物檢測技術領域,特別涉及一種檢測引起類過敏反應的物質的方法及其試劑盒。
背景技術:
過敏反應即變態反應,是外源性抗原物質與體內抗體間所發生的一種非正常的免疫反應,為常見的不良反應之一。可以誘發過敏反應的物質很多,如具有完全抗原性的蛋白質、多肽、多糖等大分子物質;另一些分子較小的化合物可作為半抗原與體內蛋白質結合成完全抗原,從而引起過敏反應。目前涉及到過敏反應的過敏物質很多,發生頻率較高的有藥品(中藥及西藥)、食品、花粉、螨蟲等。急性過敏反應包括I型超敏反應和類過敏反應。最新調查研究表明,77%的急性過敏反應為類過敏反應,類過敏反應發生率遠高于I型超敏反應。類過敏反應無需IgE介導,首次接觸藥物即可出現過敏癥狀,給人類的生活帶來極大的危害。
鑒于類過敏反應的危害性,尤其在醫藥領域中的頻繁發生,如中藥注射液的過敏反應,使人們越來越意識到早期預防的重要性。其中,致敏原物質的早期快速檢測是降低類過敏反應的重要手段。
肥大細胞是誘發類過敏反應的中心樞紐,它在受抗原刺激后脫顆粒直接導致一系列過敏癥狀的產生。目前,常用的體外檢測肥大細胞脫顆粒的方法主要有β-氨基己糖苷酶法、類胰蛋白酶法、組胺法、掃描及透射電鏡等。這些方法經典穩定,但都有各自的局限性。為了檢測相應指標,肥大細胞經過各種化學固定及顯色處理,失去了活體狀態下脫顆粒的一系列生物信息,由此也引起很多檢測誤差,也無法進行精確定量及動態觀察。因此,如何準確檢測類過敏原成為了新的研究方向。
研究發現在肥大細胞脫顆粒的過程中,鈣離子和環磷腺苷的升高是活性介質釋放的前提條件,這種現象在1973年就被發現,但真正將鈣離子和環磷腺苷的活體動態監測作為評價指標,應用于類過敏原的早期快速評估尚沒有人嘗試。
專利號為CN102154434B的專利中提出,用鈣流檢測方法確認物質的過敏性,可以對致敏原進行篩選。但鈣流方法只適用于貼壁細胞的檢測,若使用懸浮或半懸浮細胞,會使得檢測數據不真實,不穩定。同時,鈣流檢測只能針對與受體快速結合并發揮作用的化合物,不適合反應較慢的化合物。因此,需要提供一種新型的檢測引起類過敏反應的物質的方法及試劑盒。
技術實現要素:
有鑒于此,本發明提供了一種檢測引起類過敏反應的物質的方法及其試劑盒。該檢測方法結果準確可靠,與傳統的β-氨基己糖苷酶釋放率實驗檢測結果基本一致,但靈敏度比β-氨基己糖苷酶釋放率檢測方法要高;本發明的檢測方法簡便易行、快速,克服了傳統方法的不足,可應用于引起類過敏反應的物質的早期快速篩查及鑒定,具有廣泛的應用價值。
為了實現上述發明目的,本發明提供以下技術方案:
本發明提供了一種檢測引起類過敏反應的物質的方法,包括如下步驟:
步驟a:將P815細胞接種于培養基中;
步驟b:在培養基中加入待測物及與IP1和/或cAMP特異性結合的生物分子,檢測IP1和/或cAMP的濃度;
步驟c:根據IP1和/或cAMP的濃度,確認待測物是否為引起類過敏反應的物質。
在本發明中,應用P815細胞進行實驗,使用1-磷酸肌醇(IP1)來替代鈣流的檢測來確認物質的過敏性。IP1檢測反映的是第二信使1,4,5-三磷酸肌醇(IP3)的含量,當樣品中加入LiCl后,IP1不再代謝,而是蓄積在細胞內。隨著細胞內產生的IP1增多,游離的IP1與抗體結合增多,信號逐漸減弱。本發明建立了一種簡便易行、可靠的、通過檢測肥大細胞內IP1和cAMP變化來反映其脫顆粒狀況的方法,并通過與傳統方法對應比較,以C48/80為陽性藥物,對臨床不同種類的中藥注射液進行了實際應用,充分說明了本方法的快速、靈敏性及可靠性。該方法克服了傳統方法的不足,可應用于類過敏原的早期快速篩查及鑒定,具有廣泛的應用價值。
在本發明提供的實施例中,步驟b中生物分子為抗體。
作為優選,步驟b中檢測IP1和/或cAMP的濃度采用的試劑為基于HTRF技術的IP1檢測試劑和/或cAMP檢測試劑。
作為優選,P815細胞為對數生長期的P815細胞。
作為優選,待測物為藥物或螨。
在本發明提供的實施例中,待測物為藥物注射劑。
在本發明提供的實施例中,待測物為中藥注射劑。
在本發明提供的實施例中,待測物選自參麥注射液、注射用血塞通、脈絡寧注射液、舒血寧、痰熱清注射液或熱毒寧注射液。
本發明還提供了一種檢測引起類過敏反應的物質的試劑盒,包括:與IP1和/或cAMP特異性結合的生物分子。
作為優選,生物分子為抗體。
在本發明提供的實施例中,與IP1和/或cAMP特異性結合的生物分子為IP1抗體和/或cAMP抗體。
作為優選,與IP1和/或cAMP特異性結合的生物分子為經過標記的生物分子。通過標記讀取信號獲得目標物質的濃度。
在本發明的實施例中,檢測IP1和/或cAMP的濃度的試劑為基于HTRF技術的IP1檢測試劑或cAMP檢測試劑。
在本發明中,應用HTRF技術的IP1和cAMP檢測試劑盒,在活體狀態下動態監測在致敏原物質刺激下P815細胞內IP1和cAMP的變化,以變化程度作為類過敏反應判定的標準。該方法在活細胞狀態下,靈敏、快速對致敏原進行篩選,克服了原有方法的不足,在類過敏反應發生的早期即可發現潛在威脅,將為過敏原過敏性篩查、過敏原檢測、環境安全性監測等領域提供新的方法。
本發明提供了一種檢測引起類過敏反應的物質的方法及其試劑盒。該方法包括:將P815細胞接種于培養基中;在培養基中加入待測物及與IP1和/或cAMP特異性結合的生物分子,檢測IP1和/或cAMP的濃度;根據IP1和/或cAMP的濃度,確認待測物是否為引起類過敏反應的物質。本發明至少具有如下優勢之一:
1、本發明提供的檢測方法結果準確可靠,與傳統的β-氨基己糖苷酶釋放率實驗檢測結果基本一致,克服了傳統方法的不足,可應用于引起類過敏反應的物質的早期快速篩查及鑒定,具有廣泛的應用價值;
2、本發明提供的檢測方法的靈敏度比β-氨基己糖苷酶釋放率檢測方法要高;
3、本發明的檢測方法簡便易行、快速;
4、本發明檢測方法適用于貼壁細胞的檢測,也適用于懸浮或半懸浮細胞的檢測;
5、本發明檢測方法適合于類過敏反應較慢的化合物的檢測。
附圖說明
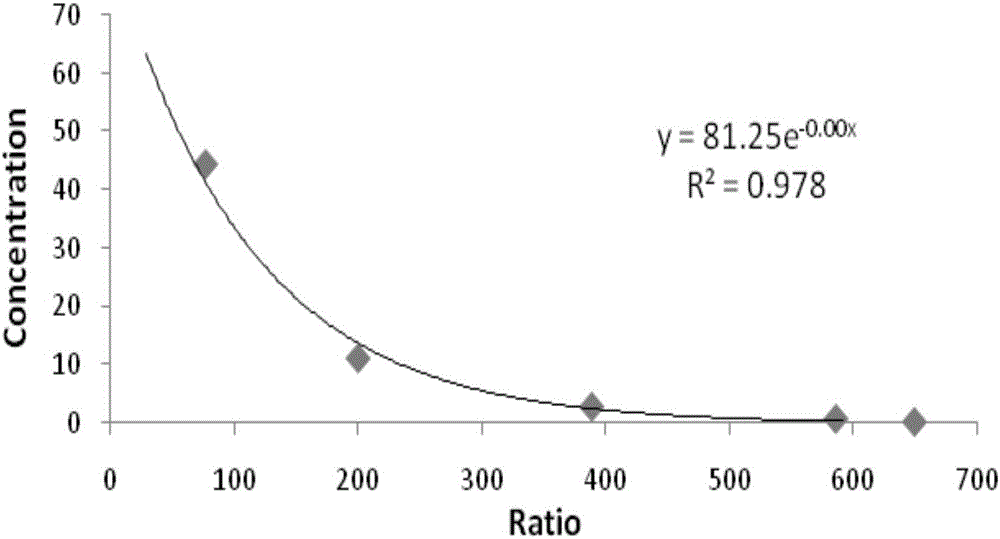
圖1示IP1的標準曲線;
圖2示cAMP的標準曲線。
具體實施方式
本發明公開了一種檢測引起類過敏反應的物質的方法及其試劑盒,本領域技術人員可以借鑒本文內容,適當改進工藝參數實現。特別需要指出的是,所有類似的替換和改動對本領域技術人員來說是顯而易見的,它們都被視為包括在本發明。本發明的方法及應用已經通過較佳實施例進行了描述,相關人員明顯能在不脫離本發明內容、精神和范圍內對本文所述的方法和應用進行改動或適當變更與組合,來實現和應用本發明技術。
本發明提供的檢測引起類過敏反應的物質的方法及其試劑盒中所用生物材料、試劑、儀器均可由市場購得。
下面結合實施例,進一步闡述本發明:
實施例1
實驗方法:
1.材料
試劑:RPMI1640培養基(GIBCO);胎牛血清(Gibco),cAMP dynamic2kit(cisbio),IP1Tb kit(cisbio),384孔板(Corning),Compound48/80(Sigma,美國),β-D-氨基葡萄糖胺(Sigma),參麥注射液(河北神威藥業有限公司,批號:1401192),注射用血塞通(黑龍江省珍寶島藥業股份有限公司,批號:14ka222),脈絡寧注射液(金陵藥業股份有限公司南京金陵制藥廠,批號:20140403),舒血寧(黑龍江省珍寶島藥業股份有限公司,批號:B20140707),痰熱清注射液(上海凱寶藥業股份有限公司,批號:1502204),熱毒寧注射液(江蘇康緣藥業股份有限公司,批號:20140722)。
細胞:小鼠肥大細胞瘤細胞P815細胞購自國家實驗細胞資源共享平臺。
儀器:二氧化碳培養箱(Thermo,美國),超凈工作臺(蘇州凈化,中國),鈣流檢測工作站(FlexStation3,Molecular Devices)。
機體發生類過敏反應時,會有肥大細胞脫顆粒而釋放炎癥介質的現象。P815細胞是小鼠肥大細胞瘤細胞,具有在體肥大細胞的反應特性,常作為類過敏反應的研究對象。Compound 48/80(C48/80)是N-甲基-對甲氧基苯乙胺和甲醛縮合產生的聚合物,具有促進肥大細胞脫顆粒的作用,常將它作為類過敏實驗的陽性藥。
2.方法
2.1細胞培養
P815細胞用RPMI1640培養基(含10%胎牛血清),于37℃、飽和濕度、5%CO2培養箱中培養,3d傳代一次,傳代比例為1:3。
2.2HTRF檢測IP1
取對數期生長的P815細胞,按照檢測試劑盒方法,用Stimulate Buffer調節細胞濃度,接種于384孔板中,4900個/孔,分設標準品組(無細胞)、陰性對照組(無細胞)、陽性藥組、注射劑組和空白對照組。其中標準品組按照試劑盒說明設置0、10.74、42.97、171.875、687.5、2750、11000nM 7個濃度做標曲;陰性對照組加入同體積的Stimulate Buffer。陽性藥組以終濃度為0、10、20、40、80、160、320、640μg/mL的C48/80;注射劑組,分別設置臨床劑量和2倍臨床劑量孔,參麥注射液SMZSY(終濃度分別為13.33ml/L、26.66ml/L)、血塞通注射液XSTZSY(2.22ml/L、4.44ml/L)、脈絡寧注射液MLNZSY(4.44ml/L、8.88ml/L)、舒血寧注射液SXNZSY(5.56ml/L、11.12ml/L)、痰熱清注射液TRQZSY(4.44ml/L、8.88ml/L)、熱毒寧注射液RDNZSY(4.44ml/L、8.88ml/L);空白對照孔加入同體積的Stimulate Buffer,培養箱孵育1h后,陰性對照孔加入3μL的lysis solution,其余各孔加入3μL IP1試劑工作液,之后,各孔加入3μL IP1cryptate,室溫孵育1h后,按照試劑盒要求設置檢測參數,上機檢測。
制作標準曲線,擬出公式,按照公式,計算各孔的IP1濃度。
2.3HTRF檢測cAMP
收集處于對數生長期的P815細胞,調節細胞濃度,接種于384孔板中,4900個/孔,分設標準品組(無細胞)、陰性對照組(無細胞)、陽性藥組、注射液組合空白對照組。陽性藥組分別加入C48/80溶液(終濃度為500μg/mL、250μg/mL、125μg/mL、62.5μg/mL、31.25μg/mL、15.63μg/mL、7.81μg/mL),注射液組,SMZSY(終濃度分別為13.33ml/L、26.66ml/L)、XSTZSY(2.22ml/L、4.44ml/L)、MLNZSY(4.44ml/L、8.88ml/L)、SXNZSY(5.56ml/L、11.12ml/L)、TRQZSY(4.44ml/L、8.88ml/L)、RDNZSY(4.44ml/L、8.88ml/L),對照孔加入等體積PBS溶液,標準孔加入等體積cAMP標準品,置培養箱中孵育30min,按照說明書進行檢測。
制作標準曲線,擬出公式,按照公式,計算各孔的cAMP濃度。
2.4β-氨基己糖苷酶釋放率檢測
取對數期生長的P815細胞,按5×105/ml接種于96孔板中,每孔200μl,置37℃、5%CO2培養箱中孵育過夜。300g、5min離心,棄上清,加入100μl無血清培養基配制的不同濃度的C48/80溶液,使其終濃度分別為200μg/ml、100μg/ml,50μg/ml;各注射液組按照以上濃度加入注射液,空白對照組加入等體積的培養液,總酶孔加入等體積0.5%的Triton X-100溶液,于培養箱中孵育1h后,1000rpm離心10min,收集上清。96孔酶標板中每孔加入底物1mmol/Lβ-氨基己糖50μl,然后加入50μl細胞上清,輕輕搖晃混勻,置37℃、5%CO2培養箱孵育1h,再加入0.1mol/L Na2CO3/NaHCO3緩沖液200μl終止反應,檢測OD 405nm的值。按照公式計算:
β-氨基己糖苷酶釋放率(%)=(樣品孔OD-調零孔OD)/(總酶孔OD-調零孔OD)×100%。
3.數據處理
結果用表示,組間顯著性差異用t檢驗方法進行比較。
4.結果
4.1 IP1檢測結果
4.1.1標準曲線
IP1的標準曲線見圖1。
4.1.2 C48/80和不同種類中藥注射液對P815細胞胞內IP1濃度的影響
表1 C48/80和不同種類中藥注射液對P815細胞胞內IP1濃度的影響
注:*與Control比較,p≤0.05,**與Control比較,p≤0.01;
結果顯示,40μg/mL~640μg/mL的C48/80,可以增大P815細胞胞內IP1的濃度,與Control組比較,差異具有統計學意義(p≤0.05或p≤0.01)。各注射液組,2倍臨床劑量的脈絡寧注射液顯著增大了P815細胞胞內IP1濃度的濃度,與Control組比較,差異具有統計學意義(p≤0.05)。
4.2 cAMP檢測結果
4.2.1標準曲線
cAMP的標準曲線見圖2。
4.2.2 C48/80和不同種類中藥注射液對P815細胞胞內cAMP濃度的影響
表2 C48/80和不同種類中藥注射液對P815細胞胞內cAMP濃度的影響
注:*與Control比較,P≤0.05,**與Control比較,P≤0.01;
結果顯示,7.81μg/mL~500μg/mL的C48/80,可以增大P815細胞胞內cAMP的濃度,與Control組比較,差異具有統計學意義(p≤0.05或p≤0.01)。各注射液組,2倍臨床劑量的參麥注射液顯著增大了P815細胞胞內IP1濃度的濃度,與Control組比較,差異具有統計學意義(p≤0.05)。
4.3β-氨基己糖苷酶釋放率檢測結果
表3不同種類中藥注射液對P815細胞β-氨基己糖苷酶釋放率的影響
注:*與Control比較,p≤0.05,**與Control比較,p≤0.01。
結果顯示,不同濃度的各中藥注射液對P815細胞β-氨基己糖苷酶釋放率均無明顯影響。
在應用實例中,本申請用不同的檢測方法對臨床6種中藥注射液致肥大細胞脫顆粒作用進行比較性研究。在劑量選擇上,按照給藥劑量與人體血容量的比例,分臨床給藥劑量和2倍臨床劑量。結果發現細胞內IP1和cAMP檢測方法與傳統的β-氨基己糖苷酶釋放率實驗檢測結果基本一致,但是靈敏度比β-氨基己糖苷酶釋放率檢測方法要高。猜測可能是由于β-氨基己糖苷酶檢測法是一種生化檢測法,最后通過比色來確定結果,其檢測限可能比較高,較少量的脫顆粒反應不會被其檢測到。而細胞內IP1和cAMP的檢測由于直接檢測單個細胞的變化,且HTRF檢測的是目的產物累加的結果,故靈敏度更高。
以上所述僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!