基于量子點的CA125免疫層析試紙條的制備方法與流程
本發明涉及醫藥診斷技術領域,更具體的是涉及一種新型的基于量子點的CA 125免疫層析試紙條的制備方法。
背景技術:
乳腺癌是發生在乳腺腺上皮組織的惡性腫瘤。全球乳腺癌發病率自20世紀70年代末開始一直呈上升趨勢,美國8名婦女一生中就會有1人患乳腺癌。我國雖不是乳腺癌的高發國家,但不宜樂觀,近年我國乳腺癌發病率的增長速度卻高出高發國家1~2個百分點。位居女性惡性腫瘤的第1位。女性乳腺癌發病率(粗率)全國合計為42.55/10萬,城市為51.91/10萬,農村為23.12/10萬。乳腺癌的早期發現、早期診斷,是提高療效的關鍵。因此研究乳腺癌早期診斷方法有重大意義。
血清糖類抗原(Carbohydrate antigen,CA)125是一種廣譜腫瘤標志物,乳腺癌患者通常伴隨著該物質的血清含量升高,正常人血清中CA 125的含量尚不到35U/mL。因此CA 125血清水平是乳腺癌患者檢測的一項關鍵指標。對乳腺癌的早期診斷,術后監測有重大作用。
免疫層析技術是將免疫標記技術與層析技術結合的一種新型檢測技術,其原理是將特異的抗體(或抗原)作為捕獲試劑固定于硝酸纖維素膜的特定區域,加入待測樣品后,在毛細作用力的推動下,待測樣品沿著膜向前移動,當移動至固定有捕獲試劑的區域時,樣品中的抗原(或抗體)與捕獲試劑發生特異性結合,標記試劑(如膠體金,酶等)則顯示出一定的顏色從而實現特異性檢測的免疫分析方法。其中膠體金免疫層析試紙條已廣泛地應用于免疫學、組織學、病理學和細胞生物學等領域。但膠體金作為標記物,抗原濃度低的樣本檢測條帶顏色太淺無法用肉眼識別,限制了其在檢測血清腫瘤標志物的應用。量子點(QDs)是一種半導體納米晶,它具有寬激發譜、窄發射譜、熒光效率高、光穩定性好等優點,是一種備受關注的新型熒光探針。用量子點取代傳統的膠體金作為標記物可以彌補膠體金標記的不足。所以本文擬研制基于量子點的CA 125免疫熒光試紙條,從而實現對乳腺癌腫瘤標志物進行快速、方便、靈敏檢測,建立乳腺癌檢測的新方法。
技術實現要素:
鑒于腫瘤標志物在腫瘤檢測中的重要地位、量子點納米粒子獨特的光學性質以及層析技術簡便和價格方面的優勢。我們將結合量子點和免疫層析試紙條兩種技術,利用量子點羧基和CA 125單克隆抗體(Ab1)的氨基反應,制得量子點熒光探針QDs@Ab1。探針、CA 125和包埋在試紙條的另一種CA 125抗體(Ab1’)通過抗體抗原之間的作用,形成一種類似夾心的結構QDs@Ab1-CA 125-Ab1’。對CA 125——乳腺癌腫瘤標志物進行定性定量的檢測,建立腫瘤標志物檢測的新方法,致力于簡單迅速、價格低廉、定性定量、操作簡便的乳腺癌診斷方法。
本發明的技術方案如下:
基于量子點的CA 125免疫層析試紙條的制備方法;其步驟如下:
(1)將水溶性量子點與1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽加入到反應器,然后向反應器中加入Tris-HCl緩沖液,在旋轉混合架上活化量子點的羧基;
(2)反應結束后,采用離心分離進行純化,用Tris-HCl緩沖液清洗以除去未反應的1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽,得到活化的水溶性量子點;
(3)將活化的量子點、CA 125單克隆抗體按照摩爾比為1:40~80比例混合于Tris-HCl緩沖液中,渦旋儀上旋轉使其混勻,將混合溶液置于旋轉混合架上,室溫下反應2~3小時;
(4)反應結束后,采用離心分離進行純化,用Tris-HCl緩沖液清洗除去游離的抗體和1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽,得到熒光探針QDs@Ab1,然后將產物分散在含有1~5%牛血清白蛋白的Tris-HCl緩沖液中,4℃靜置過夜;
(5)將另一種CA 125抗體以及羊抗鼠IgG用Tris-HCl緩沖液稀釋到1~2mg/mL,用點樣儀噴于硝酸纖維素膜上以形成T線和C線;
(6)將樣品墊和結合墊進行預處理;
(7)用含1%的BSA、1%的PEG-4000、0.1%的Tween-20、1%的蔗糖的Tris-HCl緩沖液作為稀釋液,對封閉后的水溶性量子點-CA 125單克隆抗體(QDs@Ab1)混合液進行稀釋,稀釋倍數為5倍,并將稀釋后的溶液均勻滴加在預處理后的結合墊上,靜置5min,并隨后于37℃恒溫干燥箱中至完全干燥,得到終處理的結合墊,封袋置于4℃保存備用;
(8)將預處理的樣品墊,終處理的結合墊、硝酸纖維素膜、吸水墊按順序固定于單面塑膠板上,各個墊和膜之間相互重疊1~3mm,完成試紙條的組裝。
定性檢測:用于激發量子點的紫外燈波長范圍為320nm~420nm的普通紫外燈即可;根據雙抗夾心的原理,當待測樣本中含有CA 125時,復合物將同時被T線和C線捕獲,紫外燈照射下出現兩條熒光條帶,檢測結果為陽性;反之,檢測樣本中不含CA 125時,則只在 C線位置出現熒光條帶,檢測結果為陰性;如果T線和C線都不出熒光現條帶則說明檢測無效。(如圖1,圖2所示)
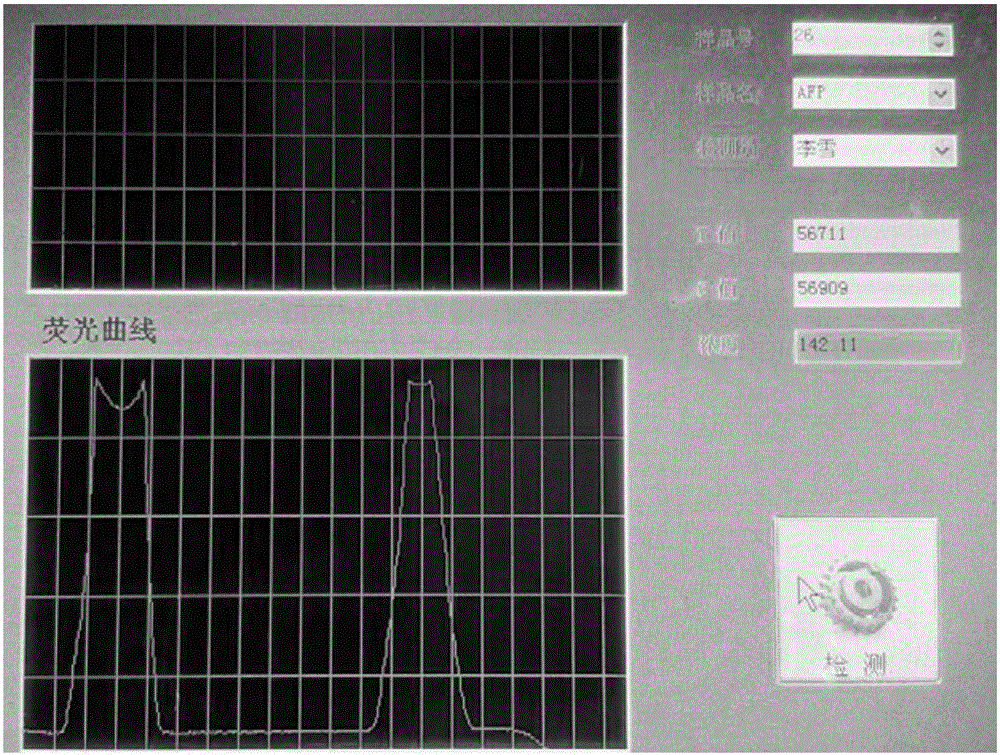
通過一系列濃度梯度的CA 125標準液滴加到免疫層析試紙條上,20分鐘后用檢測儀讀取T線和C線的熒光強度數值,并建立Log(T/C)與CA 125濃度的相對應關聯公式,將待測樣本檢測獲得的T線與C線數值通過公式,計算出其CA 125的濃度。
所述的方法中,所述量子點是聚(叔丁基丙烯酸脂-乙基丙烯酸脂-甲基丙烯酸)三嵌段共聚物改性CdZnSe量子點得到的水溶性量子點。(如圖3所示)
所述反應體系是Tris-HCl緩沖液。
所述量子點與1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽質量分數比為1:4000~10000。
所述樣品墊預處理方法如下,樣品墊浸入含Tween-20 0.1%~2%的Tris-HCl緩沖液中靜置5-10min,然后放入37℃恒溫干燥箱中干燥2~4小時,封袋置于4℃保存備用。
所述結合墊預處理方法如下,結合墊浸入含BSA、親水聚合物、表面活性劑、蔗糖的Tris-HCl緩沖液的處理液中,靜置5~10min,然后置于37℃恒溫干燥箱中干燥2~4小時,封袋置于4℃保存備用。
所述處理液配方如下:中BSA濃度為1%~4%,親水聚合物濃度為0.5%~5%,表面活性劑濃度為0.1%~2%,蔗糖濃度為1%~10%。
本發明制備的新型基于量子點的CA 125免疫層析試紙條優勢在于:
1.采用量子點這種具有優異的光學性質,已經被廣泛應用于示蹤、成像以及標記等方面的納米材料作為探針熒光來源,將納米技術應用到腫瘤檢測領域。
2.采用免疫層析技術作為檢測用的基材,免疫層析技術因其簡單迅速、價格低廉、可以隨時隨地等優點在檢測領域處于特殊重要的地位。
3.采用量子點的羧基和抗體的氨基之間的反應形成的牢固的化學鍵,而非傳統的靜電吸附作用,提高了試紙條抵抗非特異性吸附的能力,量子點熒光強度和CA 125濃度之間正相關關系可同時實現定性和定量檢測,特異性強、靈敏度高(圖4)。
附圖說明
圖1:本發明制備的基于量子點的CA 125免疫層析試紙條陰性樣品的檢測圖片。
圖2:本發明制備的基于量子點的CA 125免疫層析試紙條陽性樣品的檢測圖片。
圖3:本發明制備的基于量子點的CA 125免疫層析試紙條的量子點透射電鏡照片
圖4:本發明制備的基于量子點的CA 125免疫層析試紙條的特異性實驗數值。
圖5:實施例1制備的基于量子點的CA 125免疫層析試紙條樣品定量檢測擬合曲線。
圖6:實施案例2制備的基于量子點的CA 125免疫層析試紙條樣品定量檢測擬合曲線。
圖7:實施案例3制備的基于量子點的CA 125免疫層析試紙條樣品定量檢測擬合曲線。
具體實施方式
下面的實施案例中將對本發明作進一步的闡述,但本發明不限于此。
實施案例1:
1.量子點偶聯CA 125抗體(QDs@Ab1)
(1)將水溶性量子點、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)水溶液按照原料質量比為1:4000比例混合于Tris-HCl緩沖液中,在旋轉混合架上活化量子點的羧基30min,離心得到活化的量子點。
(2)將活化的量子點、CA 125抗體Ab1按照摩爾比為1:40比例混合于Tris-HCl緩沖液中,將混合溶液置于旋轉混合架上,室溫下反應2小時;
(3)反應結束后,采用離心分離進行純化,用Tris-HCl緩沖液清洗三次以除去游離的抗體和EDC,得到熒光探針QDs@Ab1,最后將產物分散在含有1%牛血清白蛋白(BSA)的Tris-HCl緩沖液中,4℃靜置過夜。
2.抗體的固定
將CA 125另一位點的抗體(Ab1’)以及羊抗鼠IgG(二抗,Ab2)用Tris-HCl緩沖液稀釋到1mg/mL,用點樣儀噴于硝酸纖維素膜上以形成T線和C線,然后置于37℃恒溫干燥箱中干燥2小時。
3.樣品墊、結合物釋放墊的預處理以及熒光探針的固化
(1)將樣品墊浸入含0.1%Tween-20的Tris-HCl緩沖液中靜置5min,然后放入37℃恒溫干燥箱中干燥2小時,封袋置于4℃保存備用。
(2)結合墊浸入含1%的BSA、0.5%的PEG-4000、0.1%的TritonX-100、1%的蔗糖的Tris-HCl緩沖液中,靜置5min,然后置于37℃恒溫干燥箱中干燥2小時,封袋置于4℃保存備用。
(3)將所得熒光探針QDs@Ab1用含1%的BSA、0.5%的PEG-4000、0.1%的TritonX-100、1%的蔗糖的Tris-HCl緩沖液稀釋5倍,均勻涂覆在上述已處理的結合物釋放墊上,靜置5min后于37℃恒溫干燥箱中干燥2小時,封袋置于4℃保存備用。
4.試紙條的組裝
(1)將所得樣品墊,結合物釋放墊、硝酸纖維素膜、吸水墊按順序固定于單面塑膠板上,各個墊和膜之間相互重疊1mm,完成試紙條的組裝。
(2)用自動切膜機將組裝好的試紙條進行切割,寬度約為3mm,并將其裝入塑料板中,最后將其與干燥劑一起裝入鋁箔袋內密封儲存。
5.樣品的測試和結果判讀
(1)定性和半定量檢測:用于激發量子點的紫外燈波長范圍為320nm~420nm的普通紫外燈即可;根據夾心免疫的原理,當待測樣本中含有CA 125時,復合物將同時被T線和C線捕獲,T線生成復合物QDs@Ab1-CA 125-Ab1’,C線生成復合物QDs@Ab1-Ab2。紫外燈照射下出現兩條熒光條帶,檢測結果為陽性;反之,檢測樣本中不含CA 125時,則只在C線位置出現熒光條帶,檢測結果為陰性;如果T線和C線都不出熒光現條帶則說明檢測無效。條帶顏色越深說明待測樣本中含有的CA 125含量越高。
(2)定量檢測:配置一系列濃度梯度的CA 125標準液,如:15U/mL,50U/mL,100U/mL,250U/mL,500U/mL,取50uL滴加到免疫層析試紙條上,10min后用檢測儀讀取T線和C線的熒光強度,分別將T/C的熒光強度及對應的抗原濃度做擬合曲線,得到熒光強度與濃度對應的公式。擬合曲線見說明書附圖5。
實施案例2:
1.量子點偶聯CA 125抗體(QDs@Ab1)
(1)將水溶性量子點、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)水溶液按照原料質量比為1:6000比例混合于Tris-HCl緩沖液中,在旋轉混合架上活化量子點的羧基30min,離心得到活化的量子點。
(2)將活化的量子點、CA 125抗體Ab1按照摩爾比為1:60比例混合于Tris-HCl緩沖液中,將混合溶液置于旋轉混合架上,室溫下反應2.5小時;
(3)反應結束后,采用離心分離進行純化,用Tris-HCl緩沖液清洗三次以除去游離的抗體和EDC,得到熒光探針QDs@Ab1,最后將產物分散在含有2%牛血清白蛋白(BSA)的Tris-HCl緩沖液中,4℃靜置過夜。
2.抗體的固定
將CA 125另一位點的抗體(Ab1’)以及羊抗鼠IgG(二抗,Ab2)用Tris-HCl緩沖液稀釋到2mg/mL,用點樣儀噴于硝酸纖維素膜上以形成T線和C線,然后置于37℃恒溫干燥箱中干燥3小時。
3.樣品墊、結合物釋放墊的預處理以及熒光探針的固化
(1)將樣品墊浸入含1%Tween-20的Tris-HCl緩沖液中靜置5min,然后放入37℃恒溫干燥箱中干燥2小時,封袋置于4℃保存備用。
(2)結合墊浸入含2%的BSA、3%的PVP-10000、1%的Tween-20、7%的蔗糖的Tris-HCl緩沖液中,靜置5min,然后置于37℃恒溫干燥箱中干燥3小時,封袋置于4℃保存備用。
(3)將所得熒光探針QDs@Ab1用含2%的BSA、3%的PVP-10000、1%的Tween-20、7%的蔗糖的Tris-HCl緩沖液稀釋10倍,均勻涂覆在上述已處理的結合物釋放墊上,靜置5min后于37℃恒溫干燥箱中干燥3小時,封袋置于4℃保存備用。
4.試紙條的組裝
(1)將所得樣品墊,結合物釋放墊、硝酸纖維素膜、吸水墊按順序固定于單面塑膠板上,各個墊和膜之間相互重疊2mm,完成試紙條的組裝。
(2)用自動切膜機將組裝好的試紙條進行切割,寬度約為3mm,并將其裝入塑料板中,最后將其與干燥劑一起裝入鋁箔袋內密封儲存。
5.樣品的測試和結果判讀
(1)定性和半定量檢測:用于激發量子點的紫外燈波長范圍為320nm~420nm的普通紫外燈即可;根據夾心免疫的原理,當待測樣本中含有CA 125時,復合物將同時被T線和C線捕獲,T線生成復合物QDs@Ab1-CA 125-Ab1’,C線生成復合物QDs@Ab1-Ab2。紫外燈照射下出現兩條熒光條帶,檢測結果為陽性;反之,檢測樣本中不含CA 125時,則只在C線位置出現熒光條帶,檢測結果為陰性;如果T線和C線都不出熒光現條帶則說明檢測無效。條帶顏色越深說明待測樣本中含有的CA 125含量越高。
(2)定量檢測:配置一系列濃度梯度的CA 125標準液,如:15U/mL,50U/mL,100U/mL,250U/mL,500U/mL,取50uL滴加到免疫層析試紙條上,20min后用檢測儀讀取T線和C線的熒光強度,分別將T/C的熒光強度及對應的抗原濃度做擬合曲線,得到熒光強度與濃度對應的公式。擬合曲線見說明書附圖6。
實施案例3:
1.量子點偶聯CA 125抗體(QDs@Ab1)
(1)將水溶性量子點、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)水溶液按照原料質量比為1:10000比例混合于Tris-HCl緩沖液中,在旋轉混合架上活化量子點的羧基30min,離心得到活化的量子點。
(2)將活化的量子點、CA 125抗體Ab1按照摩爾比為1:80比例混合于Tris-HCl緩沖液中,將混合溶液置于旋轉混合架上,室溫下反應3小時;
(3)反應結束后,采用離心分離進行純化,用Tris-HCl緩沖液清洗三次以除去游離的抗體和EDC,得到熒光探針QDs@Ab1,最后將產物分散在含有5%牛血清白蛋白(BSA)的Tris-HCl緩沖液中,4℃靜置過夜。
2.抗體的固定
將CA 125另一位點的抗體(Ab1’)以及羊抗鼠IgG(二抗,Ab2)用Tris-HCl緩沖液稀釋到2mg/mL,用點樣儀噴于硝酸纖維素膜上以形成T線和C線,然后置于37℃恒溫干燥箱中干燥4小時。
3.樣品墊、結合物釋放墊的預處理以及熒光探針的固化
(1)將樣品墊浸入含2%Tween-20的Tris-HCl緩沖液中靜置10min,然后放入37℃恒溫干燥箱中干燥4小時,封袋置于4℃保存備用。
(2)結合墊浸入含4%的BSA、5%的PVP-40000、2%的Tween-20、10%的蔗糖的Tris-HCl緩沖液中,靜置10min,然后置于37℃恒溫干燥箱中干燥4小時,封袋置于4℃保存備用。
(3)將所得熒光探針QDs@Ab1用含4%的BSA、5%的PVP-40000、2%的Tween-20、10%的蔗糖的Tris-HCl緩沖液稀釋20倍,均勻涂覆在上述已處理的結合物釋放墊上,靜置10min后于37℃恒溫干燥箱中干燥4小時,封袋置于4℃保存備用。
4.試紙條的組裝
(1)將所得樣品墊,結合物釋放墊、硝酸纖維素膜、吸水墊按順序固定于單面塑膠板上,各個墊和膜之間相互重疊3mm,完成試紙條的組裝。
(2)用自動切膜機將組裝好的試紙條進行切割,寬度約為3mm,并將其裝入塑料板中,最后將其與干燥劑一起裝入鋁箔袋內密封儲存。
5.樣品的測試和結果判讀
(1)定性和半定量檢測:用于激發量子點的紫外燈波長范圍為320nm~420nm的普通紫外燈即可;根據夾心免疫的原理,當待測樣本中含有CA 125時,復合物將同時被T線和C線捕獲,T線生成復合物QDs@Ab1-CA 125-Ab1’,C線生成復合物QDs@Ab1-Ab2。紫外燈照射下出現兩條熒光條帶,檢測結果為陽性;反之,檢測樣本中不含CA 125時,則只在C線位置出現熒光條帶,檢測結果為陰性;如果T線和C線都不出熒光現條帶則說明檢測無效。條帶顏色越深說明待測樣本中含有的CA 125含量越高。
(2)定量檢測:配置一系列濃度梯度的CA 125標準液,如:15U/mL,50U/mL,100U/mL,250U/mL,500U/mL,取50uL滴加到免疫層析試紙條上,30min后用檢測儀讀取T線和C線的熒光強度,分別將T/C的熒光強度及對應的抗原濃度做擬合曲線,得到熒光強度與濃度對應的公式。擬合曲線見說明書附圖7。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 基于量子點的CA15?3免疫層析試紙條的制備方法與制造工藝
- 肌紅蛋白熒光免疫層析試紙條用活化熒光乳膠微球及應用的制造方法與工藝
- 鐵蛋白熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 全程C?反應蛋白熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 一種微流控芯片上基于熒光量子點磁性富集并分離結核分枝桿菌TB的方法及裝置與制造工藝
- 25?羥基維生素D熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 25?羥基維生素D3熒光免疫層析用活化熒光乳膠微球的制造方法與工藝
- 降鈣素原熒光免疫層析檢測卡用活化熒光乳膠微球的制造方法與工藝
- 一種改變量子點熒光色的方法與制造工藝
- 一種基于熒光免疫層析技術的定量檢測計算方法與制造工藝