一種鴨茅根部組織石蠟切片的制備方法與流程
本發明涉及石蠟切片技術領域,具體涉及鴨茅根部組織石蠟切片的方法。
背景技術:
石蠟切片法是以石蠟作為包埋劑,經一系列處理制作永久裝片的方法。它不僅可將材料切成極薄的切片(4 μm以下),而且能制成連續切片,并永久保存,清晰度好,亦適合作細胞學研究。石蠟切片是植物顯微技術上最重要最常用的一種方法,在植物解剖學及其相關領域的生產和科研中有著廣泛應用。
尤其是近年來,隨著科學技術的發展與植物生態解剖學的興起,石蠟切片成為了不同生境植物或演替系列優勢種生態適應性研究的重要手段。但是,傳統的石蠟切片方法存在制片周期長,易受條件限制,制片中使用化學試劑較多,對人有一定的毒害,易使材料變脆、變硬或變形,某些內含物易于消失,常使組織變小,甚至使組織扭轉變形,細胞所含物質縮小而折光性增強,影響觀察正確性,且制片成本較高等問題,加上若所取的組織塊較小,則如何快速準確的包埋成功也是制片的關鍵之處。
技術實現要素:
本發明目的在于提供一種鴨茅根部組織石蠟切片的制備方法。該方法制得的鴨茅根部組織石蠟切片組織完整、細胞邊界清晰。
本發明目的通過如下技術方案實現:
一種鴨茅根部組織石蠟切片的制備方法,包括對新鮮鴨茅根部組織塊的殺死與固定,沖洗,脫水與透明,浸蠟與包埋,修塊與切片,展片與烤片,脫蠟、復水與番紅染色,固綠染色、脫水與透明,以及封片步驟;其特征在于:在沖洗步驟后、脫水與透明步驟前,還進行瓊脂糖預包埋,所述瓊脂糖預包埋是將沖洗后的鴨茅根部組織塊包埋在經熬化后的5%瓊脂糖凝膠中、以質量百分含量計(5 g瓊脂糖溶于100 mL蒸餾水中)。實驗中發現,進行所述的瓊脂糖預包埋處理解決了因鴨茅根部組織過小難以快速準確包埋的問題。
進一步優化,在殺死與固定后、沖洗前,還進行酸化,具體是將固定好的鴨茅根部組織塊置于0.5 mol/L三氯乙酸溶液中,酸化6-7 d,在酸化過程中,3-4 d時,更換一次0.5 mol/L三氯乙酸溶液。
更進一步,上述殺死與固定步驟中,采用的固定液為FAA混合固定液,即為福爾馬林:冰醋酸:70 %乙醇(體積濃度)=1:1:18、以體積比計。
優選地,脫水與透明步驟是將經上述瓊脂糖預包埋后的鴨茅根部組織塊依次置于體積比為1:5:4的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為2:5:3的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為3:5:2的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為5:4:1的正丁醇、體積濃度為100%乙醇、蒸餾水混合液中2 h,置于體積比15:4:1的正丁醇、體積濃度為100%乙醇、蒸餾水混合液中2 h,置于分析純正丁醇中2 h,再置于新的分析純正丁醇中2 h。
進一步,上述浸蠟與包埋步驟中,將脫水與透明處理后的鴨茅根部組織塊放于42℃的體積比為1:1的二甲苯和軟蠟混合劑中,分Ⅰ、Ⅱ兩級,各1小時;然后轉移至53℃純軟蠟中浸蠟6小時,分Ⅰ、Ⅱ兩級,各3小時;再轉移至63℃純硬蠟中浸蠟3小時,分Ⅰ、Ⅱ兩級,各1.5小時;所述軟蠟為熔點46-48℃的石蠟,所述硬蠟為熔點為56-58℃的石蠟。上述Ⅰ、Ⅱ兩級是指重復兩次,每次換上新的沒使用過的相應蠟液。
進一步,上述展片與烤片步驟中,在用于展片的載玻片上涂上蛋白甘油粘貼劑,所述蛋白甘油粘貼劑由體積比為1:1的雞蛋清和甘油組成。
進一步,上述脫蠟、復水與番紅染色步驟中,采用二甲苯脫蠟三次,每次25分鐘;所述復水依次進入無水乙醇Ⅰ級、無水乙醇Ⅱ級、無水乙醇Ⅲ級、95%乙醇、85%乙醇、70%乙醇中、乙醇均為體積百分濃度,每步停留4-5分鐘,然后蒸餾水洗5秒后進入1%水溶液番紅染液、質量濃度,密封過夜。上述Ⅰ、Ⅱ、Ⅲ級是指重復三次,每次換上新的沒使用過的無水乙醇。
更進一步,上述固綠染色、脫水與透明步驟中,將經脫蠟、復水與番紅染色處理的切片在95%乙醇中漂去浮色5-10秒,然后進入質量濃度為0.5%的95%乙醇固綠染液,保持30秒,所述95%乙醇為體積百分濃度;然后進行脫水:經三級分析純無水乙醇處理,即為進入無水乙醇Ⅰ級、無水乙醇Ⅱ級、無水乙醇Ⅲ級,每級30秒-1分鐘;脫水后進入透明處理:經三級分析純二甲苯處理,即為進入二甲苯Ⅰ級、二甲苯Ⅱ級、二甲苯Ⅲ級,每級20分鐘。上述Ⅰ、Ⅱ、Ⅲ級是指重復三次,每次換上新的沒使用過的無水乙醇或二甲苯。
最優選地說,一種鴨茅根部組織石蠟切片的制備方法,按如下步驟:
(1)殺死與固定
剪取新鮮鴨茅根部,用一次性雙面刀片切取鴨茅根部組織塊,約2~3 mm,后立即輕輕置于FAA混合固定液中固定、所述FAA混合固定液為體積比為1:1:18的福爾馬林、冰醋酸、70 %乙醇;固定液體積應為鴨茅根部組織塊總體積的10~15倍。材料經固定后,若不及時使用需要保存下來備用;鴨茅根部組織在上述FAA混合固定液中且置于冰箱4℃可保存半年至一年,材料的結構不會發生變化也不至于變壞。所述殺死與固定有效防止了細胞組織發生自溶現象。
(2)酸化
將固定好的鴨茅根部組織塊置于0.5 mol/L三氯乙酸溶液中,酸化6-7 d,在酸化過程中,3-4 d時,更換一次0.5 mol/L三氯乙酸溶液。
(3)沖洗
剪取干凈雙層紗布折成方形,采用細小鑷子將經酸化的鴨茅根部組織塊置于紗布中央,用2 B鉛筆做好材料名稱及編號標記后,將紗布合攏,用尼龍繩將紗布綁好,以材料在流動的水中不漏出為準;將紗布小團置于流動的水中,沖洗約24 h。
(4)瓊脂糖預包埋
配制質量百分濃度為5 %的瓊脂糖凝膠(取5 g瓊脂糖溶于100 mL蒸餾水中),經多次熬化后,倒入預先放置的4孔打孔器的平板上,厚度約5~7 mm,以備材料放入后進行封口;待瓊脂糖冷凝后,取出打孔器,從流動的水中取出紗布團并打開紗布團,將沖洗完成后的鴨茅根部組織塊橫切面向上,依次用細小鑷子輕放至凝膠孔底部(打孔器不會將孔打穿,鴨茅根部組織塊不會從凝膠孔底部漏出),并將瓊脂糖修整成規則的長條形,切去左上角以示材料編號,然后在酒精燈上進行瓊脂孔的封口、避免在孔內密封大量空氣。
(5)脫水與透明
用鑷子輕輕夾取包埋著的鴨茅根部組織瓊脂塊依次置于體積比為1:5:4的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為2:5:3的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為3:5:2的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為5:4:1的正丁醇、體積濃度為100%乙醇、蒸餾水混合液中2 h,置于體積比15:4:1的正丁醇、體積濃度為100%乙醇、蒸餾水混合液中2 h,置于分析純正丁醇中2 h,再置于新的分析純正丁醇中2 h。
(6)浸蠟與包埋
在烘干的燒杯中倒入二甲苯,再倒入等量的液態軟蠟制得體積比為1:1的二甲苯、軟蠟混合劑,置于42℃恒溫箱中備用;用細鑷子夾取透明完全的鴨茅根部組織瓊脂糖塊輕放于42℃恒溫箱中的二甲苯、軟蠟混合劑,分I、II兩級,各1 h;然后將瓊脂糖塊轉移至純軟蠟在53℃恒溫箱中浸蠟6 h,分I、II兩級,各3 h;再轉移至純硬蠟在63℃恒溫箱中浸蠟3 h,分I、II兩級,各1.5 h。上述Ⅰ、Ⅱ兩級是指重復兩次,每次換上新的沒使用過的相應蠟液。
在備好的包埋紙盒中,倒入純硬蠟II中的硬蠟,同時夾取浸蠟完成的瓊脂糖塊,擺正切面,待包埋紙盒中的硬蠟表面開始冷凝成固體,則立即將整個包埋紙盒置于冷水中,使其立刻凝固成蠟塊。
上述石蠟平滑均勻而無雜質,均由上海永華石蠟有限公司提供。上述軟蠟為熔點46~48℃的石蠟,硬蠟為熔點56~58℃的石蠟。
(7)修塊與切片
剪開包埋紙盒,將石蠟塊取出,用修塊刀將石蠟塊修成棱臺形狀,上、下切面平行,避開組織塊,防止損傷組織塊,然后固定在堅硬的小木方塊上;用切片機夾夾緊木塊,使蠟塊與刀口平行,然后進行切片,切片厚度以5~7μm為宜。
(8)展片與烤片
經上述修塊、切片后的蠟塊成一連續條帶狀的蠟帶,選取完整的蠟帶分切成小段,先在洗凈的載玻片上涂抹上一層由體積比為1:1的雞蛋清和甘油組成的蛋白甘油粘貼劑、有效防止展片過程蠟帶脫落,再用細小鑷子輕輕地將蠟帶放置于盛有蒸餾水的大燒杯內(預先放置于49~50℃恒溫水浴鍋內,保持大燒杯內水溫與恒溫水浴鍋水溫一致)進行展片,用覆有所述蛋白甘油的載玻片進行撈片,用小鑷子擺正蠟帶位置(位于載玻片下1/3~2/3處),用吸水紙吸去多余的水分,并用2B鉛筆做好標記;然后將覆有蠟帶的載玻片置于切片架上,于37℃恒溫箱中烘片24 h,或自然風干。
(9)脫蠟、復水與番紅染色
將上述干燥后的切片用二甲苯脫蠟三次,每次25分鐘;脫蠟完畢后,即進入復水與番紅染色系列:依次進入無水乙醇Ⅰ級、無水乙醇Ⅱ級、無水乙醇Ⅲ級、95%乙醇、85%乙醇、70%乙醇中、乙醇均為體積百分濃度,每步停留4-5分鐘,然后蒸餾水洗5秒后進入1%水溶液番紅染液、質量濃度,密封過夜。上述Ⅰ、Ⅱ、Ⅲ級是指重復三次,每次換上新的沒使用過的無水乙醇。
(10)固綠染色、脫水與透明
將經脫蠟、復水與番紅染色處理的切片在95%乙醇中漂去浮色5-10秒,然后進入質量濃度為0.5%的95%乙醇固綠染液,保持30秒,所述95%乙醇為體積百分濃度;然后進行脫水:經三級分析純無水乙醇處理,即為進入無水乙醇Ⅰ級、無水乙醇Ⅱ級、無水乙醇Ⅲ級,每級30秒-1分鐘;脫水后進入透明處理:經三級分析純二甲苯處理,即為進入二甲苯Ⅰ級、二甲苯Ⅱ級、二甲苯Ⅲ級,每級20分鐘。上述Ⅰ、Ⅱ、Ⅲ級是指重復三次,每次換上新的沒使用過的無水乙醇或二甲苯。
(11)封片
將上述透明好的切片從二甲苯中取出,用紗布擦干凈多余的二甲苯,然后用中性樹膠封片,即在要觀察的組織塊附近滴上封片劑,沿著一邊輕輕地蓋上蓋玻片(防止產生氣泡),最后自然風干后即可在Olympus顯微鏡下觀察和攝像。
本發明有益效果如下:
本發明方法制得的鴨茅根部組織石蠟切片,其組織完整、細胞界限清晰、色彩鮮艷、顏色對比鮮明、切片干凈,表明該法適用于鴨茅根部組織石蠟切片制作,比傳統植物石蠟切片制作方法能具有更好的效果。且能夠在較短時間內完成較大批量鴨茅根部組織石蠟切片的制作,試驗效果佳。
附圖說明
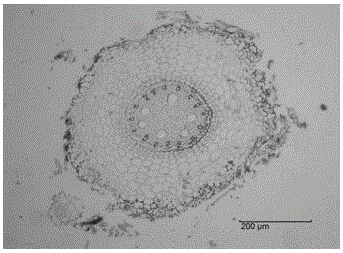
圖1:‘滇北’鴨茅側根組織切片圖;
圖2:‘PI 594994’鴨茅初生根組織切片圖;
圖3:‘PG 49’鴨茅初生根組織切片圖;
圖4:‘黔草4號’鴨茅初生根組織切片圖。
具體實施方式
下面通過具體實施例對本發明進行具體描述,在此指出以下實施例只用于對本發明進行進一步說明,不能理解為對本發明保護范圍的限制,本領域的技術熟練人員可以根據上述發明內容對本發明做出一些非本質的改進和調整。
以下實施例中采用的‘滇北’、‘PI 594994’、‘PG 49’、‘黔草4號’為鴨茅品種(系)名稱,分別來源于四川農業大學、美國牧草種質資源庫、新西蘭、貴州省草業研究所;為本領域所公知的品種(系)。
實施例1
一種鴨茅根部組織石蠟切片的制備方法,按如下步驟:
(1)殺死與固定
剪取新鮮‘滇北’鴨茅側根部,用一次性雙面刀片切取鴨茅根部組織塊,約2~3 mm,后立即輕輕置于FAA混合固定液中固定、所述FAA混合固定液為體積比為1:1:18的福爾馬林、冰醋酸、70 %乙醇;固定液體積應為鴨茅根部組織塊總體積的10~15倍。材料經固定后,若不及時使用需要保存下來備用;鴨茅根部組織在上述FAA混合固定液中且置于冰箱4℃可保存半年至一年,材料的結構不會發生變化也不至于變壞。所述殺死與固定有效防止了細胞組織發生自溶現象。
(2)酸化
將固定好的鴨茅根部組織塊置于0.5 mol/L三氯乙酸溶液中,酸化6-7 d,在酸化過程中,3-4 d時,更換一次0.5 mol/L三氯乙酸溶液。
(3)沖洗
剪取干凈雙層紗布折成方形,采用細小鑷子將經酸化的鴨茅根部組織塊置于紗布中央,用2 B鉛筆做好材料名稱及編號標記后,將紗布合攏,用尼龍繩將紗布綁好,以材料在流動的水中不漏出為準;將紗布小團置于流動的水中,沖洗約24 h。
(4)瓊脂糖預包埋
配制質量百分濃度為5 %的瓊脂糖凝膠(取5 g瓊脂糖溶于100 mL蒸餾水中),經多次熬化后,倒入預先放置的4孔打孔器的平板上,厚度約5~7 mm,以備材料放入后進行封口;待瓊脂糖冷凝后,取出打孔器,從流動的水中取出紗布團并打開紗布團,將沖洗完成后的鴨茅根部組織塊橫切面向上,依次用細小鑷子輕放至凝膠孔底部(打孔器不會將孔打穿,鴨茅根部組織塊不會從凝膠孔底部漏出),并將瓊脂糖修整成規則的長條形,切去左上角以示材料編號,然后在酒精燈上進行瓊脂孔的封口、避免在孔內密封大量空氣。
(5)脫水與透明
用鑷子輕輕夾取包埋著的鴨茅根部組織瓊脂塊依次置于體積比為1:5:4的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為2:5:3的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為3:5:2的正丁醇、體積濃度為95%乙醇、蒸餾水混合液中2 h,置于體積比為5:4:1的正丁醇、體積濃度為100%乙醇、蒸餾水混合液中2 h,置于體積比15:4:1的正丁醇、體積濃度為100%乙醇、蒸餾水混合液中2 h,置于分析純正丁醇中2 h,再置于新的分析純正丁醇中2 h。
(6)浸蠟與包埋
在烘干的燒杯中倒入二甲苯,再倒入等量的液態軟蠟制得體積比為1:1的二甲苯、軟蠟混合劑,置于42℃恒溫箱中備用;用細鑷子夾取透明完全的鴨茅根部組織瓊脂糖塊輕放于42℃恒溫箱中的二甲苯、軟蠟混合劑,分I、II兩級,各1 h;然后將瓊脂糖塊轉移至純軟蠟在53℃恒溫箱中浸蠟6 h,分I、II兩級,各3 h;再轉移至純硬蠟在63℃恒溫箱中浸蠟3 h,分I、II兩級,各1.5 h。上述Ⅰ、Ⅱ兩級是指重復兩次,每次換上新的沒使用過的相應蠟液。
在備好的包埋紙盒中,倒入純硬蠟II中的硬蠟,同時夾取浸蠟完成的瓊脂糖塊,擺正切面,待包埋紙盒中的硬蠟表面開始冷凝成固體,則立即將整個包埋紙盒置于冷水中,使其立刻凝固成蠟塊。
上述石蠟平滑均勻而無雜質,均由上海永華石蠟有限公司提供。上述軟蠟為熔點46~48℃的石蠟,硬蠟為熔點56~58℃的石蠟。
(7)修塊與切片
剪開包埋紙盒,將石蠟塊取出,用修塊刀將石蠟塊修成棱臺形狀,上、下切面平行,避開組織塊,防止損傷組織塊,然后固定在堅硬的小木方塊上;用切片機夾夾緊木塊,使蠟塊與刀口平行,然后進行切片,切片厚度以5~7μm為宜。
(8)展片與烤片
經上述修塊、切片后的蠟塊成一連續條帶狀的蠟帶,選取完整的蠟帶分切成小段,先在洗凈的載玻片上涂抹上一層由體積比為1:1的雞蛋清和甘油組成的蛋白甘油粘貼劑、有效防止展片過程蠟帶脫落,再用細小鑷子輕輕地將蠟帶放置于盛有蒸餾水的大燒杯內(預先放置于49~50℃恒溫水浴鍋內,保持大燒杯內水溫與恒溫水浴鍋水溫一致)進行展片,用覆有所述蛋白甘油的載玻片進行撈片,用小鑷子擺正蠟帶位置(位于載玻片下1/3~2/3處),用吸水紙吸去多余的水分,并用2B鉛筆做好標記;然后將覆有蠟帶的載玻片置于切片架上,于37℃恒溫箱中烘片24 h,或自然風干。
(9)脫蠟、復水與番紅染色
將上述干燥后的切片用二甲苯脫蠟三次,每次25分鐘;脫蠟完畢后,即進入復水與番紅染色系列:依次進入無水乙醇Ⅰ級、無水乙醇Ⅱ級、無水乙醇Ⅲ級、95%乙醇、85%乙醇、70%乙醇中、乙醇均為體積百分濃度,每步停留4-5分鐘,然后蒸餾水洗5秒后進入1%水溶液番紅染液、質量濃度,密封過夜。上述Ⅰ、Ⅱ、Ⅲ級是指重復三次,每次換上新的沒使用過的無水乙醇。
(10)固綠染色、脫水與透明
將經脫蠟、復水與番紅染色處理的切片在95%乙醇中漂去浮色5-10秒,然后進入質量濃度為0.5%的95%乙醇固綠染液,保持30秒,所述95%乙醇為體積百分濃度;然后進行脫水:經三級分析純無水乙醇處理,即為進入無水乙醇Ⅰ級、無水乙醇Ⅱ級、無水乙醇Ⅲ級,每級30秒-1分鐘;脫水后進入透明處理:經三級分析純二甲苯處理,即為進入二甲苯Ⅰ級、二甲苯Ⅱ級、二甲苯Ⅲ級,每級20分鐘。上述Ⅰ、Ⅱ、Ⅲ級是指重復三次,每次換上新的沒使用過的無水乙醇或二甲苯。
(11)封片
將上述透明好的切片從二甲苯中取出,用紗布擦干凈多余的二甲苯,然后用中性樹膠封片,即在要觀察的組織塊附近滴上封片劑,沿著一邊輕輕地蓋上蓋玻片(防止產生氣泡),最后自然風干后即在Olympus顯微鏡下觀察和攝像,見圖1。
實施例2-4
分別采用‘PI 594994’鴨茅初生根,‘PG 49’鴨茅初生根,‘黔草4號’鴨茅初生根進行制片。其他與實施例1方法同,結果如圖2-4所示。如圖3箭頭所示處:較老的初生根或可見外皮層細胞發生角質化,呈現亮綠色的“魚鱗狀”。圖4箭頭所示處可見外皮層細胞的細胞壁木質化與栓質化,且其內皮層細胞呈“馬蹄形”。其組織完整、切片干凈、細胞界限清晰、色彩鮮艷、顏色對比鮮明。
- 還沒有人留言評論。精彩留言會獲得點贊!