檢測嗎啡及可待因的酶聯免疫試劑盒及其應用的制作方法
本發明涉及酶聯免疫檢測技術,具體涉及一種用于檢測嗎啡及可待因的酶聯免疫試劑盒,其特別適于火鍋底料及辣椒醬中嗎啡及可待因殘留量的檢測。
背景技術:
罌粟殼俗稱大煙殼,為罌粟科植物罌粟割取漿汁后的干燥成熟果殼,內含20多種生物堿,其中含量最多的生物堿分別為嗎啡、可待因、蒂巴因、罌粟堿、那可汀。罌粟殼中生物堿雖然含量較少,但如果長期食用含有這類毒品的食物,會出現發冷、出虛汗、乏力、面黃肌瘦、犯困等癥狀,嚴重時可能對神經系統、消化系統造成損害,甚至出現內分泌失調等癥狀。在我國,罌粟殼作為非食用物質,是不允許在食品及調味品中添加使用的。但近年來少數食品生產經營者為了招攬顧客、牟取暴利,在火鍋及其調味料中添加罌粟殼及其水浸物等違禁原料,使食物味道鮮美,嚴重危害消費者的健康。
檢測罌粟殼中生物堿的方法主要有紫外分光光度法、熒光分光光度法、高效液相色譜法以及液相色譜-串聯質譜法等。這些方法各有特點,現以高效液相色譜法和液相色譜-串聯質譜法為主流,這兩種方法靈敏、準確,特異性強、分離度好,可以同時測定多種藥物,但需要昂貴的儀器、樣品的前處理復雜、繁瑣費時、檢測的成本較高,不能現場操作,而且需專業人員操作,所以限制了其應用。與之相比,酶聯免疫方法具有特異性好、靈敏度高、操作簡便、檢測成本低、適合于批量樣品的篩選檢測等優點,而且所需設備少,操作簡單易學,成本低廉,能夠更好地滿足我國食品企業、政府職能監管部門等開展檢測工作。
技術實現要素:
本發明的目的在于提供一種結構簡單、使用方便、價格便宜、便于攜帶的用于嗎啡及可待因檢測的酶聯免疫試劑盒,并提供一種高效、準確、簡便、適于大批量樣品篩選的定性、定量檢測方法。
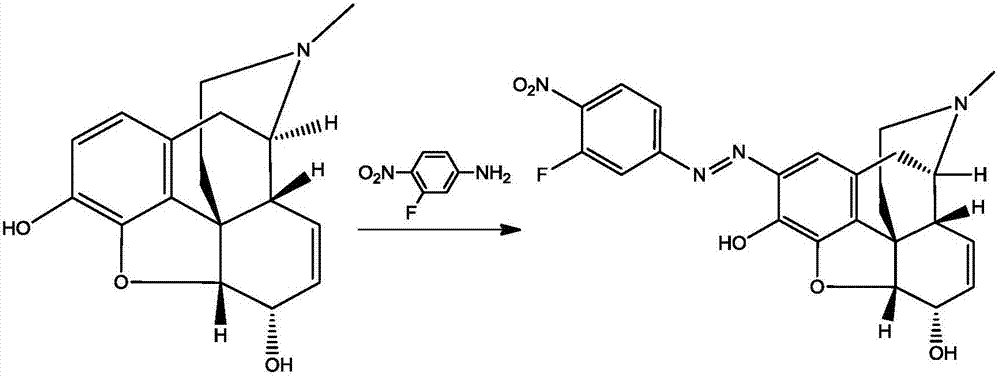
本發明試劑盒,它包括:包被有嗎啡偶聯抗原的酶標板、嗎啡單克隆抗體、酶標記抗抗體、嗎啡標準品溶液、底物顯色液、終止液、洗滌液、復溶液;所述嗎啡偶聯抗原是由嗎啡半抗原與載體蛋白偶聯得到,所述載體蛋白為鼠血清蛋白、甲狀腺蛋白、牛血清白蛋白、兔血清蛋白、人血清蛋白、卵清蛋白、血藍蛋白或纖維蛋白原;所述嗎啡半抗原是由3-氟-4-硝基苯胺與亞硝酸鈉反應得到重氮鹽,再與嗎啡反應得到的,其分子結構式為:
所述嗎啡單克隆抗體是以嗎啡偶聯抗原作為免疫原制備獲得。
所述抗抗體為羊抗鼠抗抗體。
所述酶標記抗抗體的標記酶為辣根過氧化物酶或細菌提取堿性磷酸酯酶,其中優選辣根過氧化物酶;酶標記的抗抗體是采用戊二醛法或過碘酸鈉法將標記酶與抗抗體進行偶聯得到的。
為了更方便現場監控和大量樣品篩查,所述試劑盒還包括嗎啡標準品溶液、底物顯色液、終止液、洗滌液、復溶液。
所述嗎啡標準品溶液6瓶,濃度分別為0μg/l、0.3μg/l、0.9μg/l、2.7μg/l、8.1μg/l、24.3μg/l。
當標記酶為辣根過氧化物酶時,所述底物顯色液由a液和b液組成,a液為過氧化氫或過氧化脲,b液為鄰苯二胺或四甲基聯苯胺,所述終止液為1~2mol/l的硫酸或鹽酸緩沖液;當標記酶為細菌提取堿性磷酸酯酶時,所述底物顯色液為對硝基磷酸鹽緩沖液,所述終止液為1~2mol/l氫氧化鈉溶液。
所述洗滌液優選為ph為7.6,含有0.8%~1.2%吐溫-20和0.01‰~0.02‰疊氮化鈉的0.2~0.4mol/l磷酸鹽緩沖液。
所述復溶液優選為ph為7.6,含有9%~12%卵清蛋白的0.1~0.3mol/l磷酸鹽緩沖液。
其中在酶標板制備過程中所用到的包被緩沖液為ph為9.6,0.05mol/l的碳酸鹽緩沖液,封閉液為ph為7.1~7.5,含有1%~3%酪蛋白的0.1~0.3mol/l磷酸鹽緩沖液。
本發明中酶標板的制備過程為:用包被緩沖液將包被原稀釋成20μg/ml,每孔加入100μl,37℃避光孵育2h或4℃過夜,傾去孔中液體,用洗滌液洗滌2次,每次30s,拍干,然后在每孔中加入150~200μl封閉液,37℃避光孵育1~2h,傾去孔內液體拍干,干燥后用鋁膜真空密封保存。
本發明的檢測原理為:
在微孔條上預包被嗎啡偶聯抗原,加入樣品溶液或標準品溶液后,再加入嗎啡單克隆抗體溶液,樣品中的嗎啡及可待因與酶標板上包被的嗎啡偶聯抗原競爭嗎啡單克隆抗體,加入 酶標記抗抗體進行放大作用,用顯色液顯色,樣品吸光度值與嗎啡及可待因的含量呈負相關,與標準曲線比較即可得到樣品中嗎啡及可待因的殘留量;同時根據酶標板上顏色的深淺,與系列濃度的標準品溶液顏色的比較可粗略判斷樣品中嗎啡及可待因殘留量的濃度范圍。
本發明還提供了一種應用上述酶聯免疫試劑盒檢測嗎啡及可待因的方法,它包括步驟:
(1)樣品前處理;
(2)用試劑盒進行檢測;
(3)分析檢測結果。
本發明檢測嗎啡及可待因的酶聯免疫試劑盒主要采用競爭elisa方法定性或定量檢測樣品中嗎啡及可待因的含量;對樣品的前處理要求低,樣品前處理過程簡單,能同時快速檢測大批量樣品;主要試劑以工作液的形式提供,檢驗方法方便易行,具有特異性高、靈敏度高、精確度高、準確度高等特點。本發明的酶聯免疫試劑盒,結構簡單、使用方便、價格便宜、攜帶便利、檢測方法高效、準確、簡便、適于大批量樣品篩選的定性、定量。
附圖說明
圖1:嗎啡半抗原合成路線圖
圖2:嗎啡半抗原核磁共振氫譜圖
圖3:試劑盒標準曲線圖
具體實施方式
下面結合具體的實施例來進一步闡述本發明。應理解,這些實施例僅用于說明本發明,而不用來限制本發明的范圍。
實施例1試劑盒組分的制備
1、嗎啡半抗原的合成(合成路線見附圖1)及鑒定
取3-氟-4硝基苯胺20mg,加稀硫酸20μl,加水,攪拌溶解,5℃,加入亞硝酸鈉18mg,攪拌1h,得到重氮鹽溶液;取嗎啡15mg,加氫氧化鈉乙醇溶液溶解,加入到重氮鹽中,反應2h,停止反應,離心分離,得到紅色固體化合物,加乙醇旋蒸,蒸干除去水分,加二氯甲烷:石油醚=1:20洗滌結晶得到半抗原產物。
取上述半抗原經核磁共振氫譜鑒定,結果見附圖2。1h-nmr(cdcl3,300mhz)δ:8.40(s,1h,arh),7.90(s,1h,arh),7.62(s,1h,arh),6.82(s,1h,arh),5.90(s,1h,-ch-),5.59(s,1h,-ch-),5.35(s,1h,-oh),4.30(d,1h,ch),3.04(s,1h,ch),2.76(s,1h,-ch-),1.88(d,2h,-ch2-)。圖譜中化學位移δ=8.40、7.90、7.62為間隔臂苯環上氫的共振吸收峰,這些峰的存在,證明間隔臂連接成功,嗎啡半抗原結構正確。
2、嗎啡偶聯抗原的合成及鑒定
免疫原制備——嗎啡半抗原與牛血清白蛋白(bsa)偶聯得到免疫原。
取11mg半抗原,溶解于1ml二甲基甲酰胺(dmf)中;稱取50mgbsa,使之充分溶解在3.8ml0.1mol/l碳酸鹽緩沖液(ph9.6)中,將溶解好的半抗原逐滴緩慢滴加到蛋白溶液中,并于室溫下攪拌24h,用0.01mol/lpbs4℃透析3d,每天換3次透析液;分裝,于-20℃保存備用。
包被原制備——嗎啡半抗原與卵清蛋白(ova)偶聯得到包被原。
取11mg半抗原,溶解于1mldmf中;稱取50mgova,使之充分溶解在3.8ml0.1mol/l碳酸鹽緩沖液(ph9.6)中,將溶解好的半抗原逐滴緩慢滴加到蛋白溶液中,并于室溫下攪拌24h,用0.01mol/lpbs4℃透析3d,每天換3次透析液;分裝,于-20℃保存備用。
按合成嗎啡偶聯抗原反應所用半抗原、載體蛋白與偶聯產物的比例,進行紫外(200nm~400nm)掃描測定,通過比較三者分別在260nm和280nm的吸光值計算其結合比。偶聯物嗎啡半抗原-載體蛋白的最大吸收峰與嗎啡半抗原、載體蛋白的最大吸收峰相比發生了明顯的變化,表明嗎啡半抗原-載體蛋白的合成是成功的。經計算,半抗原與bsa的結合比為14:1,與ova的結合比為10:1。
3、嗎啡單克隆抗體的制備
(1)雜交瘤細胞的獲得
1)首次免疫:將嗎啡半抗原-bsa偶聯物(免疫原)與等量的弗氏完全佐劑充分乳化,皮下注射6周齡的balb/c小鼠,每只0.2ml;
2)加強免疫兩次:從首次免疫開始,每兩周加強免疫一次,用弗式不完全佐劑代替弗氏完全佐劑,方法和劑量同首次免疫;
3)最后一次加強免疫一周后眼底靜脈采血測效價和抑制,有抑制且效價達到1:10000以上時進行如下末次免疫:腹腔注射不加任何佐劑的免疫原溶液0.1ml,三天后處死小鼠,取其脾臟與骨髓瘤細胞融合;
4)采用間接競爭酶聯免疫分析方法測定細胞上清液,篩選陽性孔。利用有限稀釋法對陽性孔進行克隆化,得到并建立穩定分泌嗎啡單克隆抗體的雜交瘤細胞株,取處于對數生長期的雜交瘤細胞用凍存液制成細胞懸液,分裝于凍存管,在液氮中長期保存。
(2)單克隆抗體的制備
1)細胞復蘇:取出嗎啡單克隆抗體雜交瘤細胞株凍存管,立即放入37℃水浴中速融,離心去除凍存液后,移入培養瓶內培養;
2)制備腹水與抗體純化:采用體內誘生法,將balb/c小鼠(8周齡)腹腔注入滅菌石蠟油0.5ml/只,7天后腹腔注射雜交瘤細胞5×105個/只,7天后采集腹水。用辛酸-飽和硫酸銨法進行純化,得到嗎啡單克隆抗體溶液(-20℃保存)。
(3)單克隆抗體效價的測定
用間接競爭elisa法測定抗體的效價為1:(100000~500000)。
間接競爭elisa方法:用嗎啡半抗原-ova偶聯物包被酶標板,加入嗎啡標準品溶液、嗎啡單克隆抗體溶液和辣根過氧化物酶標記的羊抗鼠抗抗體溶液,25℃反應30min,倒出孔內液體,用洗滌液洗滌3~5次,用吸水紙拍干;加入底物顯色液,25℃反應15min后,加入終止液終止反應;設定酶標儀于波長450nm處測定每孔吸光度值。
(4)單克隆抗體特異性的測定
抗體特異性是指它同特異性抗原結合的能力與同該類抗原類似物結合能力的比較,常用交叉反應率作為評價標準。交叉反應越小,抗體的特異性則越高。
本實驗將嗎啡、可待因、蒂巴因、那可汀、罌粟堿做系列稀釋,分別與單克隆抗體進行間接競爭elisa,制作標準曲線,分析得到ic50,然后按下式計算交叉反應率:
結果顯示各類似物的交叉反應率為:嗎啡100%、可待因150%、蒂巴因40%、那可汀<1%、罌粟堿<1%。本發明抗體對蒂巴因、那可汀、罌粟堿等其他藥物無交叉反應,只針對嗎啡及可待因有特異性結合。
4、羊抗鼠抗抗體的制備
以羊為免疫動物,以鼠源抗體為免疫原免疫無病原體羊,得到羊抗鼠抗抗體。
5、酶標記抗抗體的制備
將羊抗鼠抗抗體與辣根過氧化物酶(hrp)采用改良后的過碘酸鈉法進行偶聯。傳統的過碘酸鈉法要求反應體系中酶與抗體的摩爾濃度比為4:1,由于辣根過氧化物酶在強氧化作用下產生許多與抗體結合的位點,這樣活化的辣根過氧化物酶分子充當了連接各分子的橋梁,降低了酶標記物的酶活性,使制備的偶聯物中混有許多聚合體。為了解決這個問題,我們將傳統的方法進行了改良,即:
(1)省去了氨基的封閉過程,因為能產生自身氨基連接的氨基實際很少;
(2)降低辣根過氧化物酶與抗體的摩爾濃度比率至2:1,改良后的方法比傳統的方法簡便,對酶活性的損失減少。
6、酶標板的制備
用包被緩沖液將包被原(嗎啡半抗原-ova偶聯物)稀釋成20μg/ml,每孔加入100μl,37℃避光孵育2h,傾去孔中液體,用洗滌液洗滌2次,每次30s,拍干,然后在每孔中加入200μl封閉液,37℃避光孵育2h,傾去孔內液體拍干,干燥后用鋁膜真空密封保存。
實施例2檢測嗎啡及可待因的酶聯免疫試劑盒的組建
組建檢測嗎啡及可待因的酶聯免疫試劑盒,使其包含下述組分:
(1)包被嗎啡偶聯抗原的酶標板;
(2)嗎啡標準品溶液6瓶,濃度分別為0μg/l、0.3μg/l、0.9μg/l、2.7μg/l、8.1μg/l、24.3μg/l;
(3)嗎啡單克隆抗體工作液;
(4)用辣根過氧化物酶標記的羊抗鼠抗抗體;
(5)底物顯色液由a液和b液組成,a液為過氧化脲,b液為四甲基聯苯胺;
(6)終止液為2mol/l硫酸;
(7)洗滌液為ph為7.6,含有0.8%~1.2%吐溫-20和0.01‰~0.02‰疊氮化鈉的0.2~0.4mol/l磷酸鹽緩沖液;
(8)復溶液為ph為7.6,含有9%~12%卵清蛋白的0.1~0.3mol/l磷酸鹽緩沖液。
實施例3火鍋底料及辣椒醬樣品中嗎啡及可待因的檢測
1、樣品前處理
稱取1.0g±0.05g均質后的樣品至50ml聚苯乙烯離心管中,分別加入10ml乙醇,用渦旋儀渦動5min,3000g室溫(20~25℃)離心5min;移取1ml上層有機相(若上層有懸浮物應避開)至10ml潔凈干燥玻璃管中,于50~60℃水浴氮吹至干;加入1ml正己烷,用渦旋儀渦動2min至油脂溶解,再加入1ml復溶液,繼續渦動3min至均勻;將混勻后的液體移入2ml離心管中,4500g室溫(20~25℃)離心2min;去除上層油脂層及乳化層,取下層50μl用于分析。
2、用試劑盒檢測
向包被有嗎啡偶聯抗原的酶標板微孔中加入嗎啡標準品溶液或經前處理的樣品溶液50μl/孔,然后加入辣根過氧化物酶標記的羊抗鼠抗抗體50μl/孔,再加入嗎啡單克隆抗體工作液50μl/孔,輕輕振蕩混勻,用蓋板膜蓋板后置25℃避光反應30min;倒出孔內液體,每孔加入250μl洗滌液充分洗滌4~5次,每次間隔10s,用吸水紙拍干;每孔加入底物顯色液a液過氧化脲50μl,底物顯色液b液四甲基聯苯胺(tmb)50μl,輕輕振蕩混勻,用蓋板膜蓋板后置25℃避光顯色15min,每孔加入終止液2mol/l硫酸50μl,輕輕振蕩混勻,用酶標儀波長設定在450nm處,測定每孔吸光度值(od值)。
3、檢測結果分析
用所獲得的每個濃度的標準品溶液的吸光度平均值(b)除以第一個標準品溶液(0標準)的吸光度值(b0)再乘以100%,得到百分吸光度值。以嗎啡標準品濃度(μg/l)的對數值為x軸,百分吸光度值為y軸,繪制標準曲線,如圖3所示。用同樣的辦法計算樣品溶液的百分吸光度值,相對應每一個樣品的嗎啡及可待因含量則可從標準曲線上讀出。
實施例4嗎啡及可待因酶聯免疫試劑盒技術參數的確定試驗
1、試劑盒靈敏度和檢測限
按照常規方法測定試劑盒靈敏度,試劑盒標準曲線最低點為0.3μg/l,標準曲線的范圍為0.3~24.3μg/l,ic50(50%抑制濃度)浮動范圍為0.8~1.2μg/l;對空白火鍋底料、辣椒醬樣品各20份進行檢測,從標準曲線上查出對應于各百分吸光度值的濃度,以20份樣品濃度的平均值加上3倍標準差表示檢測限,結果得該方法對火鍋底料、辣椒醬樣品的檢測限為5μg/kg。
2、樣品精密度和準確度試驗
以回收率作為準確度評價指標,重復測定某一濃度樣品的檢測結果相對標準偏差(rsd%)作為精密度評價指標。計算公式為:回收率(%)=實際測定值/理論值×100%,其中理論值為樣品的添加濃度;相對標準偏差rsd%=sd/x×100%,其中sd為標準偏差,x為測定數據的平均值。
按5μg/kg、10μg/kg、20μg/kg三個濃度嗎啡及可待因對火鍋底料、辣椒醬樣品進行添加回收測定,每個樣品做4個平行,用三批不同試劑盒進行測定,計算樣品的平均回收率及精密度結果見下表。
表1精密度及準確度試驗
以5、10、20μg/kg三個濃度嗎啡及可待因對火鍋底料、辣椒醬樣品進行添加,平均回收率在80%~120%之間;批內、批間相對標準偏差均小于15%。
3、試劑盒穩定性試驗
試劑盒保存條件為2~8℃,經過12個月的測定,試劑盒的最大吸光度值(零標準)、50%抑制濃度、嗎啡及可待因添加實際測定值均在正常范圍之內。考慮在運輸和使用過程中,會有非正常保存條件出現,將試劑盒在37℃保存條件下放置7天,進行加速老化實驗,結果表明該試劑盒各項指標完全符合要求。考慮到試劑盒冷凍情況發生,將試劑盒放入-20℃冰箱冷凍7天,測定結果也表明試劑盒各項指標完全正常。從以上結果可得出試劑盒可以在2~8℃至少保存12個月以上。
- 還沒有人留言評論。精彩留言會獲得點贊!