用于DNA原位合成的電化學芯片及DNA原位合成方法與流程
本發明涉及DNA合成,尤其涉及一種用于DNA原位合成的電化學芯片,以及一種電化學芯片DNA原位合成方法。
背景技術:
基因芯片(gene chip,DNA chip,DNA microarray)又被稱為DNA芯片、DNA微陣列或生物芯片,是指以大量人工合成的或應用常規分子生物學技術獲得的核酸片段作為探針,按照特定的排列方式和特定的手段固定在硅片、載玻片或塑料片上,一個指甲蓋大小的芯片上排列的探針可以多達上萬個。在使用時,先將所研究的樣品標記,然后與芯片上的寡聚核苷酸探針雜交,再用激光共聚焦顯微鏡等設備對芯片進行掃描,配合計算機軟件系統檢測雜交信號的強弱,從而高效且大規模地獲得相關的生物信息。此項技術將大量的核酸分子同時固定在載體上,一次可檢測分析大量的DNA和RNA,解決了傳統核酸印跡雜交技術復雜、自動化程度低、檢測目標分子數量少、成本高、效率低等的缺點。
另外,通過設計不同的探針陣列(array),利用雜交譜重建DNA序列,還可實現雜交測序(sequencing by hybridization,SBH)。目前,該技術在基因表達研究、基因組研究、序列分析及基因診斷等領域已顯示出重要的理論和應用價值。
隨著基因芯片技術的不斷完善和發展,出現多種芯片技術。最初的芯片主要目標是用于DNA序列的測定、基因表達圖譜鑒定及基因突變體的監測和分析,因此稱為基因芯片。但目前這一技術已擴展到非核酸領域,如已出現了蛋白質芯片分析技術、Biacore技術和絲網印刷技術等。在這一發展趨勢下,芯片技術現多被稱為生物芯片技術。基因芯片技術是分子生物學中常用分子雜交技術的擴展。其基本做法是將大量的核酸片段有規則地固定在某種介質上,制成芯片,然后將要檢測的樣品加以標記,再與做成的芯片充分雜交,加以洗脫,用圖像顯示出來。目前適用于制作芯片的載體材料主要有半導體硅片、玻璃片、金屬片、各種有機高分子制作的薄膜等。
基因芯片一般有兩種制作方法。一種為合成后交聯(post-synthetic attachment),多用于大片段DNA,有時也適合于寡核苷酸甚至mRNA;另一種為原位合成(in-situ synthesis),適合于寡核苷酸。其中,常見的原位合成方法有光導原位合成法、電壓打印法、流體通道合成法、分子印章法和機械點涂法。這些方法操作成本很高,工藝較為復雜,重復性較差,并且在單位面積上探針的數量會受 到技術的限制。
本發明提供了一種電化學芯片DNA原位合成方法,通過計算機控制芯片上電極的電位實現DNA的穩定、準確的原位合成,進而實現DNA的自動原位合成。
技術實現要素:
有鑒于現有技術的缺陷,本發明所要解決的技術問題是,提供一種電化學芯片DNA原位合成方法,通過計算機控制芯片上電極的電位實現DNA的穩定、準確的原位合成,進而實現DNA的自動原位合成。
具體地說,本發明提供了一種用于DNA原位合成的電化學芯片,其特征在于,包括反應區,該反應區包括電極區與涂覆于該電極區表面的高分子聚合物,所述電極區包括至少一個鉑電極,所述高分子聚合物在所述電極的另一側具有堿基序列連接端,并且此堿基序列連接端連接有保護基團。
本發明還提供了一種基于上述電化學芯片進行DNA原位合成方法,包括
在所述電化學芯片的反應區的外側表面覆蓋電解質溶液;
將選定電極置于高電位,從而在所述電極周圍、反應液中產生氫離子;
連接于所述電化學芯片表面堿基序列連接端的保護基團在所述氫離子提供的局部酸性環境中脫去;
恢復所述電極的電位,將所述反應區的外側表面的電解質溶液替換為反應液,所述反應液呈堿性并溶解有一端連有保護基團的堿基;
所述一端連有堿基保護基團的堿基連接到所述堿基序列連接端;
去除所述反應液。
進一步地,所述電解質溶液呈堿性。
進一步地,恢復所述電極的電位,將所述反應區的外側表面的電解質溶液替換為反應液,所述反應液反應液呈堿性并溶解有一端連有保護基團的堿基包括
將所述電極的電位置于零電位;
吸取所述電解質溶液;
使用第一緩沖液沖洗所述反應區的外側表面;
在所述反應區的外側表面覆蓋反應液,其中溶解有一端連有保護基團的堿基。
進一步地,所述第一緩沖液為醋酸鹽緩沖液、碳酸鹽緩沖液、檸檬酸鹽緩沖液、HEPES緩沖液、MOPS緩沖液、磷酸鹽緩沖液、TRIS緩沖液或碘酸鉀溶液。
進一步地,所述反應液呈堿性。
進一步地,所述去除所述反應液包括
吸取所述反應液;
使用第二緩沖液沖洗所述反應區的外側表面。
進一步地,所述第二緩沖液為醋酸鹽緩沖液、碳酸鹽緩沖液、檸檬酸鹽緩沖液、 HEPES緩沖液、MOPS緩沖液、磷酸鹽緩沖液、TRIS緩沖液或碘酸鉀溶液。
本發明提供的電化學DNA原位合成方法通過改變特定電極的電位,實現DNA的穩定和準確的原位合成;結合計算機控制和自動控制技術,還可實現DNA的自動原位合成,降低基因芯片的合成成本,精度也大為提高。
以下將結合附圖對本發明的構思、具體結構及產生的技術效果作進一步說明,以充分地了解本發明的目的、特征和效果。
附圖說明
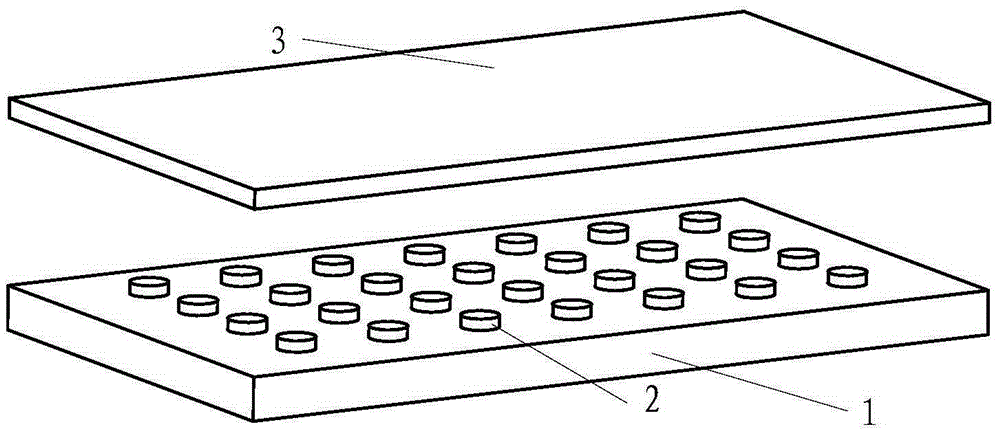
圖1是一種電化學芯片上鉑電極在底板上的排列示意圖;
圖2是一種電化學芯片的主要結構示意圖;
圖3是電化學芯片上鉑電極和高分子聚合物在底板上的位置示意圖;
圖4示出了高分子聚合物表面的堿基序列連接端以及其上連接的保護基團;
圖5是電化學芯片表面覆蓋有電解質溶液時的示意圖;
圖6是將圖5中左側鉑電極置于高電位時的反應示意圖;
圖7是將圖6中的電解質溶液替換為反應液時的示意圖,其中鉑電極已在低電位;
圖8是5’端保護的堿基連接到脫去保護的堿基序列連接端的反應示意圖;
圖9是將圖8中的反應液替換為電解質溶液時的示意圖;
圖10是繼續將圖5中左側鉑電極置于高電位時的反應示意圖;
圖11是將圖10中的電解質溶液替換為反應液時的示意圖,其中鉑電極已在低電位;
圖12是5’端保護的堿基連接到事先已經連接于堿基序列連接端、并已脫去保護的堿基的反應示意圖;
圖13是將圖12中的反應液替換為電解質溶液時的示意圖;
圖14是將圖5中右側鉑電極置于高電位時的反應示意圖;
圖15是將圖14中的電解質溶液替換為反應液時的示意圖,其中鉑電極已在低電位;
圖16是5’端保護的堿基連接到脫去保護的堿基序列連接端的反應示意圖;
圖17是去除圖16中反應液并用緩沖液沖洗電化學芯片表面的示意圖,其中鉑電極已在低電位;
圖1-圖17中,1-基板,2-鉑電極,3-高分子聚合物,4-堿基序列連接端,5-保護基團,6-電解質溶液,7-5’端保護的堿基,8-反應液,9-脫去保護的堿基。
具體實施方式
下面詳細描述本發明的實施例,所述實施例的示例在附圖中示出,其中自始至 終相同或類似的標號表示相同或類似的元件或具有相同或類似功能的元件。下面通過參考附圖描述的實施例是示例性的,旨在用于解釋本發明,而不能理解為對本發明的限制。
在本發明的描述中,需要理解的是,術語“中心”、“縱向”、“橫向”、“長度”、“寬度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“豎直”、“水平”、“頂”、“底”“內”、“外”、“順時針”、“逆時針”等指示的方位或位置關系為基于附圖所示的方位或位置關系,僅是為了便于描述本發明和簡化描述,而不是指示或暗示所指的裝置或元件必須具有特定的方位、以特定的方位構造和操作,因此不能理解為對本發明的限制。
此外,術語“第一”、“第二”僅用于描述目的,而不能理解為指示或暗示相對重要性或者隱含指明所指示的技術特征的數量。由此,限定有“第一”、“第二”的特征可以明示或者隱含地包括一個或者更多個該特征。在本發明的描述中,“多個”的含義是兩個或兩個以上,除非另有明確具體的限定。
在本發明中,除非另有明確的規定和限定,術語“安裝”、“相連”、“連接”、“固定”等術語應做廣義理解,例如,可以是直接相連,也可以通過中間媒介間接相連。對于本領域的普通技術人員而言,可以根據具體情況理解上述術語在本發明中的具體含義。
在本發明中,除非另有明確的規定和限定,第一特征在第二特征之“上”或之“下”可以包括第一和第二特征直接接觸,也可以包括第一和第二特征不是直接接觸而是通過它們之間的另外的特征接觸。而且,第一特征在第二特征“之上”、“上方”和“上面”包括第一特征在第二特征正上方和斜上方,或僅僅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”包括第一特征在第二特征正上方和斜上方,或僅僅表示第一特征水平高度小于第二特征。
圖1是一種電化學芯片的基板1的結構示意圖,其上設置有鉑電極2的陣列。如圖2所示,在基板1及鉑電極2的表面涂覆有高分子聚合物3,厚度為10-30μm。DNA原位合成即是在高分子聚合物3圖示位置的上表面進行。
圖3示出了基板1、鉑電極2及高分子聚合物3的相對位置關系。
需要說明的是,在高分子聚合物3表層具有特殊結構,即其表面具有堿基序列連接端4,堿基序列連接端4連接有保護基團5。其結構已經在圖4中示出。相鄰鉑電極2的中心之間的距離為300μm。雖然相鄰鉑電極2之間也具有相同結構,但是因為原位合成的過程中并不涉及,故已省略。
如圖5,在高分子聚合物3表面覆蓋一層電解質溶液6(NaCO3溶液,其濃度為0.05mol/L),覆蓋過程為將電解質溶液6充入高分子聚合物3表面設置的反應室(未示出)。后續各步驟的溶液覆蓋和沖洗均通過在這樣的反應室內充入溶液進行,不 再贅述。電解質溶液6呈現堿性,其pH約為9。保護基團5在堿性環境中并不會脫去,但是在酸性環境中會脫去。
為便于說明,本實施例以兩個相鄰的鉑電極為例說明,但是這并不暗示參與反應的鉑電極之間有任何位置關系的要求;事實上,實際操作過程中,本例所述的反應過程可以發生在任一設置于基板上的鉑電極位置。
如圖6所示,給左側的鉑電極2通電,提高其電位至+5V,在其對應位置的電解質溶液中會局部聚集H+離子,從而形成酸性微環境,使對應位置堿基序列連接端4所連接的保護基團5脫去,而右側鉑電極2附近的堿基序列連接端不受影響。通電過程持續約8s。恢復所有通電鉑電極2的電位。
用HEPES緩沖溶液沖洗高分子聚合物3的表面,再如圖7所示在高分子聚合物3表面覆蓋溶解有5’端保護的堿基7的反應液8。那么,5’端保護的堿基7的3’端連接到已經脫去保護基團5的堿基序列連接端4,而沒有脫去保護基團5的堿基序列連接端4則不能連接5’端保護的堿基7,如圖8。此處堿基可為鳥嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一種。
如圖9,用HEPES緩沖溶液沖洗高分子聚合物3的表面三次,再覆蓋電解質溶液6。此時,需要在左側的鉑電極2表面的高分子聚合物3已經連接的5’端保護的堿基7末端繼續連接堿基。則,如圖10所示仍將左側鉑電極2置于+5V,與前述過程類似,小范圍聚集的H+形成的局部酸性環境使之前連接的5’端保護的堿基7所連接的保護基團5脫去。
用HEPES緩沖溶液沖洗高分子聚合物3的表面,再如圖11所示在高分子聚合物3表面覆蓋溶解有5’端保護的堿基7的反應液8。此處堿基可為鳥嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一種。
如圖12,后續加入的5’端保護的堿基7連接到前述已經脫去保護基團并連接于堿基序列連接端4的堿基上。
使用HEPES緩沖溶液沖洗高分子聚合物3的表面三次,再覆蓋電解質溶液6。此時需要在右側鉑電極對應的高分子聚合物3表面連接堿基,則將右側鉑電極2置于高電位的+5V,如圖14,局部的酸性環境使堿基序列連接端4連接的保護基團5脫去。
用HEPES緩沖溶液沖洗高分子聚合物3的表面,再如圖15所示在高分子聚合物3表面覆蓋溶解有5’端保護的堿基7的反應液8。此處堿基可為鳥嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一種。則此處添加的5’端保護的堿基7的3’端如圖16所示連接于堿基序列連接端4。
使用HEPES緩沖溶液沖洗高分子聚合物3的表面三次,此時在高分子聚合物3表面得到長度分別為2個堿基和3個堿基的兩種堿基鏈,如圖17。堿基可為鳥嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一種。
以上步驟描述了通過改變鉑電極2的電位從而在高分子聚合物3表面連接堿基的過程。后續需要合成結構更加復雜的用于實用目的的堿基鏈,可以重復上述類似的過程,直至得到所需的堿基鏈,可用于實驗或診斷目的,例如制作DNA探針。
以上詳細描述了本發明的較佳具體實施例。應當理解,本領域的普通技術人員無需創造性勞動就可以根據本發明的構思作出諸多修改和變化。因此,凡本技術領域中技術人員依本發明的構思在現有技術的基礎上通過邏輯分析、推理或者有限的實驗可以得到的技術方案,皆應在由權利要求書所確定的保護范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!