一種養血清腦顆粒神經元保護生物活性的測定方法與流程
本發明涉及一種中成藥的質量控制方法,特別涉及一種養血清腦顆粒中神經元保護生物活性的測定方法。
背景技術:
:
中藥質量控制一直是中藥現代化一大難題,也是中藥走向世界的瓶頸;單味中藥材本身已是一個復雜體系,那么由多味中藥組成的復方制劑,其系統的復雜程度更不言而喻,這使得復方制劑的質量控制變得愈加困難。中藥質量控制的最終目的是保證中藥的安全性和有效性;而現行中藥制劑質量控制方法如常規鑒別檢查、少數幾個指標性成分含量測定以及化學指紋圖譜相似性評價等則主要用于評價其表觀成分的一致性,不僅無法關聯藥效或毒副作用,且存在被勾兌的風險。同時,表觀化學成分的重現也可能導致對樣品質量合格與否的誤判,其潛在風險更大。生物活性測定方法因具有整體可控、藥效相關等技術優勢,作為符合中醫藥特點的適用質量控制模式及方法,漸已成為中藥質量控制和評價的重要發展方向之一。同時,國家藥典委員會已明確表示“中藥質量標準逐步由單一指標成分定性定量測定開始向活性有效成分及生物檢定的綜合檢測過渡”,與國內一致,美國植物藥指南中關于藥材、提取物、制劑的質量標準制定中也一直強調增加生物測試項目(Biological assay)。因此,生物活性測定方法可有效地彌補現行化學成分層面難以全面監控中藥復方質量的局限。在以前的研究中,我們已成功地將斑馬魚模型應用于藥物藥效學、毒理學及藥物代謝中。
養血清腦顆粒是在中國傳統名方四物湯的基礎上,以當歸、川芎、鉤藤、白芍、夏枯草等11味中藥組成,具有養血平肝、活絡止痛的功效,主要用于血虛肝旺所致頭痛,眩暈眼花,心煩易怒,失眠多夢,是受國家重點保護的中藥品種。
本發明在現有技術的基礎上,以養血清腦顆粒為研究對象,建立了一種養血清腦顆粒的質量控制方法,本發明選用斑馬魚神經元損傷模型,對不同批次的養血清腦顆粒的生物活性進行檢測,確立標準的養血清腦顆粒生物活性指標,以對生產中的養血清腦顆粒進行相同的指標檢測,以控制生產質量,同時建立了中藥復方 質量標準中“生物活性測定”方法,同時也為其他藥效物質不清楚的復方中藥的生物活性質量控制研究提供相應參考。
技術實現要素:
:
為此,本發明提供一種養血清腦顆粒生物活性的檢測方法,所述方法步驟如下:
步驟1,對照品溶液的制備,
步驟2,供試品溶液的制備,
步驟3,用斑馬魚神經元損傷模型對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率。
其中,所述對照品溶液的制備,方法如下:
取二甲基亞砜用蒸餾水配制成0.01-0.3%的溶液,作為溶劑對照組;
取還原性谷胱甘肽用蒸餾水配制成0.1-1.0mol.L-1的溶液,作為陽性對照組。
優選的,所述對照品溶液的制備,方法如下:
取二甲基亞砜用蒸餾水配制成0.1%的溶液,作為溶劑對照組;
取還原性谷胱甘肽用蒸餾水配制成0.5mol.L-1的溶液,作為陽性對照組。
其中,所述供試品溶液的制備,方法如下:
取供試品適量,用超純水分別溶解并稀釋至1000,750,500,250,100μg·mL-1,即得。
其中,所述斑馬魚神經元損傷模型,方法如下:
用0.2~0.3mol·mL-1嗎替麥考酚酯對受精后24h野生型AB系斑馬魚胚胎處理20-25h;用吖啶橙染料染色,凋亡細胞呈熒光綠色,熒光顯微鏡下拍照觀察斑馬魚神經凋亡細胞熒光強度來判斷造模成功率。斑馬魚選用的是受精后24h野生型AB系斑馬魚胚胎。
其中,所述對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率方法如下:
將對照溶液和供試品溶液分別加入斑馬魚神經元損傷模型中處理后,使用三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色后在熒光顯微鏡下觀察、拍照,統計斑馬魚凋亡細胞熒光強度F,定量計算評價養血清腦顆粒對神經細胞保護率P%,用GraphPad軟件對實驗結果統計,用方差分析和Dunnett’s T-檢驗進行統計學分析。
其中的神經細胞保護率P%計算公式如下:
F為斑馬魚凋亡細胞熒光強度。
優選的方法如下:
分別取溶劑對照組溶液、陽性對照組溶液和各濃度供試品溶液各2-10mL,分別注入斑馬魚神經元損傷模型中處理24h后,使用0.3~0.8mmol·L-1的三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色1-2h,染色結束后在熒光顯微鏡下觀察、拍照。
更優選的,方法如下:
分別取溶劑對照組溶液、陽性對照組溶液和各濃度供試品溶液各5mL,分別注入斑馬魚神經元損傷模型中處理24h后,使用0.64mmol·L-1的三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色1h,染色結束后在熒光顯微鏡下觀察、拍照。
本發明還提供一種養血清腦顆粒生物活性的檢測方法,所述方法還包括步驟4,利用步驟3測定不同批次的養血清腦顆粒,計算確定出標準的養血清腦顆粒生物活性指標,并以該指標為依據對生產過程中或儲存過程中的養血清腦顆粒進行生物活性檢測以確定養血清腦顆粒的質量是否合格。
本發明的方法是經過篩選獲得的,篩選方法如下:
1、實驗材料:
1.1實驗儀器與試藥
IPP6.0圖像處理軟件(Media Cybernetics公司),Nest Biotech 6孔板,熒光顯微鏡(深圳市科視威光學儀器有限公司)。嗎替麥考酚酯(阿拉丁試劑有限公司,批號:128794-94-5),還原型谷胱甘肽(阿拉丁試劑有限公司,批號:70-18-8),吖啶橙染料(Sigma-Aldrich西格瑪奧德里奇(上海)貿易有限公司,批號:494-38-2),養血清腦顆粒(天津天士力制藥集團有限公司),6批效期內制劑批號(S1~S6):130225,130226,130175,130565,130601,130606;3批過期制劑批號(S7~S9):090829,091134,091211。3批特殊處理制劑批號(S10~S12):130225。
1.2實驗動物
斑馬魚是目前生命科學研究中重要的模式脊椎動物之一,作為一種新型的模式動物,斑馬魚具有典型的脊椎動物腦部特征,神經行為遵循順序發育原則。與嚙齒動物模型相比,它具有飼養經濟,產卵量大,發育快速,胚胎透明,易于觀察,動物產生的應激少以及實驗結果比較客觀等優點。目前模式動物斑馬魚已廣泛應用于神經發育、神經損傷和神經行為學等神經科學研究。因此,本發明采用標準化的斑馬魚神經元損傷藥效模型,采用AO染色與凋亡細胞熒光強度定量分析可對藥物的體內神經細胞保護效率進行快速、可靠的評價。
斑馬魚選用的是受精后24h野生型AB系斑馬魚胚胎;胚胎的繁殖以自然成對交配的方式進行。在28℃條件下用養魚用水孵育胚胎(養魚用水水質:每1L反滲透水中加入200mg速溶海鹽,電導率為480~510μS·cm-1;pH為6.9~7.2;硬度為53.7~71.6mg·L-1 CaCO3)。因為胚胎可以從自身的卵黃囊中獲取營養物質,所以在受精后9天內不需要喂食。用0.64mmol·L-1的三卡因甲磺酸對斑馬魚胚胎進行過度暴露處理,從而將斑馬魚麻醉處死;麻醉處死的操作步驟符合美國獸醫協會(AVMA)對動物麻醉處死的規范要求。
斑馬魚胚胎由杭州環特生物科技有限公司提供,使用許可證號:SYXK(浙)2012-0171。
2、斑馬魚神經元損傷模型建立
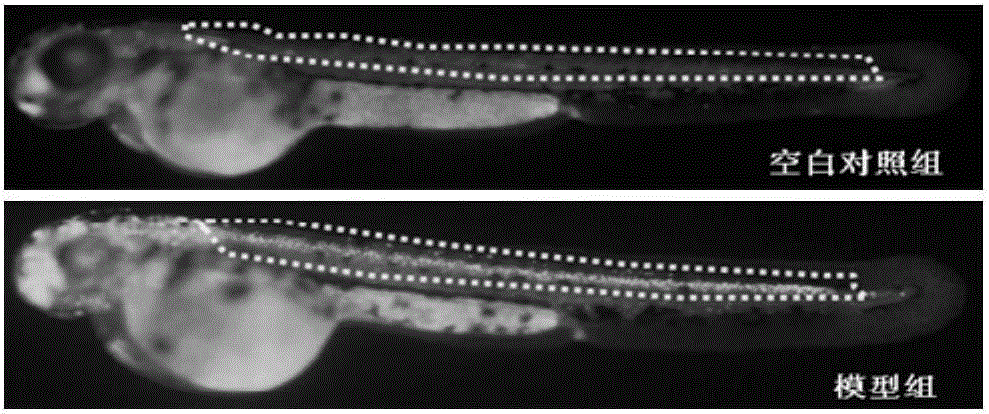
用0.25mol·mL-1嗎替麥考酚酯(MMF)對受精一天野生型AB系胚胎斑馬魚處理24h,誘導斑馬魚中樞神經損傷模型;吖啶橙(AO)染料染色,凋亡細胞呈熒光綠色,熒光顯微鏡下拍照觀察斑馬魚神經凋亡細胞熒光強度來判斷造模成功率(造模成功率95%),如圖1所示。
斑馬魚凋亡細胞熒光強度定量分析可對藥物對神經細胞保護效率進行快速、可靠的評價。
3、供試品溶液的制備
取不同批次的養血清腦顆粒制劑適量,用超純水溶解,作為藥液母液,置4℃冰箱備用;用超純水稀釋到相應濃度進行藥效活性檢測。
4、神經細胞保護藥效測定方法建立
養血清腦顆粒作為11味中藥組成的大復方,在缺血性腦血管病的治療中被廣泛應用,臨床療效顯著,安全可靠。前期藥理研究表明,養血清腦顆粒通過選擇性的抑制谷氨酸、caspase-3的表達,并且通過谷氨酸鹽合成酶選擇性抑制興奮性 氨基酸谷氨酸的神經毒性作用,減少神經細胞的死亡,從而發揮神經保護作用。根據養血神經保護機制,選擇同樣是通過抑制谷氨酸表達發揮神經元保護作用的還原性谷胱甘肽作為陽性對照藥。
選用受精一天的野生型AB系斑馬魚胚胎,將受精20-25h斑馬魚胚胎放入6孔板中,加入培養基3mL,每孔加入30條幼魚胚胎,嗎替麥考酚酯(MMF)造模但無藥物治療組為模型組,0.1%DMSO為溶劑對照組,0.50mol·L-1還原型谷胱甘肽(GSH)為陽性對照組,將供試品溶液制備中的養血清腦顆粒(工作參照物S1,批號:130225)母液用超純水分別稀釋至1000,750,500,250,100μg·mL-1各5mL,作為受試組,造模同時分別加入不同濃度的S1樣品處理24h。藥物處理結束后,使用0.64mM的三卡因甲磺酸對斑馬魚進行過度暴露處死;然后用AO染料對斑馬魚胚胎進行活體染色1h;染色結束后在熒光顯微鏡下觀察、拍照。統計斑馬魚凋亡細胞熒光強度(F),定量評價養血清腦顆粒神經細胞保護率P%效果。計算公式如下:
5、數據處理
GraphPad 5.0軟件對實驗結果統計,用方差分析和Dunnett’s T-檢驗進行統計學分析,*P<0.05,**P<0.01。
6、結果
各濃度養血清腦顆粒對斑馬魚凋亡細胞熒光強度F值與神經細胞保護率P%見表1。
如圖2所示,溶劑對照組斑馬魚中樞神經細胞凋亡較少,凋亡細胞熒光信號弱;嗎替麥考酚酯誘導的模型組斑馬魚中樞神經凋亡細胞非常明顯(P<0.01)。陽性對照治療藥谷胱甘肽組(GSH 0.50mol·L-1)神經保護藥效為104.6%,與模型組相比,斑馬魚中樞神經凋亡細胞顯著減少(P<0.01)。與模型組相比,養血清腦顆粒100,250,500,750和1000μg·mL-1組,神經細胞保護率分別為14.2%,20.5%,49.5%,65.1%和85.7%。
以藥物濃度(C)為橫坐標,以神經細胞保護率(P%)為縱坐標,通過試驗數 據進行線性回歸和計算,回歸方程為:P%=0.082C+4.439,r=0.995。以上結果表明在100~1000μg·mL-1內,養血對神經細胞保護率成良好的線性關系。另外用GraphPad 5.0軟件擬合量-效曲線,養血清腦顆粒對斑馬魚神經細胞保護作用EC50值為522μg·mL-1。因此選擇480-550μg·mL-1作為考察不同批次制劑神經保護作用的給藥濃度。
表1 養血清腦顆粒神經細胞保護作用(Mean±SD)
注:n為每組測定的斑馬魚數目;與模型組相比,*P<0.05,**P<0.01。
7、方法學考察
7.1精密度
分別平行制備三批養血清腦顆粒(S1,S2,S3)樣品3份,按照上述方法分別進行日內與日間精密度考察,重復操作6次。日內精密度采用三批制劑分別對同一批斑馬魚按本發明建立的方法進行測定;不同批次制劑的神經細胞保護率無明顯差異(P<0.05),RSD為2.2~3.7%。日間精密度考察采用同一批養血制劑對3個不同批次斑馬魚神經細胞保護率測定,不同批次斑馬魚之間的神經細胞保護率無顯著差異(P<0.05),RSD為1.2%。(表2)日內與日間精密度結果表明斑馬魚神經元損傷藥物評價模型具有很好的可靠性和重復性。
表2 養血清腦顆粒神經細胞保護藥效精密度考察
3.3.2重復性考察
平行制備養血清腦顆粒(S1)的6份,分別處理同一批次的斑馬魚24h,不同樣品處理后均有明顯的神經細胞保護藥效,且6個樣品處理組的斑馬魚神經細胞保護效率之間均無顯著性差異(P<0.05),RSD為8.4%(表3),表明該方法具有較好的重復性。
表3 養血清腦顆粒神經細胞保護藥效重復性考察
3.3.3穩定性考察
分別于0,3,6,12和24h將室溫放置的同一供試品溶液進行生物藥效活性檢測,計算RSD為4.9%,結果說明供試品溶液在室溫放置24h內是穩定的。
有益效果:
中藥成分復雜,單純效仿化學藥基于成分論的質量控制模式,對于物質基礎不明的中藥很難控制臨床上的有效性和安全性。因此,將生物測定引入到中藥質量控制與品質評價中來,是中藥質量控制模式和方法研究的重要發展方向。本發明中選擇的斑馬魚神經損傷模型具有關聯藥效,可測可評的優勢,同時本發明中使用的生物測試方法具有簡便、快速、穩定、可靠的優點。需要特別強調的是本方法的專屬性,根據養血清腦顆粒臨床上具有神經保護作用而選擇斑馬魚神經元損傷模型,同時根據神經細胞保護效率來定量評價養血清腦顆粒質量優劣,說明本方法具有較強的專屬性。但是,本方法同樣可用于其他類神經保護作用中藥產品的活性評價中,因此不具有排他性。本項研究為養血清腦顆粒的質量控制和品質評價提供了新的思路和技術支持,同時也有效的解決化學分析或指紋圖譜等方法在中藥質量控制方面存在的不足,是對中藥質量控制體系的有效補充與完善。本研 究可作為一種新型的生物活性質量評價方法推廣于其他類中藥生物質控中。
附圖說明
圖1嗎替麥考酚酯造模后斑馬魚表型圖(圖中熒光點為斑馬魚凋亡神經細胞)
圖2養血清腦顆粒神經保護作用表型圖
具體實施方式:
以下通過實施例進一步說明本發明。
實施例1
一種養血清腦顆粒生物活性的檢測方法,所述方法步驟如下:
步驟1,對照品溶液的制備,
步驟2,供試品溶液的制備,
步驟3,用斑馬魚神經元損傷模型對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率。
其中,所述對照品溶液的制備,方法如下:取二甲基亞砜用蒸餾水配制成0.1%的溶液,作為溶劑對照組;取還原性谷胱甘肽用蒸餾水配制成0.5mol.L-1的溶液,作為陽性對照組。
其中,所述供試品溶液的制備,方法如下:取供試品適量,用超純水分別溶解并稀釋至1000,750,500,250,100μg·mL-1,即得。
其中,所述斑馬魚神經元損傷模型,方法如下:用0.25mol·mL-1嗎替麥考酚酯對受精后24h野生型AB系斑馬魚胚胎處理24h;用吖啶橙染料染色,凋亡細胞呈熒光綠色,熒光顯微鏡下拍照觀察斑馬魚神經凋亡細胞熒光強度來判斷造模成功率。斑馬魚選用的是受精后24h野生型AB系斑馬魚胚胎。
其中,所述檢對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率方法如下:
分別取溶劑對照組溶液、陽性對照組溶液和各濃度供試品溶液各5mL,分別注入斑馬魚神經元損傷模型中處理24h后,使用0.64mmol·L-1的三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色1h,染色結束后在熒光顯微鏡下觀察、拍照。
其中,神經細胞保護率P%計算公式如下:
F為斑馬魚凋亡細胞熒光強度。
實施例2
一種養血清腦顆粒生物活性的檢測方法,所述方法步驟如下:
步驟1,對照品溶液的制備,
步驟2,供試品溶液的制備,
步驟3,用斑馬魚神經元損傷模型對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率。
其中,所述對照品溶液的制備,方法如下:取二甲基亞砜用蒸餾水配制成0.01%的溶液,作為溶劑對照組;取還原性谷胱甘肽用蒸餾水配制成0.1mol.L-1的溶液,作為陽性對照組。
其中,所述供試品溶液的制備,方法如下:取供試品適量,用超純水分別溶解并稀釋至1000,750,500,250,100μg·mL-1,即得。
其中,所述斑馬魚神經元損傷模型,方法如下:用0.2mol·mL-1嗎替麥考酚酯對受精后24h野生型AB系斑馬魚胚胎處理20h;用吖啶橙染料染色,凋亡細胞呈熒光綠色,熒光顯微鏡下拍照觀察斑馬魚神經凋亡細胞熒光強度來判斷造模成功率。斑馬魚選用的是受精后24h野生型AB系斑馬魚胚胎。
其中,所述檢對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率方法如下:
分別取溶劑對照組溶液、陽性對照組溶液和各濃度供試品溶液各2mL,分別注入斑馬魚神經元損傷模型中處理24h后,使用0.3mmol·L-1的三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色2h,染色結束后在熒光顯微鏡下觀察、拍照。
其中,神經細胞保護率P%計算公式如下:
F為斑馬魚凋亡細胞熒光強度。
實施例3
一種養血清腦顆粒生物活性的檢測方法,所述方法步驟如下:
步驟1,對照品溶液的制備,
步驟2,供試品溶液的制備,
步驟3,用斑馬魚神經元損傷模型對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率。
其中,所述對照品溶液的制備,方法如下:取二甲基亞砜用蒸餾水配制成0.3%的溶液,作為溶劑對照組;取還原性谷胱甘肽用蒸餾水配制成1.0mol.L-1的溶液,作為陽性對照組。
其中,所述供試品溶液的制備,方法如下:取供試品適量,用超純水分別溶解并稀釋至1000,750,500,250,100μg·mL-1,即得。
其中,所述斑馬魚神經元損傷模型,方法如下:用0.3mol·mL-1嗎替麥考酚酯對受精后24h野生型AB系斑馬魚胚胎處理25h;用吖啶橙染料染色,凋亡細胞呈熒光綠色,熒光顯微鏡下拍照觀察斑馬魚神經凋亡細胞熒光強度來判斷造模成功率。斑馬魚選用的是受精后24h野生型AB系斑馬魚胚胎。
其中,所述檢對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率方法如下:
分別取溶劑對照組溶液、陽性對照組溶液和各濃度供試品溶液各10mL,分別注入斑馬魚神經元損傷模型中處理24h后,使用0.8mmol·L-1的三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色1h,染色結束后在熒光顯微鏡下觀察、拍照。
其中,神經細胞保護率P%計算公式如下:
F為斑馬魚凋亡細胞熒光強度。
實施例4
一種養血清腦顆粒生物活性的檢測方法,所述方法步驟如下:
步驟1,對照品溶液的制備,
步驟2,供試品溶液的制備,
步驟3,用斑馬魚神經元損傷模型對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率。
其中,所述對照品溶液的制備,方法如下:取二甲基亞砜用蒸餾水配制成0.1%的溶液,作為溶劑對照組;取還原性谷胱甘肽用蒸餾水配制成0.5mol.L-1的溶液,作為陽性對照組。
其中,所述供試品溶液的制備,方法如下:取供試品適量,用超純水分別溶解并稀釋至1000,750,500,250,100μg·mL-1,即得。
其中,所述斑馬魚神經元損傷模型,方法如下:用0.25mol·mL-1嗎替麥考酚酯對受精后24h野生型AB系斑馬魚胚胎處理24h;用吖啶橙染料染色,凋亡細胞呈熒光綠色,熒光顯微鏡下拍照觀察斑馬魚神經凋亡細胞熒光強度來判斷造模成功率。斑馬魚選用的是受精后24h野生型AB系斑馬魚胚胎。
其中,所述檢對對照品溶液和供試品溶液進行檢測并計算供試品對神經細胞的保護率方法如下:
分別取溶劑對照組溶液、陽性對照組溶液和各濃度供試品溶液各5mL,分別注入斑馬魚神經元損傷模型中處理24h后,使用0.5mmol·L-1的三卡因甲磺酸對斑馬魚進行過度暴露處死,并用吖啶橙染料對斑馬魚胚胎進行活體染色2h,染色結束后在熒光顯微鏡下觀察、拍照。
其中,神經細胞保護率P%計算公式如下:
F為斑馬魚凋亡細胞熒光強度。
實施例5
按照本發明建立的生物活性測定方法測定不同生產批次的養血清腦顆粒制劑,其中包括在效期內的6批制劑,3批過期制劑,3批經破壞后的制劑;分別為高溫、光照、10%H2O2破壞后樣品。該12批制劑的神經細胞保護藥效結果見表4。結果可見不同條件下的養血樣品對斑馬魚神經細胞保護藥效有明顯差異,其中 S1~S6為效期內的合格制劑,其神經保護率在55.8~61.3%之間,具有顯著的神經細胞保護作用(P<0.01);S7~S9為過效期制劑,其神經保護率在26.7~46.3%之間,神經細胞保護率較低,與合格批次相比顯著性(P<0.01);S10~S12為經過特殊破壞后的制劑;其神經保護效率差異較大;以上結果提示通過斑馬魚神經細胞保護藥效活性測定可以定性的表征養血清腦顆粒質量的優劣。
表4 養血清腦顆粒神經保護藥效結果(Mean±SD)
注:與模型組相比,*P<0.05,**P<0.01。
本發明中斑馬魚神經損傷模型作為心腦血管藥物生物學內控檢測方法具有較好的精密度重復性,具有關聯藥效,可測可評的特點。本發明中選擇了不同批次的養血清腦顆粒制劑,根據前期化學成分研究結果選擇6批合格制劑,3批過期制劑以及3批經破壞后養血制劑進行生物活性質控評價,結果表明合格制劑均具有顯著的神經保護率,過期以及破壞性樣品的神經保護效率則大大降低,表明該方法可用于有效的區分合格與不合格樣品。
- 還沒有人留言評論。精彩留言會獲得點贊!