具有提高的靈敏度的納米線場效應晶體管生物傳感器的制作方法與工藝
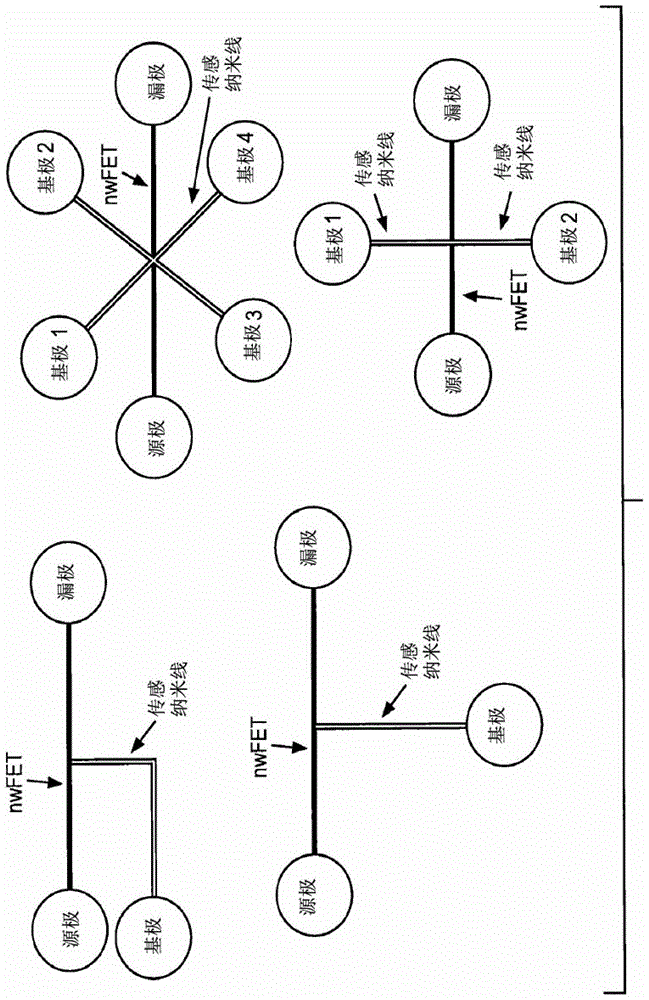
具有提高的靈敏度的納米線場效應晶體管生物傳感器交叉引用相關申請本申請根據35U.S.C.§119(e)要求2010年12月3日遞交的美國臨時申請系列號61/419,434和2011年6月7日遞交的美國臨時申請系列號61/494,373的權利,為所有的目的經由援引將二者以它們的全部內容合并入本文。發明背景帶電荷的生物分子、化學品和離子的實時的和無標記的傳感在很多應用中是有用的,例如毒素檢測、疾病診斷和藥物篩選。對于高特異性的生物分子檢測,已開發了分類為基于熒光的檢測或無標記的檢測的多種光學傳感方法。雖然基于熒光的檢測在一些情況下允許達到單個分子的靈敏度,但是不精確的每分子的熒光團數目限制了這些測定的定量性質。包括折射率變化、光學吸收、和拉曼光譜檢測的無標記的光學方法是相對簡單但是被可度量性和靈敏度所牽制。據研究高靈敏度的基于MEMS的機械生物傳感器使用光學或電子檢測設計之一以追蹤生物功能化的受體層和靶分子之間特異性結合時的懸臂位移。但是,為了提高靈敏度,必須減小懸臂尺寸到納米尺度,而這由于在點聚焦過程中的衍射損害了光學檢測的前途。雖然集成的壓阻的懸臂生物傳感器取消了光學檢測部件,但是這些裝置對準靜態表面層的固有檢測引起壓力并限制這些裝置用于追蹤基于親和性的納秒或微秒級的相互作用的隨機性。當靶分子存在于許多弱結合的物質中時,該限制特別確切。準-1-D半導體納米線特別適用于高靈敏度的無標記的檢測應用。它們微米尺度至納米尺度的體積和大的表面對體積比分別有利于批量檢測(bulkdetection)(例如,輻射和表面傳感),例如,用于檢測生物化學分子。此前半導體納米線已有配置為襯底柵控(substrate-gated)FET通道。在絕緣體層上暴露的Si納米線展現出對于免疫球蛋白<100fM和對于DNA的~10fM的檢測限(LOD)。這些傳感納米線也被集成入具有微流體模塊的檢測系統。發明概述對于集成的傳感系統的用途,硅納米線場效應晶體管(SinwFET)由于它們的可度量性和良好的靈敏度是特別有吸引力的。常規nwFET的共同缺陷是低水平的輸出信號,這影響了該裝置的最終性能。本發明解決了該問題和其它的需求。一方面,本發明涉及多線納米線場效應晶體管(nwFET)裝置。在一個實施方式中,該裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中傳感納米線的第一端與納米線FET連接以形成節點。傳感納米線和納米線FET各包含至少一種半導體材料。此外,納米線FET的第一端與源極(sourceelectrode)連接,納米線FET的第二端與漏極(drainelectrode)連接,且傳感納米線的第二端與基極(baseelectrode)連接。在進一步的實施方式中,傳感納米線的第一端以約10°和170°之間的角度與納米線FET連接。在一個實施方式中,該傳感納米線衍生有多個固定化的對感興趣的靶有特異性的捕獲探針。在進一步的實施方式中,該傳感納米線衍生有自由氨基。加到該裝置上的溶液的pH變化改變氨基上的電荷,并因此改變傳感納米線的電學性質,例如導電性。來自傳感納米線的信號由納米線FET放大產生較好的靈敏度。在另一實施方式中,nwFET裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,并且傳感納米線的第一端以約90°的角度與納米線FET連接以形成節點,從而產生T型構造。在一個實施方式中,傳感納米線的第一端和第二端與納米線FET的第一端和第二端在相同的平面。在另一實施方式中,傳感納米線的第二端與納米線FET的第一端和第二端在不同的平面。在一個實施方式中,提供了多線納米線場效應晶體管(nwFET)裝置。該裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中傳感納米線的第一端與納米線FET連接以形成節點,納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,傳感納米線的第二端與基極連接。所述傳感納米線和納米線FET各包含至少一種半導體材料。在進一步的實施方式中,傳感納米線的第一端以約10°和約170°之間的角度與納米線FET連接。在進一步的實施方式中,在硅襯底上例如在氧化硅上制作納米線。在甚至進一步的實施方式中,傳感納米線和納米線FET具有約一個或更多個相同的尺寸(例如,大約相同的高度、寬度、寬高比和/或長度)。另一方面,本文中提供的納米線FET傳感器被用作生物傳感器。例如,在一個實施方式中,傳感納米線直接地或通過使用接頭分子衍生有多個固定化的捕獲探針。在一個實施方式中,固定化的捕獲探針是同質的,即,各個探針對相同的靶有特異性。在另一實施方式中,固定化的捕獲探針是異質的,即,至少第一種捕獲探針對第一種靶有特異性和至少第二種捕獲探針對第二種靶有特異性。在一個實施方式中,固定化的捕獲探針是特異性結合對的一部分。將可含有或不含有該固定化的捕獲探針的特異性結合配偶體(即,靶分子)的測試樣品加到該裝置上。在一個實施方式中,該樣品是電解液、血樣品或細胞裂解物。在另一實施方式中,該樣品是生理學樣品,并在加到該裝置上之前經過一些處理(例如,PCR)。如果樣品包含靶分子,其將結合到裝置上,并引發各種有關電的量的變化,例如電流、電容和電阻。在一個實施方式中,讀出nwFET的漏極電流的變化以確定是否發生結合事件。一方面,本發明提供新型nwFET傳感器結構,其具有T-型通道(T-nwFET)以引入內嵌的、晶體管樣的信號放大機制。通過設計納米線的電阻和電壓偏置,傳感納米線電流(IB)在傳感事件上的任何波動密切地放大和讀出為納米線FET漏極電流(ID)。在一個實施方式中,將多個裝置串聯在一起以獲得多級信號放大。換言之,來自第一裝置的信號被第二裝置的nwFET放大以產生放大的第二信號。如果串聯有第三裝置,來自第二裝置的第二信號被第三裝置的nwFET放大以產生放大的第三信號。因此,在一個實施方式中,本發明提供串聯連接的多個nwFET裝置。在進一步的實施方式中,所述多個裝置包括兩個、三個、四個或五個裝置。在一個實施方式中,本文中提供的裝置通過自上向下的納米加工制造。肖特基結方案充分地降低了制造的熱預算和免去了任何復雜的摻雜結(dopantjunction)加工。另一方面,提供檢測樣品中pH變化的方法。在一個實施方式中,該方法包括測量與nwFET裝置關聯的基線漏極電流(ID),所述nwFET裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中傳感納米線的第一端以約10°和170°之間的角度與納米線FET連接以形成節點。納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,且傳感納米線的第二端與基極連接。所述傳感納米線具有自由氨基。該方法進一步包括將測試樣品加到傳感納米線上,并在加入樣品后測量ID的變化,其中ID的變化與測試樣品的pH變化相關聯。仍另一方面,提供檢測樣品中分子存在或不存在的方法。在一個實施方式中,該方法包括測量與nwFET裝置關聯的基線漏極電流(ID),所述nwFET裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中傳感納米線和納米線FET各包含至少一種半導體材料,傳感納米線的第一端與納米線FET連接以形成節點。納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,且傳感納米線的第二端與基極連接。傳感納米線衍生有多個固定化的對于感興趣的靶(分析物)有特異性的捕獲探針。該方法進一步包括將測試樣品加到傳感納米線上和測量加入樣品后ID的變化,其中ID的變化與結合所述裝置的感興趣的靶(分析物)相關聯。在進一步的實施方式中,傳感納米線的第一端以約10°和約170°之間的角度與納米線FET連接以形成節點。附圖簡述圖1(左)為本發明的T-nwFET的圖。圖1(右)為多平面nwFET構造的圖。圖2是本發明使用的多種nwFET裝置構造的圖。圖3是對應于T-nwFET裝置的線路圖和沿著具有VB=4V的nwFET通道在VDS=V襯底-S=2V析取的能帶圖。圖4顯示納米線FET的暴露的、官能化的通道(左)。pH變化可通過控制通道的電導來確定(右)。圖5是在源極和漏極之間的能帶圖(沿著nwFET通道),以及在傳感柵偏置下各自的電流方向(VD>0VSG>0)。圖6是顯示用-NH2官能化的Si納米線FET的pH傳感的原理圖。在圖中向左移動對應于pH降低導致的質子化,其誘導正電荷。去質子化誘導負電荷(向右移動)。圖7是顯示用Sentarus的裝置模擬效果圖。產生了3D的T-nwFET模擬結構。沿著具有VSG=4V(左上)和VSG=-4V(右上)的nwFET通道在VDS=V襯底-S=2V析取的能帶圖。下圖顯示該裝置作為漏極電壓和基極電壓的函數的固有放大。圖8是顯示對于本發明的多線裝置(T-nwFET)和單線nwFET(I-nwFET),所產生的電流作為分析物加入和去除的函數的圖。圖9顯示制造的T-nwFET的晶片和模圖以及設計布局圖。圖10顯示100nm寬的T-nwFET的原子力顯微鏡(AFM)(下)和掃描電子顯微鏡(SEM)(上)的圖像。圖11是顯示本發明的SiT-nwFET的基本DC特征的圖。圖12,左圖顯示作為背柵電壓(即,背柵偏置)的函數的漏極電流變化的圖。圖12,右圖顯示了作為傳感柵電壓(即,傳感柵偏置)的函數的漏極電流變化的圖。圖13,左圖顯示作為傳感柵電流的函數的漏極電流的所測量的變化。圖13,右圖顯示在VD=1V,VS=0V,和VSG=3V析取的作為傳感柵電流的函數的放大率的變化。圖14顯示氮化物鈍化的用于pH和PSA傳感的nwFET的SEM圖。左:單線SinwFET傳感器。右:本發明的SiT-nwFET傳感器(多線)。圖15(左)是結合至APTES處理后的3μm寬的硅nwFET的FITC的共焦顯微鏡圖像。圖15(右)是顯示由本發明的T-nwFET實時pH傳感測量的圖。傳感柵電流和漏極電流作為時間的函數提供。圖16是顯示用本發明T-nwFET的pH傳感效果與常規制造的SinwFET相比的圖。結果顯示為漏極電流(輸出信號)作為pH的函數。改變了傳感柵和背柵偏置。圖17提供兩張圖,顯示由(上)普通的肖特基單線nwFETID和(下)肖特基T-nwFETIB在批量傳感納米線實時傳感入射的顯微鏡光期間,作為取樣時間的函數的ID(納米線FET漏極電流)和IB(傳感納米線電流)。在各裝置中的傳感納米線是10μm長和100nm寬。圖18是兩張圖,顯示在樣品處理的不同階段中相對時間的理論傳感器電流(上)和相對時間的納米線溫度。圖19是具有鄰近的電阻加熱器的集成的T-nwFET結構。圖20是顯示測量所得的作為PSA濃度的的函數漏極電流變化的圖。發明詳述一方面,本發明提供具有內嵌的信號放大機制的納米線FET裝置,其用于化學和生物醫學的傳感應用,包括床邊檢測(point-of-care,POC)診斷應用(圖1和2)。本文中提供的納米線FET傳感器包含一種或更多種半導體材料,允許對帶電荷的生物分子光學-無標記的和實時的具有特異性和靈敏度的電子檢測。高表面檢測靈敏度得自于準一維納米線固有的大表面對體積比。電荷至電流信號轉換在前端納米線FET發生,從而最小化寄生效應和噪音。該方案不額外需要成像設備,傳感器自身是易于連接的,并與讀出電子儀器集成。通過如下文提供地設計納米線的電阻和電壓偏置,在傳感事件時的傳感納米線電流(IB)的任何波動作為納米線FET漏極電流(ID)被密切地放大和讀出為納米線FET漏極電流(ID)(圖3)。因此,利用相同的大表面對體積比優勢,本文中提供的基于納米線的傳感裝置通過內嵌的放大機制提高檢測靈敏度而具有最小的噪音。在一些實施方式中,納米線FET裝置是T形的,傳感納米線垂直于納米線FET(nwFET)(圖1)。但是,這兩條線的其它構造也可改良以用于本發明(圖2)中。本文中提供的納米線FET裝置適用于多數無標記的傳感和檢測測定,如下文中進一步詳細描述。例如,在一個實施方式中,本文中提供的裝置用于檢測在懸浮液或溶液中一種或更多種靶分子的存在或不存在,例如,一種或更多種蛋白質或核酸的存在或不存在。在另一實施方式中,本文中提供的裝置用于檢測溶液中的pH變化(圖4和6)。在仍另一實施方式中,本文中提供的裝置監測一種或多種生理離子的濃度,所述生理離子例如鈉離子(Na+)、鉀離子(K+)、鈣離子(Ca2+)、鎂離子(Mg2+)、氯離子(Cl-)、磷酸氫根(HPO42-)、和碳酸氫根(HCO3-)。在該實施方式中,傳感納米線暴露于電解液,溶液中的離子變化導致傳感納米線電流(IB)的波動。該波動被放大和讀出為納米線FET漏極電流(ID)。在一個實施方式中,相對于常規的單納米線FET傳感器,本發明的裝置達到了在pH檢測靈敏度、或生理離子靈敏度上至少約10X、或至少約20X或至少約50X的提高。裝置構造和操作在一個實施方式中,本發明涉及納米制造的傳感器結構,其包含傳感納米線和納米線場效應晶體管(nwFET),并且各具有第一端和第二端。各納米線包含半導體材料,且在一個實施方式中,各線的所述半導體材料相同。因此,在該實施方式中,該裝置的多線部分是單片的(monilithic)。在一個實施方式中,所述納米線由半導體襯底制成的。在一個實施方式中,該襯底是摻雜半導體襯底。在一個實施方式中,傳感納米線用于檢測環境中的變化,例如溶液中的pH變化。在另一實施方式中,傳感納米線衍生有固定化的捕獲探針,所述的捕獲探針設計為結合測試樣品中的靶分子。結合事件引起傳感納米線電流(IB)的波動。波動被放大和作為納米線FET漏極電流(ID)讀出。在一個實施方式中,將多個裝置串聯在一起以獲得多級信號放大。換言之,來自第一裝置的信號被第二裝置的nwFET放大以產生放大的第二信號。如果串聯有第三裝置,來自第二裝置的第二信號被第三裝置的nwFET放大以產生放大的第三信號。因此,在一個實施方式中,本發明提供串聯連接的多個nwFET裝置。在進一步的實施方式中,所述多個裝置包括兩個、三個、四個或五個裝置。從一般的生物傳感器的功能性觀點,應設計生物分子受體(例如,固定化的捕獲探針、固定化的氨基)和信號轉導物(傳感納米線)之間的界面以最小化會危及檢測靈敏度的固有電干擾。如果通過長的電導線將該界面依次連接到遙控的放大器或阻抗變換器,該問題將被進一步證實。根據這些標準,在生物環境和電子裝置之間具有絕緣體界面的FET生物傳感器結構是最精致的界面,因為生物分子信號轉導發生在傳感器的前端。為了檢測低濃度的生物分子,并且具體地,為了能有單分子分辨率,需要放大納米線FET生物傳感器的輸出信號。外部放大的一個問題是所加入的寄生效應,其因而降低了該裝置的總性能。因而將放大階段放在最靠近轉導前端以加強檢測靈敏度并減小的噪音影響是高度可取的。本文中提供的裝置通過將納米線FET與傳感納米線連接達到該目標。納米線FET在其第一端與源極連接并在其第二端與漏極連接。傳感納米線的第一端與納米線FET交叉以形成節點,且傳感納米線的第二端基極(本文中也稱作“SG”或“傳感柵(傳感柵)”電極)連接。與源極關聯的電壓稱作VS,與漏極關聯的電壓稱作VD而與基極關聯的電壓稱作VB或VSG。在一個實施方式中,裝置的靈敏度是可調的。在一個實施方式中,通過修改納米線裝置的尺寸和/或結構調節靈敏度。例如,在一個實施方式中,改變一條或兩條線的長寬比,或者改變一條或兩條線的寬度或長度。本領域普通技術人員將認識到不能以制造后(post-fabrication)的方式調整納米線的尺寸。在一個實施方式中,為了提高其作為背柵nwFET通道的信號水平,傳感納米線被縮短或平行地重復。但是,這也增加了裝置覆蓋區(footprint)且可能只稍微增強信-噪比。在一個實施方式中,本發明涉及nwFET裝置,其包含各具有第一端和第二端的至少兩條、至少三條或至少四條傳感納米線,其中傳感納米線的第一端在位于納米線FET的第一端和第二端之間的單個的節點與FET納米線連接。各傳感納米線的第二端具有與其關聯的基極,所述基極具有相應的電壓VB。在一個實施方式中,各傳感納米線包含相同的固定化的捕獲探針。在另一實施方式中,傳感納米線中的至少兩條具有不同的固定化的捕獲探針,以允許檢測多種分析物。在另一實施方式中,通過納米線FET裝置上的電壓偏置獲得靈敏度的可調性。如上提供的,本文中提供的納米線裝置集成傳感納米線和納米線場效應晶體管以形成多線結構。在一個實施方式中,傳感納米線的第一端在位于納米線FET的第一端和第二端之間的節點連接到納米線FET(nwFET)。在一個實施方式中,兩條線的交叉點或節點離nwFET的第一端和第二端是大約相等的距離。但是,兩條線的交叉點(節點)可以在納米線FET的第一端和第二端之間的任何點。在一個實施方式中,nwFET從第一端到第二端的長度等于X,節點存在于約0.01X和約0.99X之間。在另一實施方式中,nwFET從第一端到第二端的長度等于X,節點存在于約0.1X和約0.9X之間。在仍另一實施方式中,nwFET從第一端到第二端的長度等于X,節點存在于約0.3X和約0.7X之間。在一個實施方式中,nwFET從第一端到第二端的長度等于X,節點存在于約0.05X、約0.1X、約0.2X、約0.3X、約0.4X、約0.5X、約0.6X、約0.7X、約0.8X、約0.9X或約0.95X。在一個實施方式中,本發明的裝置包含至少一條具有第一端和第二端的傳感納米線。該傳感納米線的第一端與納米線FET連接以形成節點,該傳感納米線的第二端與基極連接(圖1和2)。如上提供的,所述至少一條傳感納米線和納米線FET各包含至少一種半導體材料。在一個實施方式中,所述至少一條傳感納米線是直的納米線、彎曲的納米線、迂回曲折的(serpentine)納米線、或是“L”形狀的。如下文描述,這些形狀由光刻工藝(lithographicprocess)限定。在圖1和2中提供本發明的nwFET裝置的多種構造。在一個實施方式中,本發明的裝置包含至少兩條傳感納米線,這兩條傳感納米線在相同的節點與nwFET連接。在另一實施方式中,本發明的裝置包含至少兩條傳感納米線,這兩條傳感納米線在不同的節點與nwFET連接。在一個實施方式中,所述至少一條傳感納米線或所述nwFET的長度定義為各自納米線第一端和第二端之間的最短距離。在一個實施方式中,傳感納米線和/或nwFET的長度為約20nm至約30μm。在一個實施方式中,所述至少一條傳感納米線和/或所述nwFET的長度獨立地是約20nm、約30nm、約40nm、50nm、約60nm、約70nm、約80nm、約90nm、約100nm、約110nm、約120nm、約150nm和約200nm、約500nm、約1μm、約2μm、約3μm、約4μm、約5μm、約10μm、約20μm、或約30μm。在一個實施方式中,傳感納米線和/或nwFET的長度是相同的。在另一實施方式中,傳感納米線和/或nwFET的長度是不同的。在一個實施方式中,傳感納米線以約90°的角與納米線FET交叉(即,傳感納米線垂直于納米線FET),形成“T-型”構型(圖1)。雖然本文中提供的多線裝置一般指“T-型”或“T-通道”FET,該裝置不限于直角的構造。本文中使用的T-型或T-通道裝置包含任何裝置,其中傳感納米線以約10°和約170°之間的角度,例如在約30°和約150°之間的角度或在約50°和約100°之間的角度,與納米線FET交叉。在一個實施方式中,使用下列三點測量該角度:(1)FET的第一端至(2)FET-傳感納米線的節點至(3)傳感納米線的第二端。在一個實施方式中,傳感納米線以約10°、約20°、約30°、約35°、約40°、約45°、約50°、約55°、約60°、約65°、約70°、約75°、約80°、約85°或約90°與納米線FET交叉。在一個實施方式中,納米線FET的第一端和第二端以及傳感納米線的第一端和第二端存在于在同一平面(圖1,左)中。此類裝置使用本領域普通技術人員已知的自上而下的納米光刻技術制造。例如,在一個實施方式中,將負性光刻膠旋涂于半導體襯底(例如硅)上,并顯影以限定出納米線結構(即,在該實施方式中,納米線包含硅作為半導體材料)。可把摻雜襯底提供為半導體襯底。因為光刻膠作為均勻的層涂覆于半導體襯底上,各納米線具有大約相同的高度。納米線的寬度將稍微變化,取決于掩模清晰度、該光刻膠曝露于電子束(或紫外光)是否均勻和曝露于光刻膠顯影劑是否均勻。本文中提供的nwFET裝置不限于平面裝置(圖1右)。例如,可用多步方法制造nwFET裝置,從而形成多平面裝置(圖1右)。因此,在一個實施方式中,納米線FET的第一端和第二端在與傳感納米線的第二端在不同的平面。在一個實施方式中,這樣的裝置由兩個光刻和蝕刻步驟制造。在一個實施方式中,所述第一步驟用底部納米線FET的覆蓋區限定出垂直的鰭(fin)。第二步驟將垂直的鰭摹制成垂直的柱狀物以形成傳感納米線。在另一實施方式中,本文中提供的該裝置是在平面批量FET通道之上合成的垂直的半導體柱狀物(傳感納米線通道)的形式。在一個實施方式中,本發明的裝置具有多個各具有第一端和第二端的傳感納米線,和單一的具有第一端和第二端的nwFET通道。各傳感納米線具有與其第二端關聯的基極。各傳感納米線的第一端形成在nwFET通道的第一端和第二端之間的節點。此外,nwFET的第一端與源極連接且nwFET的第二端與漏極連接。因此,交叉或加號或星號形狀的裝置是在本發明的范圍之內。如上提供地,本發明的多線納米線裝置(T-nwFET)包含傳感納米線和納米線FET,各自包含半導體材料。在一個實施方式中,所述半導體材料最初以半導體襯底存在,用于制造所述裝置。在一個實施方式中,該半導體材料包含摻雜半導體材料。在一個實施方式中,各線由相同的半導體材料組成,從而形成單片的納米線結構。在一個實施方式中,納米線包含硅。但是,其它半導體材料可適用于本發明。例如,在一個實施方式中,各納米線獨立地包含組IV半導體材料,組III-V半導體材料,組II-VI半導體材料,組I-VII半導體材料,組IV-VI半導體材料,組IV-VI半導體材料,組V-VI半導體材料,組II-V半導體材料,氧化物半導體材料,金屬氧化物半導體材料,有機半導體材料,復合半導體材料,摻雜半導體材料或分層的半導體材料。傳感納米線和納米線FET可具有相同的、大約相同的、類似的、或不同的尺寸,例如,相同的、大約相同的、或不同的高度、寬度、直徑、長度和/或長寬比。借助于圖3中所示的等效電路,可以理解新型傳感器的內部放大機制。在兩條線之間的交叉點的節點電勢標記為Vn,從該節點到各電極的各納米線段表現為與納米線電阻串聯的理想肖特基二極管。傳感納米線和FET漏極電流與電極電勢(例如,VB和VD)關聯:其中A、A**、kB、фBp、q、RB、ΔRB、RD、和T分別是二極管面積、有效理查森常數、波爾茲曼常數、肖特基勢壘高度、電子電荷、傳感納米線電阻、由于傳感的RB變化、漏極納米線電阻、和絕對溫度。通過從(1)和(2)中消除Vn,可將ID與IB聯系,是必須由迭代求解的方程。因而可數字計算電流放大率(dID/dIB)。在一個實施方式中,使用相同的肖特基接觸,因而放大率由納米線電阻RB和RD與電勢VD和VB確定。換言之,可由在結構設計期間納米線幾何學和/或傳感操作期間的電壓偏置來調節所需的放大。在一個實施方式中,T-nwFET操作依賴于偏置電壓組合。另外,可達到的內部的放大也由結構、幾何學和裝置的尺寸決定。在傳感操作過程中,漏極(VD)和基極(VB)接觸相對源極接觸正偏置。由于靶生物分子的特異性結合的傳感納米線電導的調制產生了非零的ΔRB值,并因而根據方程(1)改變IB。那依次改變了電勢Vn并改變了在源極和漏極接觸之間的能帶圖(圖5)。所得的電壓差(VD-Vn)變化引起ID的指數變化,獲得檢測信號的適度放大。已進行三維半導體裝置模擬(圖7)以證實所提議的傳感裝置的預期的操作和放大機制。所析取的能帶圖(圖7)高度類似于圖5中所示的能帶圖。在一些實施方式中,需要考慮和減少電解液(例如,測試樣品)中抗衡離子對結合的靶分子電荷的電場屏蔽(screening)。這種作用一般已知為德拜-休克爾屏蔽,在具有高背景離子強度的溶液樣品如生理溶液中是普遍的。雖然在此類環境中帶電荷的生物分子的電子檢測仍可能完成,但是在大多數情況下檢測信號水平太低而不能與背景水平區分。在一個實施方式中,實施去屏蔽(de-screening)電壓偏置方法,其允許在比抗衡離子德拜屏蔽長度長得多的距離的電荷檢測。因為在溶液中的高電場下,帶電荷的生物分子和抗衡離子之間的相對速度很高使得抗衡離子不能足夠快地松弛(或應答)以形成完整的屏蔽層,所以能夠檢測。檢查該現象以解釋測量的維恩效應。類似于Possion-Nernst-Plank模擬方法,相同的去屏蔽模擬能力在本文中提供的理論分析中已實現。如圖7所示的,模擬的在離子溶液中的靜電勢圖在合適的外部偏置VB下可延展到離帶電荷的分子很遠以減少靜電屏蔽。與一般單線nwFET傳感器相比,本發明的裝置(T-nwFET傳感器)的靈敏度優勢顯現在兩方面中的至少一個。一方面,相同的平均空白信號水平(I空白)可獲得檢測的生物標志物的較大信號(I檢測)(圖8)。可選地,通過施加不同的偏置電壓可降低平均I空白而I檢測值大約相同(圖8)。由于I空白的噪音覆蓋I空白自身,因此I空白的降低將降低檢測水平和定量限度。因此在一個實施方式中,本文中提供的裝置允許檢測測試樣品中以大于或等于約1fM的濃度存在的靶分子。這使得可以檢測在有限的樣品體積中的例如來自兒童或嬰兒的樣品中的靶分子。制造裝置雖然可使用自上而下或自下而上的方法和一些折衷制造常規的SinwFETs(表1),但是自下而上的方法的一個共同缺點是低水平的輸出信號,這阻礙了它們的最終性能。在圖1中提供SiT-nwFET的一個實施方式的圖。設計并用自上而下的方法制造本文中提供的SiT-nwFET裝置。該裝置具有肖特基源極結和漏極結的無摻雜結構簡化了制造過程并降低了熱預算。如下文描述的,與單納米線nwFET相比,裝置的構造在生物傳感中,例如在pH檢測中,提供較高的靈敏度。如上文提供的,該裝置的傳感納米線和納米線FET各包含半導體材料。在一個實施方式中,在定向的絕緣體上的硅(SOI)襯底上制造T-nwFET傳感器裝置,所述襯底通過注氧工藝隔離制成。在另一實施方式中,該襯底是鍵合SOI襯底。但是,其它半導體襯底可用于制造本文中提供的裝置,用于提供包含半導體材料的納米線。在另一實施方式中,非-半導體襯底(例如,基材晶片(handlewafer))用于制造該裝置。在該實施方式中,半導體材料存在于襯底表面上使得線最終包含該材料。在一個實施方式中,組IV、III-V、II-VI、I-VII、IV-VI、IV-VI、V-VI、II-V半導體材料,氧化物,有機半導體材料,分層的半導體材料,摻雜半導體材料,或其組合,可用作裝置襯底、襯底的一部分(例如,分層的襯底或具有不同襯底的單條線)或可存在于襯底表面。襯底可以作為晶片商購,可從各晶片制造多個裝置。在一個實施方式中,半導體晶片襯底用于制造多個本發明的nwFET裝置,且所述裝置中的至少兩個被設計和制造以檢測不同的靶分子(例如,病毒抗原、酶或抗體)。例如,在一個實施方式中,所述晶片包含多個裝置,且多個裝置中的至少一個包含具有對H1N1流感病毒特異的固定化捕獲探針的傳感納米線,并且所述多個裝置中的至少一個包含具有對H5N1流感病毒特異的固定化捕獲探針的傳感納米線。在一個實施方式中,nwFET裝置襯底包括硅,氧化硅,互連金屬例如鈦、鉑、鋁、或金,或它們的組合。在進一步的實施方式中,如那些本領域普通技術人員已知的,襯底是多層襯底。期待所述襯底是結實的以允許該裝置的多用途。在一個實施方式中,初始半導體層的厚度在約5nm至約500nm的范圍。例如,該半導體層的厚度為約5nm、約10nm、約50nm、約100nm、約120nm、約140nm、約150nm、約160nm、約180nm、約200nm、約220nm、約240nm、約260nm、約280nm、約300nm、約350nm、約400nm、約450nm或約500nm。在一個實施方式中,所述襯底包含氧化物埋層。在進一步的實施方式中,所述氧化物埋層的厚度為約10nm至約500nm。在另一實施方式中,所述氧化物埋層的厚度為約10nm、約20nm、約50nm、約60nm、約70nm、約80nm、約90nm、約100nm、約120nm、約140nm、約150nm、約160nm、約180nm、約200nm、約220nm、約240nm、約260nm、約280nm、約300nm、約350nm、約400nm、約450nm或約500nm。在具體實施方式中,該半導體層具有約190nm的厚度。在進一步的實施方式中,該半導體是硅。在一個實施方式中,所述襯底包含硅層和氧化物埋層,所述氧化物埋層的厚度是約150nm。在一個實施方式中,硅是p-型。在一個實施方式中,半導體材料的電阻系數為約5Ω-cm至約200Ω-cm(包括約5Ω-cm和約200Ω-cm)。在另一實施方式中,半導體材料的電阻系數為至少約5Ω-cm、至少約10Ω-cm、至少約20Ω-cm、至少約30Ω-cm、至少約40Ω-cm、至少約50Ω-cm、至少約60Ω-cm、至少約70Ω-cm、至少約80Ω-cm、至少約90Ω-cm、至少約100Ω-cm、至少約120Ω-cm、至少約140Ω-cm、至少約160Ω-cm、至少約180Ω-cm或至少約200Ω-cm。在一個實施方式中,將所述半導體材料變薄到合適的厚度,例如,約50nm、或約75nm、或約100nm,并將光刻膠層涂覆在半導體層上面。在一個實施方式中,所述光刻膠包含氫硅倍半氧烷(HSQ)。然后將該光刻膠層通過光刻工藝限定成本發明多線結構,例如,T-型納米線結構,或其中線以不是90°的角度接合的多線結構。如上文提供的,在一個實施方式中,多條傳感納米線在納米線FET的第一端和第二端之間形成節點。在一個實施方式中用電子束光刻限定本發明的納米線。在另一實施方式中,用納米壓印(nanoimprint)光刻限定本發明的納米線。在仍另一實施方式中,用光學光刻限定本發明的納米線。在一個實施方式中,納米線的寬度在約10nm至約3000nm的范圍。線的尺寸可因電子束光刻工藝而變化。各線可具有相同的,大約相同的,或不同的尺寸(寬度、直徑、長度、長寬比)。在一個實施方式中,多線結構的線中至少一條的寬度是約10nm、約20nm、約30nm、約40nm、約50nm、約100nm、約150nm、約200nm、約250nm、約300nm、約500nm、約1μm、約2μm或約3μm。在進一步的實施方式中,多線結構(即,本發明的nwFET)的兩條線具有相同的寬度、大約相同的寬度或不同的寬度。在仍另一實施方式中,多線結構(即,本發明的nwFET)的兩條線具有相同的尺寸、大約相同的尺寸或不同的尺寸。在一個實施方式中,傳感納米線和/或nwFET的長度在約20nm至約30μm的范圍。在一個實施方式中,傳感納米線和nwFET的長度各自獨立地是約50nm、約60nm、約70nm、約80nm、約90nm、約100nm、約110nm、約120nm、約150nmand約200nm、約500nm、約1μm、約2μm、約3μm、約4μm、約5μm或約10μm、約20μm、或約30μm。在一個實施方式中,傳感納米線和FET的長度相同。在另一實施方式中,傳感納米線和FET的長度不同。在仍另一實施方式中,多線構造(即,本發明的nwFET)的兩條線具有相同的長寬比、大約相同的長寬比或不同的長寬比(寬:高)。在一個實施方式中,各線的長寬比選自約1:1、約1:1.5、約1:2、約1:3、約1:4、約2:1、約2:1.5、約2:3、約3:1、約3.5:1、約4:1。一旦限定出多線結構,就形成源極、漏極和基極。電極與納米線結構稍微重疊。用于本發明的電極是從金屬、金屬合金、金屬氧化物、混合的金屬氧化物(即,惰性金屬或碳芯上的氧化物涂層)金屬氮化物或導電聚合物制成的。在一個實施方式中,電極中的一個或更多個是由鋁、碳酸銫、鈣枝晶(calciumdendrite)、氟化鋰、鉬(VI)氧化物、鎳酸鑭、鐵酸鑭鍶鈷、亞錳酸鑭鍶、錳鈷氧化物、鎳氧化物、氧化鎳(II)、釩(III)氧化物、釩(V)氧化物、石墨、碳、鉑、錫、鈀、鎳、金、或銀、或它們的組合制成。在一個實施方式中,通過光刻膠剝離(lift-off)形成電極。在進一步的實施方式中,通過在鈦(Ti)雙層上噴涂的鉑(Pt)的光刻膠剝離形成電極。然后將沒有HSQ和金屬保護的半導體區域用活性離子蝕刻和隨后的快速熱退火(例如在450℃10分鐘)去除。在一個實施方式中,退火工序是任選的。但是,據信快速熱退火能幫助增強裝置的性能。本文中描述的裝置包含一個或更多個肖特基接觸/結(即,在金屬電極和半導體之間)或一個或更多個雜質摻雜接觸/結,或其組合。那些本領域普通技術人員已知這兩種類型的結,因此本領域普通技術人員能夠制造。例如,在一個實施方式中,通過擴散或離子注入將雜質摻雜劑加入半導體襯底中。可選地,摻雜襯底是可商購的。在一個實施方式中,使用摻雜襯底制造本發明的裝置。在進一步的實施方式中,所述襯底是摻雜硅。在甚至進一步的實施方式中,所述摻雜劑是硼、磷或鎵。在一個實施方式中,除了傳感納米線表面,將整個傳感器與周圍環境屏蔽。因此,除了傳感納米線表面,將裝置表面鈍化以保護裝置的這些部分在檢測測量期間不與測試溶液相互作用。例如,在一個實施方式中,除了傳感納米線表面,將該裝置用氮化硅層覆蓋。氮化硅鈍化表面并因此限制這些表面在檢測測量期間不與測試溶液有任何相互作用。在一個實施方式中,傳感納米線衍生有多個固定化的捕獲探針。各傳感納米線上的固定化的捕獲探針可以是同質的,即對單一靶(分子、離子)有特異性,或異質的,即對多種靶(分子、離子)有特異性。在一個實施方式中,所述多個捕獲探針的各個包含至少自由氨基、羧基或羥基。在進一步的實施方式中,將電解液(例如,生理溶液)加到裝置的傳感納米線上,pH變化導致氨基電荷的變化。電荷的變化導致傳感納米線電流(IB)的波動。波動被放大和讀出為納米線FET漏極電流(ID)。因此,漏極電流(ID)的變化與溶液pH變化關聯。在一個實施方式中,各固定化的捕獲探針與感興趣的靶分子形成特異性結合對。在一個實施方式中,傳感納米線通過一個或更多個接頭分子衍生出固定化的捕獲探針。例如,在一個實施方式中,3-氨丙基三乙氧基硅烷(APTES)分子用作接頭。在另一實施方式中,APTES分子用于檢測pH的變化(圖4、6和15)。如上文提供的,在一個實施方式中,本發明提供包含兩條互相垂直的納米線(圖1)的新型nwFET裝置。在一個實施方式中,通過添加一條垂直于nwFET通道的傳感納米線(也稱為“傳感柵”或“SG”),該裝置形成T-通道結構(圖1)。在另一實施方式中,該裝置包含多條傳感納米線,各自具有與其相連的基極(圖2)。施加的傳感柵電壓(VSG,本文中也稱為VB)改變整個通道的電勢和在中間節點的電勢,如偏置圖解中(圖5)所示。T-nwFET作為具有懸空(floating)的SG的正常nwFET傳感器來操作(圖5,上)。更偏正的VSG將傳感柵電流(ISG)分成源電流(IS)和漏極電流(ID),但其并沒有有意義地調節ID(圖5,中間)。任何SG中的電流或電壓波動因此可有效地調節源極肖特基勢壘高度和/或寬度,使得可達到最適度的放大。更偏負的VSG(圖5,下)將類似地允許在肖特基勢壘上的SG調節并實現增益,但基線電流趨于更高。機械、生物學和化學傳感測定在一個實施方式中,本發明的裝置用于傳感環境壓力。例如,在一個實施方式中,本發明的裝置檢測機械壓力。在一個實施方式中,該裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中該傳感納米線和納米線FET各自包含半導體材料,傳感納米線的第一端與納米線FET連接以形成節點。此外,納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,且傳感納米線的第二端與基極連接。在進一步的實施方式中,傳感納米線的第一端以約10°和170°之間的角度(例如在約30°和150°之間,或約50°和100°之間的角度)與納米線FET連接以形成節點。在一個實施方式中,如果該傳感納米線經受一些機械壓力,例如,如果彎曲該傳感納米線,那么傳感納米線電流(IB)從基線水平改變。該傳感納米線電流(IB)被密切地放大并讀出為納米線FET漏極電流(ID)。因此,在一個實施方式中本發明的裝置用于檢測機械壓力。在本文中提供的方法中,上文描述的nwFET裝置用于檢測一種或更多種感興趣的生物分子、檢測pH變化或離子濃度變化。在各測定中,將測試樣品加到該裝置上使其與傳感納米線接觸。本文中使用的術語“測試樣品”意指這樣的樣品,其疑似含有和/或被測試一種或更多種感興趣的生物分子、離子、分析物或化學品,即一種或更多種靶分子或靶離子。在一個實施方式中,所述靶分子是至少一種細菌抗原或至少一種寄生蟲抗原。在一個實施方式中,將流感病毒RNA作為使用本發明的nwFET裝置檢測的靶分子。在仍另一實施方式中,電解液中的陽離子是檢測的靶離子。在一個實施方式中,測試樣品源自生物來源,例如生理溶液,包括但不限于全血、血清、血漿、組織液、唾液、接目鏡液、腦脊髓液、汗、尿、乳、腹水、粘液、鼻液、痰、滑液、腹膜液、陰道液、月經、羊水、精液等等。在另一實施方式中,測試樣品是電解質懸浮液或溶液。在一個實施方式中,電解液通過將一些包含帶電荷的官能團的稱為聚電解質的生物聚合物(例如,DNA、多肽)或合成聚合物(例如聚苯乙烯磺酸酯)溶解形成。除了生理溶液,其它液體樣品也可使用,例如水、食品產品等等,例如,用于進行環境或食品生產測定。在另一實施方式中,疑似含有分析物(靶分子或離子)的氣態材料可用作測試樣品。例如,可由本發明的裝置和方法檢測一種或更多種氣體(有毒的或相反)的存在。在進一步的實施方式中,所述氣體是有毒的和/或來自環境來源。在該實施方式中,所述一種或更多種氣體是分析物(靶)。在一個實施方式中,傳感納米線電流(IB)是樣品中氣體量的函數。在一個實施方式中,當有毒氣體存在時,其吸附到傳感納米線的表面,這因而改變了傳感納米線的電流。因此,在該實施方式中,傳感納米線表面起固定化探針的作用。如上文提供的,傳感納米線電流(IB)被密切地放大并讀出為納米線FET漏極電流(ID)。因此,ID的變化與測試樣品中有毒氣體的變化關聯。用作本發明的靶的氣體包括但不限于:氨、砷、砷化氫、三溴化硼、三氯化硼、三氟化硼、溴、一氧化碳、氯、二硼烷、氯化氰、氟、甲醛、疊氮化氫、硫化氫、二氧化氮、四氧化鋨、光氣、臭氧、砷化氫或其組合。對特定氣體具有靶向選擇性的半導體氧化物材料的列表提供在下表2中。在一個實施方式中,在環境樣品中或在空氣樣品中(例如,在空氣質量控制測定中)檢測這些氣體中的一種或更多種。在另一實施方式中,所述測試樣品是環境樣品,且所述靶是樣品中存在的氣體。例如在一個實施方式中,所述靶是一氧化碳氣體。在另一實施方式中,該裝置的nwFET設計為檢測測試樣品中的放射物。在一個放射物傳感實施方式中,該裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中傳感納米線的第一端以約10°和170°之間的角度(例如在約30°和150°之間,或約50°和100°之間的角度)與納米線FET連接以形成節點。此外,納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,且傳感納米線的第二端與基極連接。當將放射樣品加到傳感納米線上時,傳感納米線的電導率改變。這導致了傳感納米線電流(IB)的變化。傳感納米線電流(IB)被密切地放大并讀出為納米線FET漏極電流(ID)。可直接使用獲得自生物或非生物來源的測試樣品。在一個實施方式中,該測試樣品進行預處理以改變樣品的特性。例如這種預處理可包括從血液制備血漿、稀釋粘性液體等等。預處理方法也可包括過濾、沉淀、稀釋、蒸餾、混合、濃縮、干擾組分滅活、加入試劑、裂解、擴增(例如PCR)等。另外,改變固體測試樣品以形成液體介質或釋放分析物可能是有利的。在一個實施方式中,通過微觀流體通道將測試樣品加到裝置上,所述微觀流體通道與該裝置的傳感納米線流體連通。在另一實施方式中,將測試樣品通過移液器手動引入或由機器人技術加入。在一個實施方式中,其中在測試樣品中檢測氣體靶,將樣品包含在通道內使得樣品不會逃逸入環境中。本文中所用的“核酸”指脫氧核糖核酸(DNA)和核糖核酸(RNA)二者。此外,術語“核酸”包括人工核酸類似物,例如肽核酸(PNA),嗎啉代-核酸,鎖核酸(LNA),以及乙二醇核酸(glycolnucleicacid)和蘇糖核酸。在一個實施方式中,PNA是DNA類似物,其中通常2-氨乙基-甘氨酸連接替換正常的磷酸二酯主鏈。甲基羰基接頭將天然及非天然的核苷酸堿基連接到該主鏈的氨基氮上。PNA是非離子(不帶電荷)、非手性分子且不易經受水解(酶解)裂解。本文中使用的術語“抗體”意指免疫球蛋白分子或其免疫學活性部分,即抗原接合部分。免疫球蛋白分子的免疫學活性部分的實例包括F(ab)和F(ab’)2片段,其可通過用酶(例如胃蛋白酶)處理抗體產生。可用于本公開中的抗體的實例包括但不限于多克隆抗體、單克隆抗體、嵌合抗體、人抗體、人源化抗體、重組抗體、單鏈Fv(“scFv”)、親和力成熟的抗體、單鏈抗體、單域抗體、F(ab)片段、F(ab’)片段、二硫鍵連接的Fv(“sdFv”)、和抗獨特型(“抗Id”)抗體以及以上任何一種的功能活性表位結合片段。本文中所用的短語“特異性結合配偶體”,是特異性結合對的成員。即兩個不同的分子,其中一個分子通過化學或物理的方法特異性地結合第二個分子。在一個實施方式中,“特異性結合配偶體”作為“固定化的捕獲探針”存在于裝置上。除了普通免疫測定的抗原和抗體特異性結合對,其它特異性結合對可包括生物素和親和素、碳水化合物和凝集素、核酸雙鏈體、效應物和受體分子、輔酶和酶、酶抑制劑和酶等。另外,特異性結合對可包括原始特異性結合成員的類似物的成員,例如分析物-類似物或在一或更多個氨基酸位置突變的酶,或突變的/改變的(即非互補的)核苷酸序列。免疫反應性的特異性結合成員包括抗原、抗原片段、抗體和抗體片段,包括單克隆的和多克隆的以及復合物,包括由重組DNA分子形成的那些)。一旦將特異性結合配偶體固定化在測試裝置上,就稱作“固定化的特異性結合配偶體”或“固定化的捕獲探針”。在一個實施方式中,通過接頭分子例如APTES固定化。在核酸實施方式中,特異性結合對可以是“完美的(perfect)”或“非完美的(non-perfect)”。完美的特異性結合對包括互相互補的兩個核苷酸序列。在一個非完美的特異性結合對實施方式中,兩個核苷酸序列在至少一個位置、或至少兩個位置、或至少三個位置、或至少四個位置、或至少五個位置是非互補的。例如,在兩個序列之間可有錯配,或在一個序列中有缺失。在一個實施方式中,核酸突變是由互變異構,脫嘌呤,脫氨作用,鏈錯配,或誘變劑(例如紫外光)引起的。在一個實施方式中,本發明通過漏極電流(ID)的差別辨別完美的和非完美的結合對。在一個實施方式中,本發明用作床邊檢測的診斷裝置。該納米電子生物傳感器包含可再生的檢測設計,可用于檢測多種分析物(例如肽核酸(PNA)、核酸、抗原、抗體、酶、激素等)。在一個實施方式中,本文中提供的裝置用于檢測特定核酸分子(例如,病毒RNA或DNA)。在一個實施方式中,用本文中提供的裝置和方法檢測來自流感、肝炎、HIV和HSV的病毒RNA。核酸特異的捕獲探針(互補的核酸)固定化在納米線FET裝置上,在傳感納米線表面,將測試樣品加到裝置上。在一個實施方式中,將生物受體捕獲探針(例如,PNA)固定化在傳感納米線表面上,測試樣品如上加入。如果靶分子(例如病毒RNA)存在于測試樣品中,將與固定化的捕獲探針形成特異性結合對。結合的分子上的電荷散發的電場然后耦合以調節/改變傳感納米線的電導。所得的漏極電流(ID)信號改變被密切放大,由內嵌的納米線晶體管帶來最小的寄生效應以達到足夠的靈敏度,并電子化讀出。用多個T-nwFET很容易實現多重檢測,其中各單獨的傳感納米線包含不同的對特定靶或疾病特異的固定化的捕獲探針。在另一實施方式中,單一裝置包含在單一的傳感納米線上的不同的捕獲探針以提供多重檢測。為了控制非特異性結合和假陽性,在一個實施方式中,進行了兩步特異性結合方法。例如,在一個實施方式中,將測試樣品加到裝置上,讓其與傳感納米線相互作用。如果測試溶液包含靶分子,靶分子將與傳感納米線上存在的固定化的捕獲探針結合,以形成特異性結合對復合物。之后,將測試溶液去除,并加入結合特異性結合對復合物的另外的結合試劑,以提供第二水平的特異性。這些方法需要另外的試劑和混合步驟,可由那些本領域普通技術人員實現。在一個實施方式中,在將靶分子加到測試裝置上之前,首先特異性擴增靶分子。例如,在一個實施方式中,在將測試樣品加到裝置上之前,對測試樣品中的核酸進行聚合酶鏈反應。在另一實施方式中,在對靶分子(例如,核酸或蛋白質分析物)定量和/或定性之前,將在各結合的靶分子上的檢測信號(例如電子電荷)放大。如果測試樣品包含一種或更多種靶分子,其將通過在傳感納米線上存在的一種或更多種固定化的捕獲探針(即,固定化的特異性結合配偶體)與裝置雜交。雜交時,裝置的電導改變。改變的電導指示發生了結合事件。改變的程度也指示發生了多少結合事件。在一個實施方式中,本發明的nwFET裝置用于檢測核酸靶分子,例如在診斷測定中檢測病毒核酸。在該實施方式中,用與一種或更多種靶核酸互補的核酸分子或與一種或更多種靶核酸互補的PNA固定化的捕獲探針共價地官能化傳感納米線表面。之后,加入可包含靶核酸例如病毒RNA靶分子(即,在圖18中的t1)的測試樣品。在一個實施方式中,在靶與其互補物結合并形成特異性結合對時,T-nwFET電流從I空白增大到I檢測。在一個實施方式中,測試樣品中的靶分子與其特異性結合配偶體不是完全互補的,并因此形成非完美的結合對。在該實施方式中,在特異性結合配偶體的核酸序列間有至少一個差別。在一個實施方式中,非完美的對包含兩個核酸分子,一個核酸序列與第二核酸序列相比具有一個缺失、錯配。在另一實施方式中,本文中提供的裝置和方法能夠檢測蛋白質的氨基酸序列中的變異。在一個實施方式中,固定化的捕獲探針結合蛋白質以及該蛋白質的變體。例如,在一個實施方式中,第一個蛋白質與第二個蛋白質相比具有氨基酸突變。在該實施方式中,取決于發生的結合事件(即,是突變體還是非突變體結合),裝置的電學性質不同。在一個核酸實施方式中,存在少數與或者一種或更多種非靶核酸分子(噪音),或者與一種或更多種靶核酸分子的非特異性結合或具有堿基對錯配的雜交(圖18(上)的實曲線)。在該實施方式中,固定化的捕獲探針(特異性結合配偶體)設計為非互補的,使得它捕獲一種或更多種包含非互補的和/或突變的序列的靶核酸分子。在一個實施方式中,兩種不同的捕獲的核酸的序列(即這兩個靶分子各具有不同的序列),通過不同核酸雙鏈體的熔解溫度(meltingtemperature)辨別(即圖18中的虛線,上)。在一個實施方式中,達到穩態溫度后,傳感納米線的溫度連續地和可控地斜線上升(圖18,下)。這接著會增大電流I檢測(或I空白,如果沒有靶結合至其互補的/特異性結合對成員)。在一個實施方式中,使用集成的靠近傳感納米線的電阻加熱器(圖19)實現熔解分析所需的高度局部加熱。在另一實施方式中,將裝置置于加熱塊上進行熔解分析。在一個實施方式中,由一種或更多種常規的集成電路的制造材料來構造電阻加熱器。例如,鈦、鉑、鎳、或硅、或其組合可用于生產該加熱器。在一個實施方式中,使用有限元模擬設計集成的電阻加熱器結構和性能。在一個實施方式中,通過測量依賴溫度的nwFET泄漏電流來相對加熱器的輸入電流校準該納米線裝置的溫度。具有一個或更多個堿基對錯配的核酸雙鏈體(例如,RNA-PNA、RNA-RNA、DNA-DNA、DNA-RNA和DNA-PNA雙鏈體)展現出比它們的完全互補的對應物的熔解溫度(Tm2)更低的熔解溫度(Tm1)。類似地,具有不同的氨基酸序列的蛋白質當結合至不同的蛋白質上時,展現出不同的熔解溫度。例如,在一個實施方式中,具有不同的氨基酸序列的抗體以不同的解離常數結合相同的抗原,并因此展現出不同的熔解溫度。在一個實施方式中,其中在熔解分析期間形成了非完美的結合對,各個T-nwFET的I檢測在回到接近I空白水平之前減少至中等水平(圖18中實曲線),其在互補的雙鏈體減少至中等水平之前(圖18中的虛線)。在Tm的I減小表示特定靶序列在它的互補物上的結合和去除(即靶分子不再存在于特異性結合對中)。這允許裝置的再生以及檢測靶分子的核苷酸序列的變異。雖然本文中提供的裝置可再生以允許多次使用,但是在一些情況下該裝置可能需要更換。例如,如果經過一段時間由于分子/顆粒的累積性污垢使I空白水平變得太靠近I檢測,或者如果在重復使用之后(例如,10-100次使用之后)傳感器、加熱器、或固定化的捕獲探針自然耗損,本發明的裝置不可再使用。在一個實施方式中,將抗衡離子屏蔽的電場,其強烈地依賴于背景離子強度和完美對非完美(例如,錯配的核酸鏈)的結合對,施加至nwFET裝置以使得靶核酸或靶蛋白從固定化的捕獲探針上去雜交,即分離特異性結合對成員。在一個實施方式中,進行整個檢測方案的再生。在一個實施方式中,為確保完全熔解,傳感納米線溫度持續升高至稍高于Tm2(即,完全補體的Tm),然后穩定(圖18,下)。在一個實施方式中,溫度穩定后,進行使用洗滌劑的再生清洗步驟以去除所有熔解的核酸和殘余的測試樣品溶液(即,在圖18中的t2)。然后將傳感納米線溫度斜線降低。例如,如果使用加熱塊,將加熱塊關閉。類似地,如果使用集成的電阻加熱器,關閉這些以斜線降低傳感納米線的溫度。溫度的降低和特異性結合對的去除使電流回到I空白水平。在該過程中,檢測傳感器電流重置到I空白(圖18,上)。最后,將T-nwFET關閉(即,在圖18中的t3)以最小化能量消耗并將裝置準備好再使用于隨后的下一檢測循環。如上文提供的,在一個實施方式中,本文中提供的多線納米線FET裝置使得形成完美的和非完美的結合對。為了區別這些類型的結合對,例如,為了區別互補的核酸與固定化的捕獲探針(即,完美的結合對)的結合以及非互補的核酸序列與相同的固定化的捕獲探針(即,非完美的結合對)的結合,在一個實施方式中,考慮一些熱力學因素。在另一實施方式中,當區別具有不同序列的兩種蛋白質和相同的固定化的捕獲探針(例如,其中一種蛋白質與另一種相比具有氨基酸突變)的結合時,考慮這些相同的因素。例如,下列因素在確定是否可進行熔解分析是有用的:A.Tm1和Tm2之間足夠的差異(圖18)。B.在熱循環中固定化的(例如,共價的固定)探針的熱穩定性。C.在t2到t3的冷卻期間沒有繼發的核酸熔解物的退火或延伸。關于因素A,有完全互補的或包含堿基對錯配的核酸雙鏈體的熱穩定性的數據。與完全互補的雙鏈體相比,具有1對堿基對錯配的雙鏈體可具有低8-10℃的Tm。此外,之前顯示雖然RNA-PNA雙鏈體具有平均比DNA-PNA雙鏈體高4℃的Tm,兩種雙鏈體類型展現出大約相同的量化的錯配的Tm變化。因此,Tm的不同可區別對相同的特異性結合配偶體的完美互補物結合和非完美的互補物結合。當處理相同的固定化的捕獲探針捕獲的不同序列的蛋白質時,也適于進行這些考慮。在一個實施方式中,當具有17個堿基對中多于15個堿基對完美配對時,結合是特異性的。這種配對足以辨別特定的病原體和宿主基因。在一個實施方式中,具有單堿基錯配的寡核苷酸和傳感納米線的結合,與具有兩對堿基錯配的寡核苷酸或作為固定化的捕獲探針完美互補物的寡核苷酸相比,nwFET漏極電流不同。在一個實施方式中,核酸雙鏈體的Tm值,使用最近鄰熱力學模型進行最初評估并隨后在實驗和裝置校準中驗證。本發明也滿足了因素B和C。特異性結合配偶體(即,固定化的捕獲探針)在傳感納米線上的共價固定化應該是穩定的,例如,當所有感興趣的特異性結合對的Tm值<100℃時,固定化的捕獲探針的解離發生在高于200℃的溫度。此外,不發生延伸,因為測試樣品中不存在該過程必需的試劑,即使傳感納米線在冷卻期間可能達到所需的延伸溫度。除了上述的理論考慮,也應考慮控制傳感納米線溫度。由于納米線周圍環境用局部加熱器(圖17)或加熱塊通過焦耳加熱來加熱,納米線溫度可在相同的樣品溶液環境中在實際的靶分子檢測之前相對加熱器的輸入電流進行預校準。需注意與需要高溫度精度的應用(例如,突變篩選和基因型分型的DNA熔解分析)相反,這里的要求較寬松(以幾℃的量級),因為完美雙鏈體和非完美的雙鏈體的Tm有足夠大的差異。在一個實施方式中,檢測方案的程序性持續時間依賴于納米線溫度斜線和特異性結合對(例如,核酸雙鏈體,或蛋白-蛋白復合體)的解離速率。前者通過加熱器的加熱速率(例如,局部集成的加熱器)和樣品溶液體積確定。后者由特異性結合對的熔解動力學決定。在一個實施方式中,包括再生清洗步驟的整個熱循環持續大約10分鐘(見圖18)。一方面,提供了檢測樣品中的pH變化的方法。在一個實施方式中,所述方法包括測量與nwFET裝置關聯的基線漏極電流(ID),所述nwFET裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中該傳感納米線的第一端以約10°和170°之間的角度(例如在約30°和150°之間,或約50°和100°之間的角度)與納米線FET連接以形成節點。納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,且傳感納米線的第二端與基極連接。所述傳感納米線衍生有自由氨基。該方法進一步包括將測試樣品加到傳感納米線上,和測量加入樣品后ID的變化,其中ID的變化與測試樣品pH的變化關聯。仍另一方面,提供檢測樣品中靶分子存在或不存在方法。在一個實施方式中,該方法包括測量與nwFET裝置關聯的基線漏極電流(ID),所述nwFET裝置包含具有第一端和第二端的傳感納米線和具有第一端和第二端的納米線FET,其中該傳感納米線的第一端以約10°和170°之間的角度(例如在約30°和150°之間,或約50°和100°之間的角度)與納米線FET連接以形成節點。納米線FET的第一端與源極連接,納米線FET的第二端與漏極連接,且傳感納米線的第二端與基極連接。所述傳感納米線衍生有多個對感興趣的靶(分析物)有特異性的固定化的捕獲探針。該方法進一步包括將測試樣品加到傳感納米線上,和測量加入樣品后ID的變化,其中ID的變化與感興趣的靶(分析物)和裝置結合相關聯。測試條在一個實施方式中,在用電池作電源的或自備能源的手提式數字式儀表(類似于葡萄糖計)中,以測試條的方式將本發明的T-nwFET集成入醫學裝置中。在一個實施方式中,將一小滴測試樣品(例如,血液)置于包含多線結構的測試條上,并比較加樣品之前和之后的電學性質以確定感興趣的分子是否存在于測試樣品中。例如,在一個實施方式中,在將樣品加到測試條上時裝置的漏極電流(ID)被改變。實施例參考下列實施例進一步闡明本發明。但是,需注意這些實施例,像上文描述的實施方式,是例證性的并不意在以任何方式限制本發明的范圍。除非另外指出,下列實施例中用的材料根據下列方法和程序制備。裝置的設計和制造在絕緣體上的硅(SOI)襯底上使用CMOS兼容工藝設計和制造SiT-nwFET(圖9)。使用具有10-20Ohm-cm的電阻系數的P-型SIMOX(通過注氧隔離)SOI晶片作為初始材料。各晶片在150nm厚的氧化物埋層(BOX)上具有190nm厚的SOI層。首先將SOI層變薄到50nm,然后用電子束光刻臺面成形(mesapatterning)T-通道。然后使用常規光刻通過Pt/Ti剝離形成源極、漏極、和SG(基)極。通過反應性離子蝕刻去除暴露的Si區域,隨后是在450℃快速熱退火10分鐘以燒結金屬-Si接觸。為對比目的(controlpurpose)制造相同寬度的肖特基單線FET傳感器。完成的100nm寬的T-nwFET的AFM(圖10,上右)和SEM圖像(圖10,下)顯示在圖10中。在測量所制造的SiT-nwFET(和共制造的單線FET)的電學特性之后,所有裝置用300nm的LPCVD氮化硅(除了在傳感納米線區域上)覆蓋以鈍化它們使得在pH傳感或分析物(靶分子)測量期間不與電解液相互作用。實施例1–SiT-nwFET裝置表征測量了nwFET通道的DC特征。該裝置包含10μm長和100nm寬的傳感納米線和納米線FET通道。結果顯示在0.2V漏極電壓的反(inverse)亞閾值斜率S~294mV/decade(圖11)。此外,柵壓-漏極電流傳輸特性變化到左邊,有增大的漏極電壓(圖11,上)。并不希望被理論束縛,據信變化是因為漏極電勢降低了肖特基勢壘,類似于MOSFET中的dram感應勢壘降低(dram-inducedbarrierlowering,DIBL)效果。因此獲得了在關閉狀態的較高的最小漏極電流。當基極(即傳感納米線)懸空時,橫跨具有不同的襯底柵電壓V襯底(插入在圖11中,下左)的源極和漏極的輸出特性類似于常規的肖特基nwFET的那些。這些數據證實制造方法的基線完整性。在不懸空的和不同的VB析取T-nwFET的傳輸特征,即ID-V襯底(圖11,下左)。當VB小時(例如,<0.5V),T-nwFET表現為正常的nwFET,且ID從漏極流進通道。當增大VB,Vn也將升高以減小電壓差(VD--Vn)。根據上文方程(2),從而ID將減小到零并最終變負。另外,證實了新型T-nwFET中所期望的電流放大。ID-IB特征首先通過從測量系統注入不同量的IB獲得,隨后取它們的導數(圖11,下右)。所得的放大率對IB的表現通過估算dID/dIB比率進行適當的模擬,如上文討論的(圖11,下右)。更重要地,如上文的數值方法所指導,可以通過電阻值調整這些放大率。大的正VSG將ID變為負(圖12,左)。如圖5中所解釋,ID的絕對值也小于在負的VSG下的絕對值(圖12,右)。通過注入來自測量系統的ISG,證實了所期望的電流放大(圖13,左)。達到了大至100的DC放大系數(ID/ISG)(圖13,右)。實施例2–與常規SinwFET比較的用SiT-nwFET的pH傳感測量如上文所述制造在這些研究中用的T-通道裝置。常規的納米線和T-通道納米線裝置的SEM圖像提供在圖14中。為了檢測氫離子濃度(或pH),傳感Si納米線表面首先用3-氨丙基三乙氧基硅烷(APTES)分子官能化以形成暴露的氨基(-NH2)(圖6)。這些基團作為進行質子化或去質子化反應的氫離子的受體。周圍pH的升高增加了納米線表面上的負電荷密度并因而改變納米線電導。在實際傳感操作中,固定VSG偏置使得在SG表面上周圍pH的變化直接改變它的電導并因而改變ISG。然后調節在中間節點的電壓。這依次導致肖特基勢壘高度和/或寬度調節,這調節了流過的載流子(carrier)。因而達到像在晶體管中的放大。這些提議的帶圖被裝置模擬所證實(圖7)。需注意為了達到高增益,傳感納米線和通道的中間節點尺寸應具有納米尺度尺寸,即,為本文中描述的裝置提供的尺寸。與常規的SinwFET對比將SiT-nwFET的傳感表現與共制造(co-fabricated)的SinwFET進行比較。圖14中提供了這兩種裝置的圖像。在T-nwFET中的傳感納米線(傳感柵)沒有用氮化硅層鈍化,而將該裝置的剩余部分鈍化。單線裝置沒有用氮化硅鈍化。將兩個裝置浸入含有2%APTES的乙醇1小時。然后在乙醇中沖洗幾次。然后將該裝置在烤箱中在100℃烘烤10分鐘。穩定的APTES表面官能化用異硫氰酸熒光素(FITC)結合來考察(圖15,左)。使用T-nwFET對改變中的周圍pH進行的樣品實時測量顯示在圖15,右。漏極電流(即,輸出信號)隨著增大的pH值而減小。無意于被理論束縛,據認為輸出信號和增大的pH值之間的關系依賴于VSG和VBG-S偏置組合。為了新型T-nwFET和共制造的nwFET之間的客觀比較,析取輸出信號并將各種VSG,VDS,和/或VBG偏置組合相對pH值作圖(圖16)。各實線將來自T-nwFET的ID數據與相同的偏置組合結合。虛線可選地合并了來自nwFET的ID值。兩種裝置都能追蹤周圍pH在6和10之間的變化。與常規的nwFET比較,在新型T-nwFET中獲得高7-49倍的靈敏度。靈敏度值從圖16中的斜率析取。據觀察從檢測靈敏度的角度VSG是比VD更敏感的參數。實施例3–T-nwFET的大量傳感性能在該研究中,相對共制造的肖特基I-nwFET(即單通道納米線)考察新型T-nwFET的批量傳感性能。該研究選擇檢測探針臺顯微鏡光,假定光強度會始終保持恒定。整個I-nwFET是非遮蔽的,而T-nwFET中只有傳感納米線是暴露的,通過用特氟隆澆鑄將源極和漏極納米線通道和肖特基接觸遮蔽。初始時將光關閉約1.5s然后打開,并在各種光照條件下將偏置電壓施加于測試中的裝置上,持續0.6s。取實時測量的ID(對I-nwFET),與IB和ID(對T-nwFET),如圖15中所示。在固定的VD和VS,有光的I-nwFET的ID水平比黑暗中高,因為入射光降低了納米線電阻。但是T-nwFET的IB和ID水平展現出相反的趨勢。這可理解為雖然RB確實隨光照減小,但是電壓差(VB–Vn)更進一步變小從而引起(VD–Vn)下降。因為所有端電壓始終固定,IB和ID根據(1)和(2)均應減小。為了公平地比較,選擇I-和T-nwFET它們各自的偏置電壓使得I-nwFET中因光照的|ΔID|(90nA)的量類似于T-nwFET中的|ΔIB|(47-75nA)。這樣做所得的增強的T-nwFET中的|ΔID|(2.3μA)可通過內部的放大(31-49)闡明,因為只有傳感納米線被光照。這些析取的電流值和對應的電壓偏置列于下表3中(案例A和C)。另外,也將兩個相關的案例列表以獲得更多的認識。在案例B中,通過升高VD和V襯底可獲得I-nwFET中較大的|ΔID|;但是與案例C相比它伴隨著明顯的ID增大(即較低的靈敏度)。當T-nwFET中的源極和漏極納米線通道和肖特基接觸也在案例D中被照亮,|ΔID/ΔIB|比相對具有相同端電壓的案例C減小。無意于被理論束縛,這可以由RD(和RS)減小來解釋,其降低所得的|ΔID|。最后,上述的放大效果可區分于肖特基勢壘修正機制(J.Zhou等(2009).Appl.Phys.Lett.,vol.94,pp.191103),因為在對照I-nwFET和新型T-nwFET二者中的傳感納米線上均制備有相同的肖特基接觸。實施例4–與常規的SinwFET相比的使用SiT-nwFET的無標記前列腺特異性抗原(PSA)檢測如上所述制造用在這些研究中的T-通道裝置。常規的納米線和T-通道納米線裝置的SEM圖像,以及該裝置的圖畫描述分別提供在圖13和圖17中。用3-氨丙基三乙氧基硅烷(APTES)分子將Si納米線表面官能化以形成氨基(-NH2)(圖6)。用APTES和戊二醛接頭分子將抗-PSA抗體固定化在傳感納米線表面上。加入PSA溶液(溶解在磷酸鹽緩沖鹽水中,PBS)后,發生特異性抗原-抗體結合并導致可測量的源極-漏極電流變化。如圖20中所畫的,T-nwFET傳感器呈現出比I-nwFET傳感器至少高7倍的靈敏度。無意于被理論束縛,據認為納米線制造的技術改進應該成正比地并可能超線性地增強T-nwFET性能。實施例5–檢測H1N1和H5N1如上所述制造用于這些研究中的單通道和多通道裝置。分別合成H1N1和H5N1的PNA(TCACTGCAAACTCATGG(SEQIDNO:1)和AGAAGGCCAATCCAGTC(SEQIDNO:2))作為捕獲探針,其在N端有醛。這兩個序列之前被用于在使用大表面檢測平臺的微觀流體裝置中區別H1N1和H5N1的結合。PNA探針通過可商購的APTES接頭分子共價地固定化在傳感納米線表面上。病毒核酸(例如RNA)上的負電荷因而可以增強它們的無標記檢測。將各PNA捕獲探針單獨地固定化在傳感納米線上以檢測病毒靶序列:H1N1:(5'-ATGTAGGACCATGAGTTTGCAGTGAGTAGAAGGICACATTCTGGATTGCC-3',SEQIDNO:3)和H5N1:(5'-GAGGTCATTGACTGGATTGGCCTTCTCCACTATGTAAGACCATTCCGGCA-3’,SEQIDNO:4)。任選地,為了確認它們成功固定化,將熒光標記的互補的核酸分子(即熒光標記的具有序列SEQIDNO:3或SEQIDNO:4的分子)加到裝置上,隨后由共聚焦顯微鏡方法來顯現結合。將這兩種非熒光標記的靶序列以不同的比例混合以確定檢測靈敏度和特異性。低離子強度的溶液用于與該測試裝置結合。然后測量該裝置的電學性質。將溶液用微流控系統或手動(由滴管或移液器)加入。然后將傳感器(單線或多線傳感器之一)置于具有良好溫度控制的實驗室電爐上以實現所設計的熱循環(圖17,下)。由于晶片塊是非常導熱的,傳感器溫度應接近于電爐表面的溫度。然后通過測量依賴溫度的I-nwFET或T-nwFET泄漏電流,相對電爐讀數校準I-nwFET或T-nwFET傳感納米線的溫度(在頂上有一小滴緩沖溶液)。之后,將H1N1和H5N1的病毒RNA靶序列,例如上面提供的序列,加到裝置上。各靶分子對其特異性結合配偶體是完全互補的。此外,將具有至少一個或兩個錯配的病毒RNA序列加入以形成非完美的結合對。在加入RNA緩沖溶液期間監測傳感器電流,隨后的溫度如圖17(上)中變化。在緩沖溶液中只存在錯配的RNA時,預期電流下降將發生在Tm1。相反,只有完全互補的RNA時類似的變化應發生在Tm2。因此將錯配的和完全互補的RNA以不同的比例混合在相同的緩沖溶液中以確定該病毒測定的靈敏度和特異性。下一步,將納米線加熱至稍微高于Tm2,隨后是用去污劑的再生清洗步驟。監測傳感器電流的任何反彈或I空白水平變化。************為所有目的,該申請全文中引用的所有文件、專利、專利申請、出版物、產品說明書和方案經由援引將其全文合并入本文中。在該說明書中舉例的和討論的實施方式只意在向本領域技術人員教導發明人已知的制備和使用本發明的最好的方法。本領域技術人員根據上述教導能理解,不背離本發明而對上述的本發明的實施方式進行修改和變化是可能的。因此需理解,除具體描述的之外,本發明可在權利要求書和它們的等同物的范圍內實施。
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 具有提高的靈敏度的納米線場效應晶體管生物傳感器的制作方法與工藝
- 一種具有三乙胺敏感效應的NiO納米片/α?Fe2O3納米立方體異質結材料的制作方法與工藝
- 一種具有立體藝術效果的背景材料的制作方法與工藝
- 一種具有三甲胺敏感效應的CoMoO4納米顆粒/MoO3納米帶異質結材料的制作方法與工藝
- 一種具有非常好耐光性的化纖材料的制作方法與工藝
- 具有調制的納米線數目的半導體器件的制作方法與工藝
- 具有多個LED以及光效應材料的可穿戴發光單元的制造方法與工藝
- 具有三維結構的FeS2納米材料、其制備方法與應用與流程
- 具有可調諧功能的平面納米振蕩器的制造方法與工藝
- 一種具有納米片層組裝的三維環狀微納結構的硫化鈷的制備方法及其應用與流程