一種載Mn分子篩的制備方法及其應用與流程
(一)技術領域
本發明涉及廢水處理技術領域,特別涉及一種載mn分子篩的制備方法及其應用。
(二)
背景技術:
含鉛廢水或者污染物排放到環境中,會逐漸增長環境對鉛離子的負荷容量,導致地球涂層和水環境中的鉛含量超標,從而通過生物富集最終進入人體中,因此有效的對含鉛廢水或者污染物進行處理具有重要的意義。
由于mcm系列的介孔分子篩的較大的比表面積,加之可以改性成為非硅系介孔材料,引入不同的雜原子會給材料帶來很多性質的改變,如穩定性的變化、親疏水性質的變化、吸附性能的變化以及催化活性的變化;因此改性得到mn-mcm-41分子篩處理廢水中鉛離子,實現廢水的資源化利用,在水體污染日益嚴重和淡水資源短缺的背景下,具有重要的環境效益和經濟效益。
(三)
技術實現要素:
本發明為了彌補現有技術的不足,提供了一種選擇性高、處理效果好的載mn分子篩的制備方法及其應用。
本發明是通過如下技術方案實現的:
一種載mn分子篩的制備方法,以模板劑十六烷基三甲基溴化銨為原料,包括如下步驟:
(1)向十六烷基三甲基溴化銨中加入蒸餾水和鹽酸溶液,攪拌至溶解成膠狀物質,向膠狀物質中緩慢滴加正硅酸乙酯并攪拌,得到透明狀膠體;
(2)將透明狀膠體置于聚四氟乙烯內襯的反應釜中,將反應釜放入烘箱中,在110℃下反應24h得到白色脆性固體,將白色脆性固體搗碎、洗滌、過濾,濾餅放入烘箱中于100℃下干燥過夜,后置于馬弗爐中焙燒,得到酸性mcm-41分子篩;
(3)向酸性mcm-41分子篩中加入二氧化錳樣品攪拌,得到的樣品導入聚四氟乙烯內襯的反應釜中,將反應釜置于烘箱中,在110℃下反應24h得到白色脆性固體,將白色脆性固體搗碎、洗滌、過濾,濾餅放入烘箱中于100℃下干燥8h,后置于馬弗爐中焙燒,得到mn-mcm-41分子篩。
本發明采用十六烷基三甲基溴化銨、正硅酸乙酯為原料,在酸性條件下制備mcm-41分子篩,并以mcm-41分子篩為載體,以溶膠凝膠法制備一種新型mn-mcm-41分子篩吸附劑,用于處理廢水中的鉛離子。
本發明的更優技術方案為:
步驟(1)中,向4.5g十六烷基三甲基溴化銨中加入15ml蒸餾水和質量濃度為36%的鹽酸溶液2.80ml,攪拌至溶解成膠狀物質,向膠狀物質中緩慢滴加10.5ml正硅酸乙酯,控制滴加速率為0.5ml/min,滴加后攪拌30min,得到透明狀膠體。
步驟(2)中,產品在馬弗爐中焙燒,先在300℃下焙燒2h,再在550℃下焙燒6h。
步驟(3)中,酸性mcm-41分子篩與二氧化錳中硅錳的摩爾比為1:1-10:1;產品在馬弗爐中焙燒,先在300℃下焙燒2h,再在550℃下焙燒6h。
本發明制得的載mn分子篩的應用,將mn-mcm-41分子篩與含鉛離子廢水充分混合,廢水中鉛離子的初始濃度為5-25μg/ml,廢水ph值為1-7,于20-40℃下吸附15-240min,得到脫除鉛離子的廢水。
本發明產品具有吸附容量大、選擇性高、處理效果好、操作簡便等特點,可有效實現廢水中鉛離子的處理,分離效率高、效果好。
(四)說明書附圖
下面結合附圖對本發明作進一步的說明。
圖1為本發明吸附劑不同用量的吸附效果示意圖;
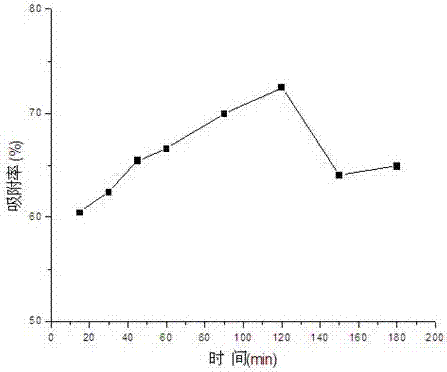
圖2為本發明吸附劑不同吸附時間的吸附效果示意圖;
圖3為本發明吸附劑不同吸附溫度的吸附效果示意圖;
圖4為本發明吸附劑不同初始濃度的吸附效果示意圖。
(五)具體實施方式
實施例1:mn-mcm-41分子篩的制備
(1)酸性環境(hcl)下mcm-41分子篩的制備
取出模版劑十六烷基三甲基溴化銨(ctab)4.5g,向其中加入蒸餾水15.00ml和質量分數為36%的鹽酸2.80ml,攪拌至溶解成膠狀物質,向混合液中緩慢滴加10.5ml的正硅酸乙酯,控制速率約為0.5ml/min,滴加后攪拌半個小時,得到透明狀膠體。
靜置15分鐘看是否分層,不分層則將得到的透明膠體倒入100ml聚四氟乙烯內襯的反應釜中,將反應釜放入烘箱中,在110℃下反應24h得到白色脆性固體。
將白色固體搗碎洗滌過濾多次,濾餅放入烘箱100℃中干燥過夜,后產品放入馬弗爐中焙燒,在300℃下焙燒2h,550℃下焙燒6h,得到產品研磨即為酸性mcm-41分子篩。
(2)mno2的制備
稱取一水硫酸錳(mnso4·h2o)固體7.015g在80℃溶于定量的蒸餾水中和高錳酸鉀(kmno4)固體4.3764g,在80℃下溶于定量蒸餾水。
在燒杯中先加入100ml蒸餾水,在磁力攪拌器上攪拌同時倒入上邊中的兩種溶液至另一燒杯,在水溫是80℃的磁力攪拌器中攪拌2h,得到黑色或者棕色懸浮液,靜置一夜后,待明顯分層用蒸餾水洗滌過濾重復多次,得到的濾餅在設置溫度為80℃的鼓風干燥箱中干燥12h,得到mno2樣品。
(3)mn-mcm-41分子篩吸附劑的制備
用制備的mno2樣品,加入到0.2g酸性環境(hcl)下制備的mcm-41分子篩中繼續攪拌1小時,至得到穩定的黑棕色樣品為止。加入的mno2樣品量固定,使得硅錳比分別為1:1:1-10:1(摩爾比)。
將得到的樣品倒入反應釜(聚四氟乙烯內襯)中,將反應釜放入烘箱中,在110℃下反應24h得到白色脆性固體。
將白色固體搗碎洗滌過濾多次,濾餅放入烘箱100℃中干燥過夜,后產品放入馬弗爐中焙燒,在300℃下焙燒2h,550℃下焙燒6h,得到產品研磨即為載錳mcm-41分子篩。
實施例2:產品載錳mcm-41分子篩的吸附性能研究
(1)不同的吸附劑用量的吸附效果
取編號為1-10的碘量瓶,向每個瓶中都加入10ml鉛吸附液,它的濃度為:10μg/ml。
用電子天平準確稱量負載硅錳比3:1的mcm-41分子篩:0.050g、0.075g、0.100g、0.125g、0.150g、0.175g、0.200g、0.250g、0.300g、0.400g。
將上述固體藥品倒入碘量瓶中,藥品量從小到大與碘量瓶對應。將碘量瓶放入恒溫搖床上動態吸附。使搖床上的溫度保持為25℃,動態吸附110min。
將吸附后的混合液倒入10ml的離心管中,將離心管標號離心。離心后的上清液用水系濾頭過濾后,測吸附率,檢測結果如附圖1所示。
由圖1的數據可以看出,隨著吸附劑用量的增加被吸附的鉛離子的吸附率也越來越大,但是從吸附劑用量0.2g開始斜率的變化出現明顯的差異,當吸附劑的用量小于0.2g時,可以從圖中看出斜率明顯大于0.2g以后的斜率,推測可能當吸附劑的用量為0.2g時為最佳的吸附用量,因為當大于0.2g時吸附效果反而增長的速率緩慢,0.2g達到最佳吸附劑利用率。
(2)吸附溫度的影響
取編號為1-5的碘量瓶,向每個瓶中都加入10ml鉛吸附液(10μg/ml)待用。
用電子天平準確稱量負載硅錳比3:1的mcm-41分子篩固體0.200g五份,待用。
將上述固體藥品倒入碘量瓶中,將五個碘量瓶分別放到20℃、25℃、30℃、35℃、40℃下恒溫震蕩120min。
將吸附后的混合液倒入10ml的離心管中,將離心管標號離心。離心后的上清液用水系濾頭過濾后,測吸附率,檢測結果如附圖2所示。
根據圖2的數據分析可得,當吸附時間增加對應的固體的吸附率也隨之增加。但當吸附時間大于120min時吸附率反而下降,此種原因在于吸附的鉛離子解吸出來。所以單就吸附時間這一因素來說,當吸附時間為120min時為最佳吸附時間。也可以理解為在120min時達到吸附解吸平衡。
(3)吸附時間的影響
取編號為1-9的碘量瓶,向每個瓶中都加入10ml鉛吸附液(10μg/ml)待用。
用電子天平準確稱量負載硅錳比3:1的mcm-41分子篩固體0.200g九份。
將上述固體藥品倒入碘量瓶中,將這九個碘量瓶放置于25℃恒溫水浴下的搖床中,保持恒定的速率震蕩吸附,在吸附了15min、30min、45min、60min、90min、120min、150min、180min、240min這幾個時間后準時取出碘量瓶。
將吸附過后的混合液倒入10ml的離心管中,將離心管標號離心。離心后的上清液用水系濾頭過濾后,測吸附率,檢測結果如附圖3所示。
根據圖3的數據分析可得,當不同的吸附溫度時,相同的吸附劑用量得到不同的吸附率。從圖中可以看出隨著吸附溫度的增加吸附量也增加,吸附率也有相應的增加。結果表明高溫有利于吸附劑吸附鉛離子,可能的原因為吸附過程是一個吸熱的過程,升溫有利于吸附過程的進行。此種正與實驗結果相符,同時也與做的熱力學數據相符。
(4)不同初始濃度的影響
取編號為1-5的碘量瓶,向每個瓶中分別加入初始濃度為5μg/ml、10μg/ml、15μg/ml、20μg/ml、25μg/ml的鉛標準使用液,待用。
用電子天平準確稱量負載硅錳比3:1的mcm-41分子篩固體0.200g五份,待用。
將稱取的藥品倒入碘量瓶中,將碘量瓶放入恒溫搖床上動態吸附。使搖床上的溫度保持為25℃。動態吸附120min。將吸附過后的混合液倒入10ml的離心管中,將離心管標號離心,離心后的上清液用水系濾頭過濾后,測吸附率,檢測結果如附圖4所示。
根據圖4中反應的數據可以看出,當鉛離子濃度為5μg/ml時吸附率達到71%,而隨著鉛離子初始濃度的增加吸附率隨著下降,其原因為:當鉛離子濃度為10μg/ml-15μg/ml,改性材料對鉛離子的吸附容量達到最大,同時吸附率保持穩定。而當鉛離子初始濃度為20μg/ml-25μg/ml時,吸附容量q不變。
- 還沒有人留言評論。精彩留言會獲得點贊!