一種制備氫氧化亞鐵沉淀的裝置及方法與流程
本發明屬于化學學科教學實踐領域,具體是涉及一種制備氫氧化亞鐵沉淀的裝置及方法。
背景技術:
高中化學教師在演示用硫酸亞鐵溶液和氫氧化鈉溶液,制備白色的氫氧化亞鐵實驗時,往往得到的是灰綠色沉淀,并非白色沉淀。對于這一現象,化學老師普遍解釋為是氫氧化亞鐵被溶液中溶解的氧氣氧化所致。
為了排除溶液中溶解氧的影響,在氫氧化鈉溶液中和硫酸亞鐵溶液中均加入vc注射液以消耗掉溶液中溶解的氧氣(除消耗溶解的氧氣外vc并不參與其他反應),用溶解氧傳感器檢測確定無氧后,將硫酸亞鐵溶液滴加到氫氧化鈉溶液中,觀察是否有灰綠色出現。將含有0.1mol/l硫酸亞鐵溶液(滴有2滴vc注射液)的滴定管,插入到氫氧化鈉溶液(滴有2滴vc注射液)液面下,緩慢滴加硫酸亞鐵溶液,產生的白色沉淀迅速變為灰綠色。因此,使用溶解氧含量均為零的氫氧化鈉溶液與硫酸亞鐵溶液反應,白色沉淀依然迅速變為灰綠色,說明沉淀顏色的變化并不是由氧氣所引起的。
另外,氫氧化亞鐵的制備實驗的改進裝置有很多,有些改進實驗可以長時間看到白色沉淀,但實驗結果并不盡如人意,現選取了比較典型的三個實驗進行分析。
①、植物油隔絕空氣的改進裝置
利用植物油隔絕試管中的氫氧化鈉空氣,硫酸亞鐵溶液插入到氫氧化鈉溶液液面下進行實驗。也有人認為將氫氧化鈉溶液滴加到硫酸亞鐵溶液中效果更好,但經過重復該實驗同樣不能長時間看到白色絮狀沉淀。
②、運用氫氧化鈉乙醇溶液與0.1mol/l硫酸亞鐵溶液反應
有作者使用氫氧化鈉乙醇溶液(飽和,下同)與0.1mol/l硫酸亞鐵溶液反應可以長時間看到白色沉淀,經過重復該實驗發現確實如此。但是,利用實驗方法驗證沉淀成分,發現該白色沉淀并不是氫氧化亞鐵沉淀,而是硫酸鈉。
驗證方法一:傳統化學實驗分析
步驟1:過濾出制得的白色沉淀,并使用乙醇清洗后。加入一定量的水,發現白色沉淀溶解,得到無色溶液;步驟2:用鉑絲對該無色溶液進行焰色反應,發現火焰顏色呈黃色,說明溶液中含有鈉離子;步驟3:往步驟1所得的無色溶液中加入過量1mol/l鹽酸溶液,再滴加幾滴0.1mol/l氯化鋇溶液,出現白色沉淀,說明溶液中含有硫酸根離子。步驟4:往氫氧化鈉乙醇溶液中,滴加0.1mol/l的硫酸溶液,也出現了白色沉淀。結論:氫氧化鈉乙醇溶液與硫酸亞鐵溶液反應,生成的白色沉淀中含有硫酸鈉。
驗證方法二:xrd檢測法
待測樣品xrd峰形峰位與標準卡片(78—2076)吻合,呈立方晶系。衍射峰從左到右分別對應于立方相的(110)、(111)、(200)、(220)、(311)及(222)晶面。除na2so4的衍射峰外,沒有發現fe(oh)2的衍射峰。結論:白色沉淀為硫酸鈉,而非氫氧化亞鐵沉淀
③、碳酸氫鈉與硫酸亞鐵反應制備
有文章認為使用碳酸氫鈉與硫酸亞鐵溶液在橡膠管中反應,可長時間看到白色氫氧化亞鐵沉淀。現選取文章中的可以看到白色沉淀的最佳濃度進行實驗即1.5mol/l碳酸氫鈉與1mol/l硫酸亞鐵。在白色橡膠管中加入10ml、1.5mol/l碳酸氫鈉溶液,使用注射器緩慢地注射約1ml、1mol/l的硫酸亞鐵溶液,可以看到溶液中有大量氣泡產生,同時可以較長時間看到白色沉淀。但是,往溶液中鼓入空氣后,白色沉淀仍不變色,由此引起了發明人對于白色沉淀的質疑,發明人認為該白色沉淀有可能是碳酸亞鐵而不是氫氧化亞鐵。
技術實現要素:
為了解決傳統制備制備強氧化亞鐵方法存在無法得到白色沉淀的缺點,本發明提供了一種制備氫氧化亞鐵沉淀的裝置及方法,可以制備出長時間存在的氫氧化亞鐵白色沉淀。
為解決本發明的技術問題,所采用的技術方案為:一種制備氫氧化亞鐵沉淀的裝置,由原料預處理及溶解氧含量檢測裝置和沉淀制備裝置組成;
原料預處理及溶解氧含量檢測裝置包括燒杯和溶解氧傳感器,燒杯內盛放制備原料,溶解氧傳感器底端伸入燒杯中,其探測的溶解氧數值通過數據采集器傳輸至處理設備中,處理設備顯示溶解氧數值;氮氣導管通過一個鐵夾安裝在鐵架臺上,氮氣導管的末端伸入燒杯中;
沉淀制備裝置包括滴管和u型管,滴管和u型管分別通過一個鐵夾安裝在鐵架臺上,滴管的底端伸入u型管的一個入口內的液面以下并用密封塞封住;u型管的另一個入口直接用密封塞封住;u型管上有兩個細的管口,分別用作氮氣鼓入口和排氣口,u型管安裝在鐵架臺上時,傾斜一定角度,確保鼓入口置于排氣口的下方;滴管和u型管內分別盛有硫酸亞鐵溶液、經過通氮氣預處理的氫氧化鈉溶液。
利用上述裝置制備氫氧化亞鐵沉淀的方法,步驟如下:
①、利用原料預處理及溶解氧含量檢測裝置降低氫氧化鈉溶液的溶解氧含量:
往盛有氫氧化鈉溶液的燒杯中持續通入高純氮氣,利用溶解氧傳感器測定溶解氧含量,并通過數據采集器傳輸至處理設備中,處理設備顯示溶解氧數值并作出溶解氧變化曲線;
②、利用沉淀制備裝置制備白色氫氧化亞鐵沉淀:
向滴管和u型管內分別裝入新制的硫酸亞鐵溶液、經過通氮氣預處理的氫氧化鈉溶液,向u型管中持續通入氮氣,然后開始滴加新制的硫酸亞鐵溶液,即可在u型管中觀察到有白色沉淀生成。
本發明相對于現有技術的有益效果是:
本發明通過實驗裝置可以證實,縱然在無氧環境下也很難長時間看到白色絮狀沉淀,同時,灰綠色沉淀的形成之“氧化理論”是不嚴謹的。另外,本發明在鼓入氮氣情況下可以長時間制得白色氫氧化亞鐵,結合亞鐵離子的顏色,有此可知灰綠色沉淀的出現,是因為生成氫氧化亞鐵凝膠吸附亞鐵離子所致(吸附過程)。
附圖說明
以下結合實施例和附圖對本發明作出進一步的詳述。
圖1是原料預處理及溶解氧含量檢測裝置的結構示意圖。
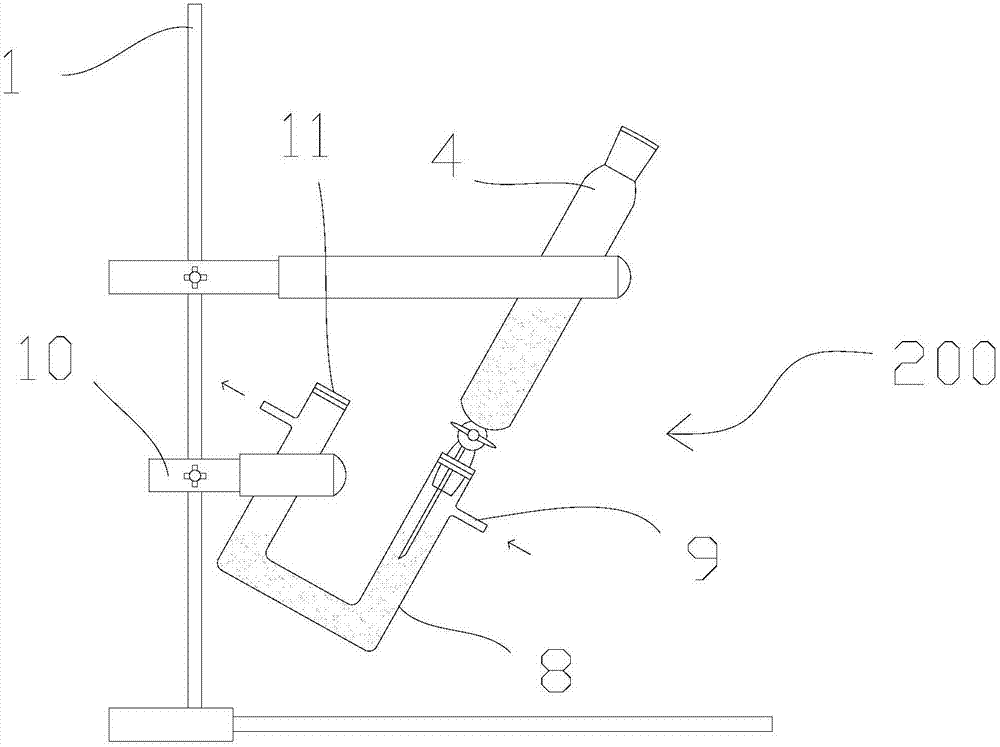
圖2是氫氧化亞鐵沉淀制備裝置的結構示意圖。
圖3是持續通入氮氣情況下0.1mol/l氫氧化鈉溶液中的溶解氧含量變化曲線。
圖4是停止通入氮氣下0.1mol/l氫氧化鈉溶液中的溶解氧含量變化曲線。
圖5是有無通入氮氣對沉淀生成的影響對比圖(左側未通入氮氣、右側通入氮氣)。
圖6是沉淀生成后后續通入氮氣對沉淀的影響對比圖(左側為向未通入氮氣制備的沉淀中后續通入氮氣、右側為通入氮氣下制得的沉淀)。
具體實施方式
本發明的目的是制備出可長時間存在的氫氧化亞鐵白色沉淀
①、實驗裝置
原料預處理及溶解氧含量檢測裝置100的結構如圖1所示,燒杯3內盛放制備原料硫酸亞鐵或氫氧化鈉,在燒杯3的外側放置一個環形支撐架2,溶解氧傳感器5底端伸入燒杯3中,上部抵靠在環形支撐架2上。溶解氧傳感器5探測的溶解氧數值通過數據采集器6(如威尼爾數據采集器)傳輸至處理設備7(如裝有威尼爾配套軟件的電腦)中,處理設備7顯示溶解氧數值。氮氣導管12通過一個鐵夾10安裝在鐵架臺1上,氮氣導管12的末端伸入燒杯3中。
沉淀制備裝置200的結構如圖2所示,滴管4和u型管8分別通過一個鐵夾10安裝在鐵架臺1上,滴管4的底端伸入u型管8的一個入口內的液面以下并用密封塞11封住;u型管8的另一個入口則直接用密封塞封住。u型管8上有兩個細的管口,分別用作氮氣鼓入口和排氣口,u型管8安裝在鐵架臺1上時,傾斜一定角度,確保鼓入口置于排氣口的下方。滴管4和u型管8內分別盛有硫酸亞鐵溶液、經過通氮氣預處理的氫氧化鈉溶液。
②、通入氮氣對氫氧化鈉溶液溶解氧含量的影響
毫無疑問,氧氣會對氫氧化亞鐵沉淀的制備造成影響,如果持續通入與氫氧化鈉溶液不反應的氣體,可以最大程度地趕走溶液中溶解的氧氣。
利用原料預處理及溶解氧含量檢測裝置測定氮氣通入時氫氧化鈉溶液中溶解氧含量變化:
往200ml、0.1mol/l氫氧化鈉溶液中通入近1小時的高純氮氣,并測定其中溶解氧含量,測出最終溶液中溶解氧含量從10.18mg/l降至0.76mg/l(具體數據如圖3所示)。
測定停止通入氮氣氫氧化鈉溶液中溶解氧含量變化,如圖4所示,從數據中可以得出,停止通入氧氣后5min內溶解氧含量變化為0.08mg/l,變化程度非常小。
③、使用溶解氧含量很低的氫氧化鈉溶液與新制硫酸亞鐵溶液反應
使用溶解氧含量為0.76mg/l的氫氧化鈉溶液與新制硫酸亞鐵溶液(溶解氧含量為0.16mg/l)進行實驗,裝置如圖2所示。
步驟1:分兩組進行,一組通入氮氣,另一組不通入氮氣(其他條件完全相同),分別向兩只u型管均加入上述氫氧化鈉溶液15ml。
步驟2:兩個滴管內均放入新制硫酸亞鐵溶液,分別向兩只u型管中滴入新制硫酸亞鐵溶液1ml。觀察實驗現象。
如圖5所示,左側u型管中先出現白色沉淀很快變為灰綠色(約3秒);右側u型管中沉淀是在通入氮氣條件下制備的,維持通氮氣狀態可以長時間看到白色沉淀,繼續通入氮氣1小時未見明顯改變。左側u型管雖不是在氮氣保護氣下進行,從圖4數據來看,溶液溶解空氣中氧氣并不快,所以兩溶液中溶解氧含量應該是相當的。
為了考察未通入氮氣制備的沉淀是否因為沉淀聚集而導致顏色變深,現向左側的u型管中通入氮氣,結果如圖6所示,左側生成沉淀再鼓入氮氣顏色明顯呈綠色,故左側灰綠色沉淀(不同氮氣制備的產物)不是聚集狀態所致。
綜上所述,本發明在氮氣環境下可以制備出白色絮狀沉淀,同時,通過實驗證實:灰綠色沉淀的出現并不是溶液中溶解的氧氣所致。可能是因為生成了氫氧化亞鐵凝膠吸附亞鐵離子所致,滴加硫酸亞鐵時氮氣鼓入可以阻礙這種聚集,故可以長時間看到白色絮狀沉淀。
以上內容僅僅是對本發明的構思所作的舉例和說明,所屬本技術領域的技術人員對所描述的具體實施例做各種各樣的修改或補充或采用類似的方式替代,只要不偏離發明的構思或者超越本權利要求書所定義的范圍,均應屬于本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!