一種光催化劑CNB?BA及其制備方法與流程
本發明涉及光催化領域,特別涉及一種光催化劑CNB-BA及其制備方法。
背景技術:
石墨相氮化碳(g-C3N4)以其光催化活性較高、穩定性好、原料價格便宜、尤其是不含金屬這一突出優點,使它成為一種新型的光催化材料,然而,單一相催化劑通常因量子效率低而使其光催化性能表現不夠理想。
因g-C3N4材料光生電子-空穴復合率較高,導致其催化效率較低,從而限制了它在光催化方面的應用,為了提高g-C3N4的催化活性,最近幾年來,人們研究了很多改性方法,對g-C3N4進行改性的非金屬元素包括S、N、C、B、F、P等,一般認為這些非金屬元素取代了3-s-三嗪結構單元中的C、N、H元素,從而形成g-C3N4晶格缺陷使得光生電子-空穴對得到有效分離,有效提高其光催化性能。
Zhang等將雙氰胺與BmimPF6(離子液體)混合,經過高溫煅燒后得到P摻雜g-C3N4催化劑,經XPS分析表明P元素取代了結構單元中C,少量P摻雜雖然不能改變g-C3N4的結構,但是,其明顯改變了g-C3N4的電子結構,光生電流也明顯高于沒摻雜g-C3N4。
Yan等采用加熱分解三聚氰胺與氧化硼的混合物制備了B摻雜g-C3N4,經過XPS光譜分析表明B取代了g-C3N4結構中的H,光催化降解染料研究表明B摻雜同時提高了催化劑對光的吸收,因此,羅丹明B光催化降解效率也得到提高。
Liu等將g-C3N4在H2S氣氛里于450℃煅燒制備了具有獨特電子結構S元素摻雜g-C3N4的CNS催化劑,XPS分析顯示S取代了g-C3N4結構中N,當λ>300及420nm時S摻雜g-C3N4光催化分解水產氫催化效率分別比單一g-C3N4提高7.2和8.0倍。
Wang等報道了B、F摻雜g-C3N4研究,他們用NH4F作為F源與DCDA制得F元素摻雜g-C3N4催化劑(CNF),其研究結果表明F元素已摻入g-C3N4的骨架中,形成了C—F鍵,使其中一部分sp2C轉化為sp3C,從而導致g-C3N4平面結構不規整;另外,隨著F元素摻雜數量增多,CNF在可見光區域內的吸收范圍也隨之擴大,而其對應的帶隙能由2.69eV降到2.63eV。
Wang等又用BH3NH3作為硼源制備B元素摻雜的g-C3N4催化劑(CNB),對其表征發現B元素摻入取代了g-C3N4結構單元中的C元素。
Lin等采用四苯硼鈉作為B源,在摻入B的同時,又因苯離去基團的作用使得g-C3N4形成薄層結構,其層的厚度為2~5nm,降低了光生電子到達催化劑表面所需要消耗的能量,因此提高光催化效率。
到目前為止,利用焙燒的方法制備了CNB與巴比妥酸(BA)不同質量比率的CNB-BA復合光催化劑的研究卻未見報道。
技術實現要素:
為了解決上述問題,本發明人進行了銳意研究,結果發現:用硼源與碳氮源進行化合反應制得的石墨相氮化碳,經過巴比妥酸改性后制得的光催化劑對甲基橙等染料具有良好的光催化降解效率,從而完成了本發明。
本發明的目的在于提供以下方面:
第一方面,本發明提供一種光催化劑CNB-BA,其特征在于,該光催化劑中,CNB與巴比妥酸的重量0.5g:(1~60)mg,優選為0.5g:(2~55)mg,如0.5g:50mg,0.5g:25mg,0.5g:15mg,0.5g:5mg,0.5g:2.5mg;
根據其XRD譜,其在2θ=13.0°、24.7°處存在衍射峰,分別對應(100)和(002)晶面;
根據其紅外光譜圖,在波數為810cm-1附近,在波數為1280cm-1以及1375cm-1附近以用在波數為1649cm-1附近存在吸收峰。
第二方面,本發明還提供一種制備上述光催化劑的方法,其特征在于,該方法包括以下步驟:
步驟1,將硼源與碳氮源混合,分散于第一分散劑中,除去第一分散劑后煅燒,制得CNB;
步驟2,將巴比妥酸與步驟1制得的CNB混合,向體系中加入第二分散劑,制成第二分散體系,升溫后保溫反應,除去第二分散劑,焙燒。
第三方面,本發明還提供上述光催化劑在催化降解染料污水方面的應用。
附圖說明
圖1示出樣品的XRD光譜圖;
圖2示出樣品的紅外光譜圖
圖3示出樣品的光致發光光譜圖;
圖4示出樣品的紫外-可見漫反射光譜圖;
圖5示出對比例1制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖6示出實施例3制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖7示出對比例2制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖8示出對比例3制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖9示出樣品在光降解30min時對甲基橙的降解率;
圖10示出樣品在光降解45min時對甲基橙的降解率;
圖11示出樣品降解甲基橙的紫外光催化活性;
圖12示出清除劑對樣品催化活性的影響。
具體實施方式
下面通過對本發明進行詳細說明,本發明的特點和優點將隨著這些說明而變得更為清楚、明確。
以下詳述本發明。
根據本發明的第一方面,提供一種光催化劑CNB-BA,其特征在于,該光催化劑中,CNB與BA的重量0.5g:(1~60)mg,優選為0.5g:(2~55)mg,如0.5g:50mg,0.5g:25mg,0.5g:15mg,0.5g:5mg,0.5g:2.5mg;
根據其XRD譜,其在2θ=13.0°、24.7°處存在衍射峰,分別對應(100)和(002)晶面;
根據其紅外光譜圖,在波數為810cm-1附近,在波數為1280cm-1以及1375cm-1附近以用在波數為1649cm-1附近存在吸收峰。
根據本發明的第二方面,還提供一種制備上述光催化劑的方法,其特征在于,該方法包括以下步驟:
步驟1,將硼源與碳氮源混合,分散于第一分散劑中,除去第一分散劑后煅燒,制得CNB。
在本發明中,所述硼源選自氧化硼、硼酸、硼酸鈉、硼酸鉀、四苯基硼酸鉀和/或四苯基硼酸鈉等,優選為四苯基硼酸鈉。
在本發明中,所述碳氮源選自碳氮比為1:3~3:1的小分子量的含氮有機物,優選選自碳氮比為1:2的小分子量含氮有機物作,如單氰胺、二氰二胺、三聚氰胺、尿素、鹽酸胍等,優選為尿素。
在本發明中,硼源與碳氮源的重量比為(1~20)mg:10g,優選為(3~15)mg:10g,如5mg:10g。
本發明人發現,將含氮有機物和含有非金屬元素的化合物置于液相體系中混合,能夠使上述兩種物質混合充分,煅燒制得的非金屬元素摻雜石墨相氮化碳形貌均一。
在本發明中,所述第一分散劑選自純凈水、去離子水和/或蒸餾水,優選為蒸餾水。
本發明人發現,除去含氮有機物和含有非金屬元素的化合物混合物所在體系中的第一分散劑能夠顯著縮短煅燒時間,因此,本發明選擇在煅燒前除去第一分散劑,本發明對除去第一分散劑的方式不做特別限定,現有技術中任何一種除去第一分散劑的方式均可使用,如常溫揮發、常壓加熱、減壓蒸餾等,本發明對除第一去分散劑時的溫度也不做特別限定,以不使含氮有機物和含有非金屬元素的化合物分解為優選,如30℃~200℃,更優選為50℃~150℃,進一步優選為60℃~120℃,如80℃。
任選地,將除去第一分散劑后的混合物進行干燥,本發明人發現,干燥后的混合物其在高溫煅燒的條件下更容易反應,能夠明顯縮短反應時間,而且得到的產物形貌良好,粒徑均一。
在本發明中,對除去第一分散劑后的體系進行煅燒制得CNB。
本發明人發現,在400℃~800℃下煅燒時能夠生成硼摻雜的石墨相氮化碳,即CNB,而且制得的產物形貌均一,本發明優選煅燒溫度為400℃~800℃,更優選為450℃~600℃,如550℃。
本發明人進一步發現,煅燒時間為1~5小時即可充分反應,因此,本發明優選選擇煅燒時間為1~5小時,優選為1.5~4小時,更優選為2~3.5小時,如2小時。
在本發明中,任選地,將煅燒后的物質進行冷卻,并進行粉碎。
步驟2,將巴比妥酸與步驟1制得的CNB混合,向體系中加入第二分散劑,制成第二分散體系,除去第二分散劑,焙燒。
本發明人發現,當使用巴比妥酸(縮寫為BA)對光催化劑進行改性后,巴比妥酸附著于產物氮化碳表面后,使制得的光催化劑在紫外可見光下的吸收波長范圍變寬,即,使光催化劑能夠吸收利用更寬范圍的紫外可見光,從而提高光催化劑對紫外光及可見光的利用率。
在本發明中,巴比妥酸與步驟1制得的CNB的重量比為(0.5~80)mg:1g,優選為(1~70)mg:1g,更優選為(5~50)mg:1g。
在本發明中,將巴比妥酸與步驟1制得的CNB混合后分散于第二分散劑中,使其在液相中混合,能夠實現最大程度的均勻程度。
在本發明中,所述第二分散劑選自純凈水、去離子水和/或蒸餾水,優選為蒸餾水。
本發明人發現,在液相體系中CNB與巴比妥酸能夠充分地進行包覆反應,尤其當液相溫度升高時,包覆速率加快,包覆均勻程度和穩定程度增加,因此,本發明選擇將第二分散體系升溫。
本發明人發現,當使用常壓加熱法除去第二分散體系中第二分散劑時,體系中的CNB與巴比妥酸即可充分地包覆,因此,本發明選擇使用常壓加熱的方法除去體系中的第二分散劑。
在本發明一種優選地實施方式中,將第二分散體系的溫度升高至100℃,保溫反應,直至除盡體系中的第二分散劑。
在本發明中,當除去第二分散劑后,將得到的固相物質進行焙燒。
在本發明中,焙燒溫度為450℃~700℃,更優選為400℃~600℃,如550℃。
本發明人發現,煅燒時間為1~5小時即可充分反應,因此,本發明優選選擇焙燒時間為1~5小時,優選這為1.5~4小時,更優選為2~3.5小時,如3小時。
在本發明一種優選地實施方式中,在焙燒前對固相物質進行粉碎,以使焙燒進行得更為充分。
光催化劑中,CNB與BA的重量0.5g:(1~60)mg,優選為0.5g:(2~55)mg,如0.5g:50mg,0.5g:25mg,0.5g:15mg,0.5g:5mg,0.5g:2.5mg;
根據其XRD譜,其在2θ=13.0°、24.7°處存在衍射峰,分別對應(100)和(002)晶面;
根據其紅外光譜圖,在波數為810cm-1附近,在波數為1280cm-1以及1375cm-1附近以用在波數為1649cm-1附近存在吸收峰。
根據本發明的第三方面,提供上述光催化劑在催化降解染料污水方面的應用,其中,所述染料是指有機染料,特別是指甲基橙等有機染料。
根據本發明提供的光催化劑CNB-BA及其制備方法,具有以下有益效果:
(1)該光催化劑在紫外光下對甲基橙等有機染料具有較高的催化降解作用,可達88%以上;
(2)該制備光催化劑的方法簡單,在制備光催化劑的過程中僅使用綠色環保的原料及試劑,不產生環境污染;
(3)該方法生產效率高,制得的光催化劑性能穩定,重復性好。
實施例
實施例1
準確稱取10.0g尿素(urea)和5.0mg四苯硼鈉,放入干燥潔凈的100ml的燒杯中加入10ml蒸餾水使其溶解,當水浴鍋內溫度加熱至80℃時將此燒杯放入水浴中,待水蒸干后將樣品研磨成粉末轉入干燥潔凈的坩堝中置于箱式電阻爐內,并于550℃溫度下焙燒2h,即可制得CNB。
準確稱量0.05g BA和0.5g CNB分別將以上6組樣品放入干燥潔凈的100mL的燒杯中加入10mL蒸餾水使其溶解,當水浴鍋內溫度加熱至100℃時將此燒杯放入水浴中,待水蒸干后將樣品研磨成粉末轉入干燥潔凈的坩堝中置于箱式電阻爐內,并于550℃溫度下焙燒2h,即可制得CNB-BA復合光催化劑,記為CNB-BA0.1。
實施例2~5
實施例2~5與實施例1相似,區別僅在于在步驟2中,BA與CNB的用量依次分別為25mgBA和0.5gCNB(實施例2)、15mgBA和0.5gCNB(實施例3)、5mgBA和0.5gCNB(實施例4)、2.5mgBA和0.5gCNB(實施例5),分別記為CNB-BA0.05、CNB-BA0.03、CNB-BA0.01、CNB-BA0.005。
對比例
對比例1 單純石墨相氮化碳
10g尿素在研缽中研磨至粉末狀,放入氧化鋁坩堝中,隨后,將坩堝在馬弗爐中加熱,升溫速率為20℃·min-1,加熱到550℃并保持2h,得到淡黃色的g-C3N4固體,研磨至粉末狀。得到g-C3N4粉末。
對比例2 單純CNB
本對比例所用樣品為實施例1步驟1中制得的CNB。
對比例3 單純BA
本對比例所用樣品為實施例1中步驟2中所用的BA。
實驗例
實驗例1 樣品的XRD光譜分析
本實驗例所用樣品為實施例1~5和對比例1~3中制得。
采用Bruker D8Advance型X射線衍射儀(XRD),銅靶(Cu Kα(λ=0.154nm))射線,Ni濾光片,工作電壓40kV,電流40mA,掃描范圍2θ=10-70°,掃描速度8deg/min分析樣品的晶相結構,結果如圖1所示,其中,
曲線a表示對比例1制得樣品的XRD譜;
曲線b表示對比例2制得樣品的XRD譜;
曲線c表示對比例3制得樣品的XRD譜;
曲線d表示實施例1制得樣品的XRD譜;
曲線e表示實施例2制得樣品的XRD譜;
曲線f表示實施例3制得樣品的XRD譜;
曲線g表示實施例4制得樣品的XRD譜;
曲線h表示實施例5制得樣品的XRD譜;
由曲線a,即g-C3N4的XRD光譜可知,最強峰在2θ=27.40°,屬于g-C3N4(002)晶面,其另一特征峰在2θ=13.00°,對應g-C3N4(100)晶面。
從圖1中可以清楚地看到實施例1~5制得的樣品對應峰,它的衍射峰2θ=13.0°、24.7°分別與(100)和(002)晶面對應,這表明CNB-BA制備的很成功。
圖1還顯示出,在光催化劑中隨著巴比妥酸(BA)含量的增加,在2θ=27.40°處峰的強度逐漸變弱及逐漸變寬,且其石墨相夾層厚度明顯減小,不受任何理論的束縛,本發明人認為其原因可能來源于巴比妥酸插入石墨相層結構中,破壞了石墨相原來的結構。
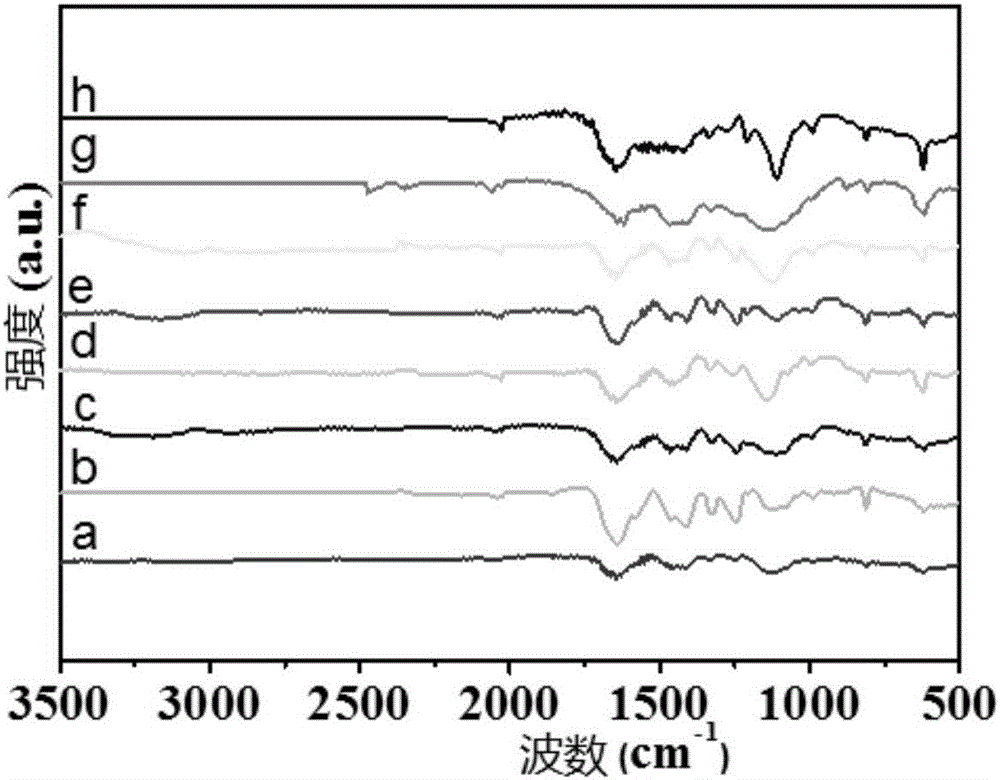
實驗例2 樣品的紅外光譜分析
紅外光譜是用來測量樣品在受到連續變化頻率的紅外光照射時,分子吸收某些頻率的輻射,并由其振動運動或彎曲運動引起偶極矩的變化,引起能級從基態到激發態的躍遷,從而形成分子吸收光譜。
本實驗例所用樣品為實施例1~5和對比例1~3中制得。
取少量上述光催化劑樣品,分別加入少量溴化鉀粉末,研磨至混合均勻,壓成薄片,用傅里葉變換紅外光譜儀對催化劑進行紅外光譜表征,結果如圖2所示,其中,
曲線a表示對比例1制得樣品的紅外光譜圖;
曲線b表示對比例2制得樣品的紅外光譜圖;
曲線c表示對比例3制得樣品的紅外光譜圖;
曲線d表示實施例1制得樣品的紅外光譜圖;
曲線e表示實施例2制得樣品的紅外光譜圖;
曲線f表示實施例3制得樣品的紅外光譜圖;
曲線g表示實施例4制得樣品的紅外光譜圖;
曲線h表示實施例5制得樣品的紅外光譜圖。
由圖2可知,在波數為810cm-1附近處的吸收峰歸屬于三嗪環骨架的彎曲振動,在波數為1280cm-1以及1375cm-1附近的吸收峰是石墨相氮化碳C-N的特征吸收峰,在波數為1649cm-1附近的吸收峰是C=N雙鍵的伸縮振動峰。
由圖2可知,在上述樣品的紅外光譜中,實施例3制得樣品的吸收峰最強,不受任何理論束縛,本發明人認為這可能與其具有相對較高的光催化活性有關。
實驗例3 樣品的光致發光光譜分析
光致發光光譜(PL)是研究半導體納米材料電子結構和光學性能的有效方法。能夠揭示半導體納米材料的表面缺陷和表面氧空位等結構特性以及光生載流子(電子-空穴對)的分離與復合等信息,從而為制備和利用性能高的半導體功能材料提供了有力依據。
本實驗例所用樣品為實施例1~5和對比例1~3中制得。
取少量上述光催化劑樣品(粉末),利用熒光光譜儀測試各種催化劑樣品的光致發光性能,激發波長435nm,掃描范圍410-700nm。實驗中,應盡可能用玻片將樣品壓得致密,以保持樣品表面的平整,且一個樣品應至少平行測試兩次,保證數據的有效性,結果如圖3所示,其中,
曲線a表示對比例1制得樣品的光致發光光譜圖;
曲線b表示對比例2制得樣品的光致發光光譜圖;
曲線c表示對比例3制得樣品的光致發光光譜圖;
曲線d表示實施例1制得樣品的光致發光光譜圖;
曲線e表示實施例2制得樣品的光致發光光譜圖;
曲線f表示實施例3制得樣品的光致發光光譜圖;
曲線g表示實施例4制得樣品的光致發光光譜圖;
曲線h表示實施例5制得樣品的光致發光光譜圖。
由圖3可知,在波長為410-700nm范圍內CNB-BA催化劑樣品(粉體)表現出強而寬的發光信號。通過熒光光譜強度可知道光生載流子復合率的高低。
從圖3中可以看出,與純CN、CNB相比,CNB-BA復合型催化劑的熒光光譜在波長440nm處的峰的強度的降低,說明復合后光生電子從氧空位到價帶的復合幾率降低。
一般認為,熒光信號越強,光生載流子(電子-空穴對)的復合幾率越高,光催化活性就相應越低,就這一點而言,CNB-BA0.1復合光催化劑具有更高的電子空穴分離效率,提高了催化劑的催化活性,由此推斷催化劑活性順序為a<b<c<d<e<f<g<h,這與其它實驗測定的光催化劑活性順序基本一致。
實驗例4 樣品的紫外-可見漫反射光譜分析
本實驗例所用樣品為實施例1~5和對比例1~3中制得。
取少量上述光催化劑樣品,利用紫外-可見漫反射光譜儀對各催化劑樣品進行表征,測試波長200-700nm,結果如圖4所示,其中,
曲線a表示對比例1制得樣品的紫外-可見漫反射光譜圖;
曲線b表示對比例2制得樣品的紫外-可見漫反射光譜圖;
曲線c表示對比例3制得樣品的紫外-可見漫反射光譜圖;
曲線d表示實施例1制得樣品的紫外-可見漫反射光譜圖;
曲線e表示實施例2制得樣品的紫外-可見漫反射光譜圖;
曲線f表示實施例3制得樣品的紫外-可見漫反射光譜圖;
曲線g表示實施例4制得樣品的紫外-可見漫反射光譜圖;
曲線h表示實施例5制得樣品的紫外-可見漫反射光譜圖。
由圖4可知,紫外-可見漫反射光譜圖在摻雜負載前后形狀幾乎相似,變化不是很明顯,并沒有產生新的圖譜現象。上述光催化劑在波長225-450nm之間均存在明顯的吸收峰,并且隨著波長的增長,吸光值呈現逐漸增大的趨勢。
從圖4中還可以看出,與對比例1~3制得的樣品相比,實施例制得的光催化劑在紫外和可見區域對光的利用率都比較高,光催化劑對光的利用率強弱順序為:a<b<c<d<e<f<g<h,這與催化劑活性基本一致。
實驗例5 樣品的降解甲基橙的UV-Vis譜隨時間變化分析
本實驗例所用樣品為實施例3和對比例1~3中制得。
準確稱取上述光催化劑粉末各0.050g,分別于4支石英管中,編號為1、2、3、4,分別加入40mL濃度為5mg·L-1甲基橙,最后分別放入一個小磁子。把石英管放入光化學反應儀中,在持續攪拌下,暗處理30min,取樣離心20min。之后打開300W汞燈光源,進行紫外光照降解打開光源,光照處理45min,取樣離心20min,測其吸光度At,計算降解率W(%)=(A0-At)/A0×100%,結果如圖5~圖8所示,其中,
圖5示出對比例1制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖6示出實施例3制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖7示出對比例2制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖;
圖8示出對比例3制得樣品降解甲基橙的UV-Vis譜隨時間的變化圖。
由圖5~圖8可知,同樣的反應條件下,在紫外光條件下降解甲基橙,復合光催化劑CNB-BA0.03比CNB、CN、BA的降解程度要大,不受任何理論束縛,本發明人認為,由于沒有新的峰出現,吸光度值得逐漸減小主要是由于光催化降解反應導致的。
實驗例6 樣品降解甲基橙的紫外光催化活性分析
本實驗例所用樣品為實施例1~5和對比例1~3中制得。
準確稱取上述光催化劑粉末各0.050g于石英管中,編號為1、2、3、4、5、6、7、8,分別加入40mL濃度為5mg·L-1甲基橙,最后分別放入一個小磁子,把石英管放入光化學反應儀中,在持續攪拌下,暗處理30min,取樣離心20min。之后打開300W汞燈光源,進行紫外光照降解打開光源,光照處理45min,取樣離心20min,測其吸光度At,計算降解率W(%)=(A0-At)/A0×100%。根據所得降解率繪制出上述光催化劑樣品的紫外光活性圖,結果如圖9和圖10所示,其中,
圖9示出樣品在光降解30min時對甲基橙的降解率;
圖10示出樣品在光降解45min時對甲基橙的降解率,
在圖9和圖10中,
a表示對比例1制得樣品對甲基橙的降解率;
b表示對比例2制得樣品對甲基橙的降解率;
c表示對比例3制得樣品對甲基橙的降解率;
d表示實施例1制得樣品對甲基橙的降解率;
e表示實施例2制得樣品對甲基橙的降解率;
f表示實施例3制得樣品對甲基橙的降解率;
g表示實施例4制得樣品對甲基橙的降解率;
h表示實施例5制得樣品對甲基橙的降解率。
由圖9和圖10可知,CNB-BA0.03催化劑光催化降解45min甲基橙降解率達到89.61%,隨著復合型催化劑中BA的成分增多,光催化活性先增加后減小,且CNB-BA0.03降解率最好。
實驗例7 樣品的降解甲基橙的紫外光催化活性分析
本實驗例所用樣品為實施例1~5和對比例1~3中制得。
準確稱取上述光催化劑粉末各0.050g于石英管中,編號為1、2、3、4、5、6、7、8,分別加入40mL濃度為5mg·L-1甲基橙,最后分別放入一個小磁子,把石英管放入光化學反應儀中,在持續攪拌下,暗處理30min,取樣離心20min。之后打開300W汞燈光源,進行紫外光照降解打開光源,光照處理45min,取樣離心20min,測其吸光度At,計算降解率W(%)=(A0-At)/A0×100%。根據所得降解率繪制出上述光催化劑樣品不同光催化時間對甲基橙的降解率圖,結果如圖11所示,其中,
曲線a表示對比例1制得樣品在不同時間對甲基橙降解率;
曲線b表示對比例2制得樣品在不同時間對甲基橙降解率;
曲線c表示對比例3制得樣品在不同時間對甲基橙降解率;
曲線d表示實施例1制得樣品在不同時間對甲基橙降解率;
曲線e表示實施例2制得樣品在不同時間對甲基橙降解率;
曲線f表示實施例3制得樣品在不同時間對甲基橙降解率;
曲線g表示實施例4制得樣品在不同時間對甲基橙降解率;
曲線h表示實施例5制得樣品在不同時間對甲基橙降解率。
由圖11可知,暗反應幾乎不降解甲基橙,且光催化反應速率明顯加快,前半個小時降解速率較快。
實驗例8 清除劑對樣品催化活性的影響
本實驗以甲基橙為模型化合物,通過引入各種自由基清除劑,研究實施例3制得光催化劑的光催化機制。
本實驗例所用樣品為實施例3制得。
準確稱取五份上述光催化劑粉末于石英管中,編號1、2、3、4、5,依次向石英管中加入40ml濃度為5.00mg·L-1的甲基橙溶液,
在1號管中不加入任何清除劑,在2號管中加入5.000μL異丙醇,在3號管中加入0.004g草酸銨,在4號管中加入0.004g對苯醌,在5號管中加入3.800μL過氧化氫酶。
并在各管中均加入一個小磁子,將石英管放入光化學反應儀中,在持續攪拌下,暗處理30min,取樣離心20min,分別測其吸光度A0。打開光源,紫外光照處理45min,取樣離心20min,測其吸光度At,計算降解率W(%)=(A0-At)/A0×100%,繪制成圖,結果如圖12所示,其中,
no scavenger表示不加入任何清除劑;
IPA表示加入異丙醇,起到抑制體系降解過程中·OH產生的作用;
AO表示加入草酸銨,起到抑制體系降解過程中h+產生的作用;
BQ表示加入對苯醌,起到抑制體系降解過程中·O2-產生的作用;
CAT表示加入過氧化氫酶,起到抑制體系降解過程中H2O2產生的作用。
由圖12可以看出,在其他條件不變的情況下,(1)與不添加清除劑相比較,加入清除劑后,催化劑的活性均有所降低;(2)加入對苯醌(BQ)和草酸銨(AO)后,催化劑的活性均有較為明顯的降低,對苯醌(BQ)的加入使得催化劑的活性降得最低。不受任何理論束縛,本發明人認為,·O2-和h+在光催化降解過程中起明顯作用,尤其是·O2-在光催化過程中起最主要作用。
以上結合具體實施方式和范例性實例對本發明進行了詳細說明,不過這些說明并不能理解為對本發明的限制。本領域技術人員理解,在不偏離本發明精神和范圍的情況下,可以對本發明技術方案及其實施方式進行多種等價替換、修飾或改進,這些均落入本發明的范圍內。本發明的保護范圍以所附權利要求為準。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 可見光響應的光催化劑Li<sub>3</sub>FeSiO<sub>5</sub>的制作方法
- 一種原位合成CuS/WO3異質結光催化劑的制備方法
- 二氧化硅納米片負載鐵氮共摻雜TiO<sub>2</sub>光催化劑的方法及用圖
- 可見光響應的光催化劑Li<sub>2</sub>CaSnO<sub>4</sub>及其制備方法
- 可見光響應的光催化劑LiBGe<sub>2</sub>O<sub>6</sub>及其制備方法
- 鈦、銅雙金屬功能化的多酸基染料降解光催化劑及制備方法
- 熔鹽法制備Bi<sub>2</sub>O<sub>3</sub>/BiTaO<sub>4</sub>復合光催化劑的方法
- 可見光響應的光催化劑LiB<sub>3</sub>Sn<sub>2</sub>O<sub>9</sub>及其制備方法
- 可見光響應的光催化劑LiBGe<sub>3</sub>O<sub>8</sub>及其制備方法
- 可見光響應的光催化劑LiInGeO<sub>4</sub>及其制備方法
- 一種AlON復合可見光催化劑及其制備方法和應用與流程
- 氮化碳光催化材料及其制備方法和應用與流程
- 一種原位制備g?C3N4?TiO2納米異質結光催化薄膜的方法與流程
- 一種銀/氯化銀復合納米立方體的制備方法與流程
- 一種BiOCl光催化劑的制備方法及制得的光催化劑和其應用與流程
- 一種BiOCl納米光催化劑的制備方法及制得的光催化劑和應用與流程
- 一種塊狀BiOCl光催化劑的制備方法及制得的光催化劑和應用與流程
- 一種CdS量子點/Bi2MoO6復合型光催化劑的制備方法與流程
- 一種納米層狀CdV2O6?CdS復合光催化劑及其制備方法和應用與流程
- 一種Cd?Nd?S/TiO2?NTs可見光催化材料的制備與應用的制造方法與工藝
- 一種鎳摻雜納米鎢酸鉍可見光催化劑及其制備和應用的制造方法與工藝
- 漂浮型可見光光催化劑及制備方法和應用與制造工藝
- 對可見光敏感的光催化劑、其制法及含其的分解池和系統的制造方法與工藝
- 一種磷酸銀-共軛聚合物可見光復合光催化劑的制作方法
- 以玻璃纖維織物為基底的二氧化鈦納米線陣列光催化劑的制作方法
- 一種有機廢氣催化氧化處理裝置的制造方法
- 實驗用光催化化學反應裝置的制造方法
- 一種尺寸可控的Bi<sub>12</sub>GeO<sub>20</sub>介晶及其合成方法
- 一種海泡石負載卟啉敏化Bi<sub>2</sub>WO<sub>6</sub>可見光催化劑的制備方法
- 以硝酸作氮源制備Fe<sub>3</sub>O<sub>4</sub>/SiO<sub>2</sub>/N?TiO<sub>2</sub>磁性可見光催化劑的方法
- 一種四角型礬酸鉍/石墨烯復合光催化劑的制備方法與制造工藝
- 硅藻土/納米TiO2光催化涂料添加劑的穩定化方法與制造工藝
- 一種具有光催化特性的核殼結構雜化溶膠及其制備與應用的制造方法與工藝
- 一種雙粒徑分布的納米二氧化鈦光催化劑及其制備方法與制造工藝
- 一種用于排氣處理的納米催化器的制造方法
- 以玻璃纖維織物為基底的二氧化鈦納米線陣列光催化劑的制作方法
- 一種制備納米催化材料的工藝裝置的制造方法
- 一種MIL?53(Fe)/g?C<sub>3</sub>N<sub>4</sub>納米片復合光催化材料的制備方法
- 高效Ag/AgCl空心八面體可見光光催化劑的制備方法
- 一種制備CdS/CoWO<sub>4</sub>異質結復合光催化劑的方法