用于鋰?空氣電池的可溶性催化劑的制作方法
本發明涉及催化劑,并且更具體地,涉及用于鋰-空氣電池的可溶性催化劑。可溶性催化劑可以包括氧化還原介體(RM),其具有在真空下約5.5~7.5eV的電離能或具有約3.0~4.0V的氧化電位并且很好地溶解在電解質中且不與電解質反應。另外,氧化還原介體(RM)具有的在初始狀態(RM)下的HOMO(最高能量占據分子軌道)水平小于過氧化鋰(Li2O2)的形成能,但最大地接近于該形成能,并且其具有的處于氧化態(RM+)的HOMO水平大于電解質的HOMO水平。
背景技術:
目前,諸如與高速增長相應的化石燃料的損耗、環境污染以及全球變暖的問題日益增加。作為對此的對策,已經開發出新的可再生能源,但還未實現顯著的結果。因而,特別是在電池領域,對能量存儲技術的興趣不斷增加。
例如,在鋰離子電池中已經實現了先進發展。然而,常規鋰離子電池由于其低能量密度而不足以替代礦物燃料。此外,近來,已經積極地開發出金屬-空氣電池,諸如鋰-空氣電池。
鋰-空氣電池沒有任何限制地使用從空氣供給的氧作為活性材料。理論上,可以從鋰-空氣電池中獲得足夠高的能量密度,例如,約3,200Wh/kg,這是常規鋰離子電池能量密度的約10倍。另外,因為氧被用作活性材料,所以鋰-空氣電池是環境友好的。
然而,常規鋰-空氣電池由于高極化而具有短壽命和過電壓的缺點。特別地,當電池放電時,可以生成過氧化鋰(Li2O2),并且過氧化鋰的離子電導率低。因此,當過氧化鋰覆蓋鋰-空氣電池的空氣電極(陰極)時,發生高的極化并且因此能量效率顯著降低。因而,在鋰-空氣電池中重要的研究課題可以是開發適當的分解過氧化鋰的催化劑。
相關技術的早期的鋰-空氣電池使用固體氧產生催化劑。因為上述催化劑是固相的,所以難以使催化劑與同樣為固相的過氧化鋰接觸。結果,因為催化劑的活性低,所以無法解決上述問題。近來,已經積極地進行了對于可溶性催化劑的研究。因為可溶性催化劑可以在電解質中自由地移動,所以可溶性催化劑可以更容易地接觸到過氧化鋰。
可溶性催化劑包括在被氧化和還原的同時分解過氧化鋰的氧化還原介體。例如,在相關技術中已經報道了作為鋰-空氣電池用可溶性催化劑的氧化還原介體的四硫富瓦烯(TTF)。另外,本發明人曾建議碘化鋰(LiI)作為另一種替代方案,其可用作氧化還原介體。因而,本發明人已經努力集中于研究開發解決鋰-空氣電池的問題的新型高級可溶性催化劑,由此完成了本發明。
在該背景技術部分中公開的以上信息僅僅是為了增強對本發明背景技術的理解,并且因此其可包括不形成對于本領域的普通技術人員而言在本國已經知道的現有技術的信息。
技術實現要素:
本發明提供可溶性催化劑,其可有效地分解在鋰-空氣電池放電時所產生的過氧化鋰。此外,本發明提供可用作鋰-空氣電池用可溶性催化劑的化合物。
本發明的目的并不限于上述目的。本發明的目的將通過以下描述更加清楚并且可通過權利要求中所述的手段及其組合來實現。
本發明可包括以下構造,以便實現上述目的。
在一個方面,本發明提供一種用于鋰-空氣電池的催化劑。特別地,本發明的催化劑在用于鋰-空氣電池中的電解質中可以是可溶性的。如本文所用的術語“可溶性催化劑”是指催化劑或催化劑組合物,其溶解在各種類型的液體或半固體電解質(例如,固態凝膠電解質)、電解質的溶液或構成電解質的溶劑中。此外,電解質可以包括相關技術中用于制造電池(例如鋰-空氣電池)的各種溶劑,例如,質子隋性溶劑(極性或非極性的非水溶劑或有機溶劑)、質子溶劑或水性溶劑或它們的混合物。在下文中,除非另外指出,否則催化劑可以被稱為可溶性催化劑。
另外,催化劑可包括氧化還原介體(RM),其可具有在真空下約5.5~7.5eV的電離能并且可以溶解在電解質中。如本文所用的術語“氧化還原介體”是指可接受或給出電子從而促進電子在基質或體系中的轉移過程的分子或化合物,例如在鋰-空氣電池中的催化劑。
根據本發明的用于鋰-空氣電池的催化劑可包括氧化還原介體,其具有大于Li2O2的平衡電位的氧化電位。
氧化還原介體的氧化電位可以為約3.0~4.0V。
電解質可以為三乙二醇二甲醚(TEGDME)或二甲基亞砜(DMSO)。
氧化還原介體可以為不與電解質反應的有機化合物。
優選地,氧化還原介體的最高占據分子軌道(HOMO)水平可以小于Li2O2的形成能。
優選地,氧化還原介體的電離能在電解質中可以為約4.5~6.0eV。
優選地,處于氧化態的氧化還原介體的HOMO水平可以大于電解質的HOMO水平。
氧化還原介體可以選自5,10-二甲基吩嗪(DMPZ)、1,5-萘二胺(NDA)、4,N,N-三甲基苯胺(TMA)和1-苯基吡咯烷(PPD)。
在另一個方面,本發明提供可包括如本文所述的催化劑的鋰-空氣電池。
還提供可包括鋰-空氣電池的車輛,所述鋰-空氣電池包括如本文所述的催化劑。
根據各種示例性實施方式,本發明可提供有效地分解在鋰-空氣電池放電時所產生的過氧化鋰以降低極化程度的催化劑。此外,可以提供可以作為催化劑即可溶性催化劑的化合物。
本發明的效果并不限于上述效果。應當理解,本發明的效果包括所有可以從下面描述中推斷出的效果。
本發明的其它方面和優選實施方式在以下進行討論。
附圖說明
現在將詳細參照附圖所示的本發明的示例性實施方式描述本發明的以上和其它特征,所述附圖在下文僅通過示例說明的方式給出,并且因此不是對本發明的限制,并且其中:
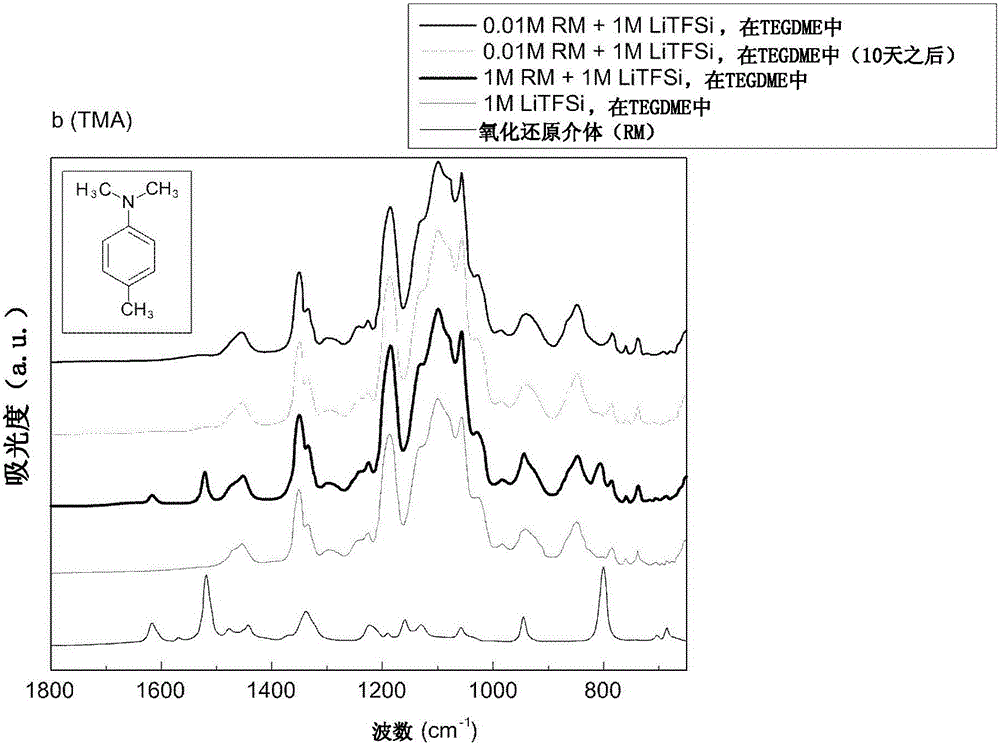
圖1A示出了用于評估當根據本發明的示例性實施方式的氧化還原介體和電解質混合時示例性氧化還原介體化合物NDA的穩定性的FT-IR(傅里葉變換紅外光譜)測量結果;
圖1B示出了用于評估當根據本發明的示例性實施方式的氧化還原介體和電解質混合時示例性氧化還原介體化合物TMA的穩定性的FT-IR(傅里葉變換紅外光譜)測量結果;
圖1C示出了用于評估當根據本發明的示例性實施方式的氧化還原介體和電解質混合時示例性氧化還原介體化合物PPD的穩定性的FT-IR(傅里葉變換紅外光譜)測量結果;
圖1D示出了用于評估當根據本發明的示例性實施方式的氧化還原介體和電解質混合時示例性氧化還原介體化合物NC的穩定性的FT-IR(傅里葉變換紅外光譜)測量結果;
圖1E示出了用于評估當根據本發明的示例性實施方式的氧化還原介體和電解質混合時示例性氧化還原介體化合物DMPZ的穩定性的FT-IR(傅里葉變換紅外光譜)測量結果;
圖2示出了應用有根據本發明的示例性實施方式的包括示例性氧化還原介體的示例性可溶性催化劑的示例性單電池的充電和放電的評估結果;
圖3示出了當使用三乙二醇二甲醚(TEGDME)作為示例性電解質時,根據本發明的示例性實施方式的示例性氧化還原介體的HOMO/LUMO水平的測量結果;
圖4示出了當使用二甲基亞砜(DMSO)作為示例性電解質時,根據本發明的示例性實施方式的示例性氧化還原介體的HOMO/LUMO水平的測量結果;
圖5示出了當使用5,10-二甲基吩嗪(DMPZ)作為示例性氧化還原介體時應用有根據本發明的示例性實施方式的包括DMPZ的示例性可溶性催化劑的示例性單電池的XRD(X-射線衍射)分析結果;且
圖6示出了根據本發明的示例性實施例的圖5的示例性單電池的示例性陰極(空氣電極)的SEM(掃描電子顯微鏡)分析圖像。
應當理解,附圖未必按比例繪制,而是呈現出說明本發明的基本原理的各種示例性特征的稍微簡化的表示。如本文所公開的本發明的特定設計特征,包括例如,特定尺寸、取向、位置和形狀將部分地通過具體的預期應用和使用環境確定。在附圖中,附圖標記在貫穿附圖的若干圖中是指本發明的相同或等同部分。
具體實施方式
下面將詳細地參照本發明的各個實施方式,其實施例圖示在附圖中,并在下文加以說明。盡管本發明將結合示例性實施方式進行描述,但應當理解,本說明書無意于將本發明局限于這些示例性實施方式。相反,本發明不僅要涵蓋這些示例性實施方式,還要涵蓋各種替換方式、變化方式、等同方式和其它實施方式,其均可以包括在所附權利要求限定的本發明的精神和范圍之內。
如果判斷公知構造或其功能的描述使本發明的要點不清楚,那么所述描述可以被省略。
本文使用的術語僅僅是為了說明具體實施方式的目的而不是意在限制本發明。如本文所使用的,單數形式“一個、一種”和“該”也意在包括復數形式,除非上下文中清楚指明。還可以理解的是,在說明書中使用的術語“包括”和/或“包含”是指存在所述特征、整數、步驟、操作、元件和/或部件,但是不排除存在或添加一個或多個其它特征、整數、步驟、操作、元件、部件和/或其群組。如本文所使用的,術語“和/或”包括一個或多個相關所列項目的任何和所有組合。
除非特別說明或從上下文明顯得到,否則本文所用的術語“約”理解為在本領域的正常容許范圍內,例如在均值的2個標準偏差內。“約”可以理解為在所述數值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%內。除非另外從上下文清楚得到,本文提供的所有數值都由術語“約”修飾。
應理解,本文使用的術語“車輛”或“車輛的”或其它類似術語包括通常的機動車,例如,包括多功能運動車(SUV)、公共汽車、卡車、各種商務車的客車,包括各種船只和船舶的水運工具,飛行器等等,并且包括混合動力車、電動車、插入式混合動力電動車、氫動力車和其它代用燃料車(例如,來源于石油以外的資源的燃料)。如本文所提到的,混合動力車是具有兩種或多種動力源的車輛,例如,具有汽油動力和電動力的車輛。
鋰-空氣電池是使用鋰作為陽極并且使用空氣的氧作為陰極(空氣電極)的活性材料的電池系統。在陽極處,發生鋰的氧化和還原反應,并在陰極處,發生從外界流入的氧的還原和氧化反應。
以下化學式1和化學式2表示在鋰-空氣電池放電時在陽極和陰極處發生的反應。
[化學式1]
(陽極):Li→Li++e-
[化學式2]
(陰極):2Li++O2+2e-→Li2O2
陽極的鋰金屬被氧化以產生鋰離子和電子。鋰離子通過電解質移動,并且電子通過外部導線或者集電器移動到陰極。由于陰極是多孔的,所以外部空氣可以流入到陰極中。外部空氣中包括的氧在陰極處被電子還原,并且形成Li2O2。
充電反應的過程與上述反應相反。換句話說,如在以下化學式3中,Li2O2在陰極處分解以產生鋰離子和電子。
[化學式3]
(陰極)Li2O2→2Li++O2+2e-
當Li2O2不適當分解時,可發生由于上述高極化現象造成的能量效率的降低問題。
在一個方面,根據本發明的用于鋰-空氣電池的可溶性催化劑(在下文中,稱為“可溶性催化劑”)可通過促進化學式3的反應而有效地分解Li2O2。因而,可以增加電池的能量效率并且可以增加其壽命。
可溶性催化劑可通過氧化還原介體(RM)促進化學式3的反應。
氧化還原介體的機理將在下面簡要描述。
[化學式4]
1.2RM→2RM++2e-
2.Li2O2+2RM+→2Li++O2+2RM
當鋰-空氣電池進行充電時,氧化還原介體可以首先被氧化。因為處于氧化態的氧化還原介體(2RM+)溶解在電解質中,所以氧化還原介體可更容易地接觸到Li2O2。然后,處于氧化態的氧化還原介體可從Li2O2帶來電子。結果,Li2O2可以高效地分解為2Li+和O2,并且處于氧化態的氧化還原介體可以被還原以返回到初始狀態。
為了順利運行上述機理,或者可選擇地,為了促進Li2O2的分解,氧化還原介體可需要化學分解Li2O2。因此,氧化還原介體的氧化電位(或氧化電壓)需要大于Li2O2的平衡電位。由于Li2O2的電化學分解的高過電位(例如,大于約1.5V),所以氧化還原介體可以在Li2O2之前被氧化。
然而,當該氧化電位與Li2O2的平衡電位之間的差值大大增加時,充電和放電效率(放電電壓/充電電壓)可能劣化,因為施加到電池的電壓增加。因此,氧化還原介體的氧化電位需要大于Li2O2的平衡電位,并且優選地,氧化還原介體的氧化電位可以在預定的范圍內接近于Li2O2的平衡電位。
特別地,因為Li2O2的平衡電位為約2.96V,所以氧化還原介體的氧化電位可以在約3.0V至4.0V的范圍內。
上述條件可以通過電離能來描述,因為當氧化還原介體被氧化時,或換句話說,當氧化還原介體失去電子時,可開始化學式4的機理。
在相關技術中,諸如四硫富瓦烯(TTF)、二茂鐵和四甲基對苯二胺(TMPD)的材料已被建議作為氧化還原介體。例如,這些化合物在真空下的電離能可以分別為6.8eV、6.7eV和6.7eV,并且當電離能為5.5eV至7.5eV時,氧化還原介體可起可溶性催化劑的作用。
因而,本發明人已經使用各種有機化合物作為氧化還原介體來制造鋰-空氣電池,所述有機化合物具有約3.0V至4.0V的氧化電位或具有在真空下約5.5eV至7.5eV的電離能。
結果,本發明可提供有效地分解在鋰-空氣電池放電時所產生的過氧化鋰以降低極化程度的可溶性催化劑。此外,可以提供可以作為可溶性催化劑的化合物。
實施例
以下實施例示例說明本發明而并非旨在限制本發明。
所選的有機化合物可包括5,10-二甲基吩嗪(在下文中,稱為DMPZ)、1,5-萘二胺(在下文中稱為NDA)、4,N,N-三甲基苯胺(在下文中稱為TMA)、1-苯基吡咯烷(在下文中簡稱為PPD)和并四苯(在下文中稱為NC),并且其物理性質在以下表1中描述。
表1
*實際計算值
鋰-空氣單電池的制造
通過在鎳網(Ni網)上施加科琴黑和聚四氟乙烯(PTFE)的混合物來制造陰極(空氣電極)。使用鋰金屬作為陽極。
通過順序地層壓鋰金屬(陽極)、隔板和陰極來制造單電池。使用1M的LiTFSI-TEGDME(在四乙二醇二甲醚中的鋰雙(三氟甲烷)磺酰胺)作為電解質。
氧化還原介體的穩定性的評估
如本文所用的包括氧化還原介體的可溶性催化劑可以溶解在電解質中以被引入到單電池中。因此,氧化還原介體可以溶解在電解質中。另外,氧化還原介體可不需要與電解質反應,因為在其中較為穩定。
因而,在將NDA、TMA、PPD、NC和DMPZ與電解質以預定濃度混合之后,通過FT-IR(傅里葉變換紅外光譜)評估穩定性。結果在圖1A-1E中示出。
如圖1A-1E中所示,當將氧化還原介體與電解質混合時,NDA(圖1A)、TMA(圖1B)、PPD(圖1C)、NC(圖1D)和DMPZ(圖1E)的峰消失,這表明所有的NDA、TMA、PPD、NC和DMPZ都溶解在電解質中。此外,在10天之后峰未顯示改變,這表明NDA、TMA、PPD、NC和DMPZ不與電解質反應而是穩定地存在。
鋰-空氣單電池的充電和放電的評估
將單電池放電至1mAh的有限電容,并且然后通過施加0.2mA/cm2的預定電流進行充電。充電電壓和放電電壓屬于2.0V至4.5V的范圍。調整單電池的內部以連續供給高純度氧。
根據充電和放電的評估的結果在圖2中示出。
其中未將包括氧化還原介體的可溶性催化劑添加到電解質中的單電池是參照。各個圖顯示出將包括NDA、TMA、PPD、NC和DMPZ的可溶性催化劑添加到電解質中的單電池的充電和放電的評價結果。
如圖2所示,在參照的情況下,強烈發生極化,并且因此觀察到約1.5V的高過充電現象。
另一方面,可以看出,在包括可溶性催化劑的單電池的情況下,上述過充電現象大大減少。如此,當對單電池進行充電時,可溶性催化劑中包括的NDA、TMA、PPD和DMPZ可促進Li2O2的分解反應。特別地,包括DMPZ的單電池最有效地減少極化現象。
然而,當單電池包括NC時,放電性能不穩定。當單電池在高純度氧的氣氛下放電并且NC對光和空氣不穩定時,可能發生副反應。因此,NC可能最不適合于用作氧化還原介體。
氧化還原介體的HOMO/LUMO水平的測量
如圖2所示,DMPZ可最有效地分解Li2O2。如上所述,Li2O2的分解反應的促進程度(例如,催化劑的活性)可以基于所使用的氧化還原介體的類型而改變。
為了鑒于電離能示出上述情形,測量在電解質中NDA、TMA、PPD、NC和DMPZ的HOMO(最高占據分子軌道)/LUMO(最低未占分子軌道)水平,并且結果在圖3和圖4中示出。
圖3示出了當使用三乙二醇二甲醚(TEGDME)作為電解質時的結果,圖4示出了當使用二甲基亞砜(DMSO)作為電解質時的結果。
圖3和圖4的Li2O2的能級表示Li2O2的形成能。Li2O2的形成能指示如化學式2所示(2Li++O2+2e-→Li2O2)的陰極處的反應的標準產生能(在標準條件下,在約25℃的溫度并且在約1atm的壓力下)。
因此,如圖3和圖4所示,所有在初始狀態(RM)下的NDA、TMA、PPD、NC和DMPZ的HOMO水平小于Li2O2的形成能。
在初始狀態(RM)下氧化還原介體的HOMO水平可以被認為是在電解質的存在下氧化還原介體的原始電離能。因而,當HOMO水平小于Li2O2的形成能時,氧化還原介體可化學分解Li2O2。由于Li2O2的電化學分解的高過電位(例如,大于約1.5V),所以氧化還原介體可以在Li2O2之前被氧化。如上所述,為了促進Li2O2的分解反應,氧化還原介體的氧化應領先并且化學分解Li2O2(參照化學式4)。
因此,為了使氧化還原介體行使其功能,在初始狀態(RM)下的HOMO水平應小于Li2O2的形成能。
然而,由于充電電壓在實際單電池中隨著HOMO水平的降低而增加,所以當HOMO水平相當低時,充電和放電效率(放電電壓/充電電壓)可能降低。因此,可以選擇電離能(在電解質中的初級電離能和在初始狀態下的HOMO水平)可以在約4.5V至6.0V,或特別是在約4.5V至5.0V的范圍內的氧化還原介體。
此外,如圖3和圖4所示,處于氧化形式(RM+)的TMA和PPD的HOMO水平小于電解質(TEGDME和DMSO)的HOMO水平。
因而,TMA和PPD的氧化形式(RM+)可從電解質而不是Li2O2帶來或吸引電子。為了分解Li2O2,RM+應該與Li2O2接觸以從Li2O2帶來電子,如化學式4所示。然而,由于處于氧化形式(RM+)的TMA和PPD的HOMO水平小于電解質的HOMO水平,所以TMA和PPD可以不從Li2O2帶來或吸引電子,而從電解質帶來電子,從而被還原然后返回到初始狀態(RM)。
因此,TMA和PPD作為氧化還原介體的效率可能不足。結果,處于氧化狀態(RM+)的氧化還原介體的HOMO水平應高于電解質的HOMO水平。
氧化還原介體的選擇和對Li2O2的實際分解的觀察
下面將描述根據本發明的各種示例性實施方式的氧化還原介體。
1)根據本發明的各種示例性實施方式的氧化還原介體可具有在真空下可以為約5.5eV至7.5eV的電離能或具有可以為約3.0V至4.0V的氧化電位。
2)根據本發明的各種示例性實施方式的氧化還原介體可以很好地溶解在電解質中而不與電解質反應。
3)根據本發明的各種示例性實施方式的氧化還原介體在初始狀態(RM)下的HOMO水平可以小于Li2O2的形成能,但最大地接近于形成能。
4)根據本發明的各種示例性實施方式的氧化還原介體在初始狀態(RM+)下的HOMO水平可以大于電解質的HOMO水平。
如以上所討論,在NDA、TMA、PPD、NC和DMPZ中,可較少地使用NC作為氧化還原介體,因為NC對光和氧較不穩定并且在放電期間可能發生副反應。另外,如上所述,由于TMA和PPD在氧化狀態(RM+)下的HOMO水平低于電解質的HOMO水平,所以催化劑的效率可能不足。如圖3和圖4所示,由于NDA在初始狀態(RM)下的HOMO水平較低,所以存在如下擔心,即增加單電池的充電電壓,這可導致充電和放電效率的降低。
結果,包括DMPZ作為氧化還原介體的可溶性催化劑可以是最高效的,因為包括DMPZ的可溶性催化劑在電解質中較為穩定,不發生副反應,極化和過電壓現象可以在很大程度上降低,并且充電和放電效率是足夠的。
因此,在制造應用有包括DMPZ作為氧化還原介體的可溶性催化劑的單電池之后,進行X-射線衍射(XRD)分析和掃描電子顯微鏡(SEM)分析。結果在圖5和圖6中示出。如圖5所示,當單電池充電和放電時,Li2O2分解并形成。
比較在首先制備單電池時的圖(如所制備的)和在單電池放電之后的圖(放電),可以確認,在放電期間Li2O2的峰出現并且形成Li2O2。
比較在單電池放電之后的圖(放電)和在單電池被再充電時的圖(再充電),可以確認,在充電期間Li2O2的峰消失并且Li2O2完全分解。
如圖6所示,可以更清楚地確認Li2O2的分解和形成。可以看出,在鋰-空氣電池放電時,在陰極(空氣電極)的表面(A)上形成環形Li2O2。此外,當單電池完全放電并且然后再充電時(B),Li2O2完全分解并且因此沒有再發現Li2O2。
如上所述,本發明提供了用作新型可溶性催化劑的化合物。特別地,本發明的可溶性催化劑可以有效地分解在鋰-空氣電池放電時所產生的Li2O2,由此降低極化并且增加充放電效率和壽命。另外,本發明通過發現和建議用于用作鋰-空氣電池的可溶性催化劑的條件而有助于后續研究。
本發明已經參照其各種示例性實施方式進行了詳細描述。然而,本領域的技術人員應該理解,在不脫離本發明原理和精神的前提下,可以對這些示例性實施方式進行修改,本發明的范圍在所附權利要求及其等同物中限定。
- 還沒有人留言評論。精彩留言會獲得點贊!