一種用于蛋白標記及檢測的熒光探針及其合成方法與應用與流程
本發明涉及一種用于蛋白標記的新型熒光探針的合成方法及應用。
背景技術:
隨著分子生物學,分析化學以及有機化學的逐步發展,研究工作者對蛋白功能及結構的研究,含量的檢測,實時的追蹤的需求極為迫切。因而,有機小分子熒光探針作為一種重要的蛋白標記手段逐漸被廣泛應用于蛋白的監測。近年來,有機小分子熒光探針對蛋白的標記主要通過共價鍵(雙砷-四半胱氨酸體系、SNAP-tag、Halo-tag等),非共價鍵(氫鍵,金屬配位等)以及基因工程(非天然氨基酸等)等對目標蛋白進行修飾而達到熒光標記的效果。
SNAP-tag蛋白是對由207個氨基酸組成的DNA修復蛋白酶(O6-鳥嘌呤-DNA烷基轉移酶,hAGT)進行突變改造而獲得的。其中作為反應位點的半胱氨酸能夠與O6修飾的苯甲基鳥嘌呤進行親核反應。脫去鳥嘌呤后,半胱氨酸能夠與芐基形成穩定的硫醚鍵,從而以共價鍵形式達到與熒光底物高特異性的結合。因此,通過有機合成手段可以將多種多樣的有機小分子熒光探針引入芐基端,從而達到熒光探針與SNAP-tag蛋白的特異性結合。
有機小分子熒光探針作為蛋白的標記和檢測手段的實例以屢見不鮮,但是在諸多熒光探針中其主要表現為與蛋白結合后出現熒光增強并伴有熒光的藍移,這種探針容易受到設備、樣品等外界因素影響。比率型的熒光探針能很好地克服這類缺點,但是成功用于蛋白標記與檢測的卻較為少見。
技術實現要素:
本發明的目的之一是提供一類用于蛋白標記的熒光探針的生物應用,該探針能夠與SNAP-tag蛋白特異性結合并呈現出長波~550nm處的熒光增強。
本發明的另一目的是提供一類用于蛋白標記的熒光探針的合成方法,該方法具有操作方便、原料廉價、提純簡單等優點。
本發明提供一種用于熒光標記的熒光探針,以4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酰亞胺為熒光基團,芐氧基為結合位點,熒光探針能夠特異性與SNAP蛋白結合并呈現~8倍熒光增強,其在~550nm處熒光強度比例明顯增加。
該熒光探針具有如下結構:
其中R為R1:或R2:中的一種或二種;當R為R1時,探針為探針1,當R為R2時,探針為探針2,結構為:
用于蛋白標記及檢測的熒光探針合成路線,如下:
具體合成步驟如下:
(1)中間體4-疊氮基-1,8-萘酐的合成:
將4-溴-1,8-萘酐溶于N,N-二甲基甲酰胺(DMF)制成反應液。疊氮化鈉溶于水中,滴加至反應液,加熱至90-100℃,持續4-8h,冷卻,倒入200-300mL冰水中抽濾,得4-疊氮基-1,8-萘酐。
(2)中間體4-氨基-1,8-萘酐的合成:
將4-疊氮基-1,8-萘酐置于乙腈中,并加入九水硫化鈉。加熱至50-70℃,持續8-20h,冷卻,倒入200-300mL冰水中,抽濾得4-氨基-1,8-萘酐。
(3)中間體4-(2-氯乙酰基)氨基-1,8-萘酐的合成:
將4-氨基-1,8-萘酐置于四氫呋喃中,并在冰浴下加入氯乙酰氯。室溫攪拌過夜(10-16h),減壓除去溶劑,硅膠柱分離,以二氯甲烷為洗脫劑,減壓除去溶劑得4-(2-氯乙酰基)氨基-1,8-萘酐。
(4)中間體4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐的合成:
將4-(2-氯乙酰基)氨基-1,8-萘酐置于乙腈中,攪拌下加入二乙胺。加熱至50-70℃,2-4h,減壓除去溶劑,硅膠柱分離,以二氯甲烷:甲醇=100:1-20:1為洗脫劑,減壓除去溶劑得4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐。
(5)當R為R1時,合成探針1:
將4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐溶于乙醇中,攪拌下加入正丁胺。加熱至80-90℃,3-6h,減壓除去溶劑,得探針1;
或,當R為R2時,合成探針2:
將4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐溶于乙醇中,攪拌下加入2-氨基-6-(4-氨甲基)芐氧基-嘌呤。加熱至80-90℃,3-6h,減壓除去溶劑,硅膠柱分離,以二氯甲烷:甲醇=50:1-10:1為洗脫劑,減壓除去溶劑得探針2。
步驟(1)中,4-溴-1,8-萘酐、N,N-二甲基甲酰胺(DMF)、疊氮化鈉,其質量比例為2:10:1-2:30:1。步驟(2)中,4-疊氮基-1,8-萘酐、乙腈、九水硫化鈉,其質量比為1:50:3-1:100:8。
步驟(3)中,4-氨基-1,8-萘酐、四氫呋喃、氯乙酰氯,其質量比為5:80:1-5:160:2。所述硅膠柱分離,以二氯甲烷為洗脫劑,減壓除去溶劑得4-(2-氯乙酰基)氨基-1,8-萘酐。
步驟(4)中,4-(2-氯乙酰基)氨基-1,8-萘酐、乙腈、二乙胺,其質量比為2:80:1-2:160:1.5。所述硅膠柱分離,以二氯甲烷:甲醇=100:1-20:1為洗脫劑,減壓除去溶劑得4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐。。
步驟(5)中,4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐、乙醇、正丁胺,其質量比為1:200:1-1:800:3;4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐、乙醇、2-氨基-6-(4-氨甲基)芐氧基-嘌呤,其質量比為1:200:1.5-1:800:3;所述硅膠柱分離,以二氯甲烷:甲醇=50:1-10:1為洗脫劑,減壓除去溶劑得探針2。。
上述的用于蛋白標記及檢測的熒光探針在SNAP蛋白標記與檢測及在生物熒光成像中可以應用。
本發明具有以下特征:
該類探針擁有合成原料低價、方法簡單易操作、易純化等優點。
該類探針在水溶液中呈現出~470nm的藍色熒光,在乙醇、二甲基亞砜、N,N-二甲基甲酰胺等極性溶劑中呈現出525-560nm的綠色到黃色熒光。在水溶液與不同有機極性溶劑混合液中,隨著有機極性溶劑的增加~470nm處熒光逐漸減弱而~550nm處的熒光逐漸增強。
該類探針能成功用于熒光標記,探針2與SNAP-tag蛋白特異性結合之后,~550nm處熒光比例明顯增加,通過這種比率的變化,可以排除其他因素的干擾,達到更精準的定位SNAP-tag蛋白。
該類探針可以通過SNAP-tag技術,引入到目標蛋白中,對目標蛋白進行更精準的監測。其可應用于生物 熒光成像等領域。
附圖說明
圖1該類熒光探針合成路線圖。
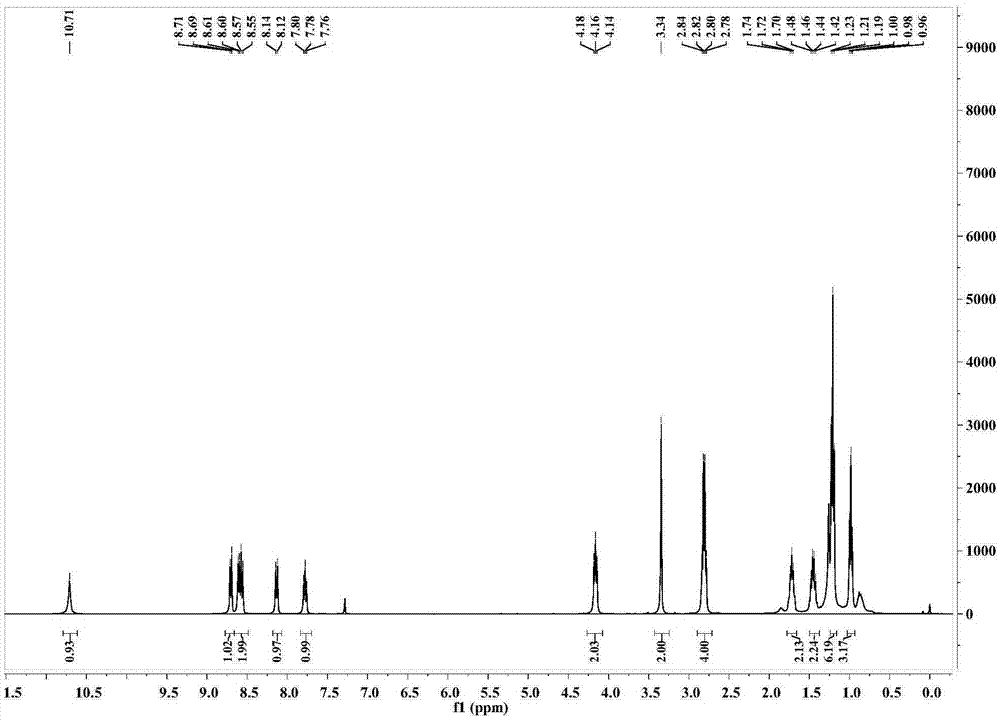
圖2實施例1制備的該熒光探針1核磁譜圖氫譜。
圖3實施例1制備的該熒光探針1核磁譜圖碳譜。
圖4實施例1制備的該熒光探針2核磁譜圖氫譜
圖5為實施例1制備的探針1在不同溶劑中的熒光譜圖,橫坐標為波長,縱坐標為熒光強度,熒光探針的濃度為10μM。
圖6為實施例1制備的探針1在不同溶劑中的紫外吸收譜圖,橫坐標為波長,縱坐標為吸收強度,熒光探針的濃度為10μM。
圖7為實施例1制備的探針1在水與二甲基亞砜不同比例(水:二甲基亞砜=10:0,9:1,8:2,7:3,6:4,5:5,4:6,3:7,2:8,1:9,0:10)下熒光譜圖,橫坐標為波長,縱坐標為熒光強度,熒光探針的濃度為10μM。
圖8實施例1制備的探針2與10μMSNAP-tag蛋白結合前后熒光譜圖。
圖9實施例1制備的探針2與10μMSNAP-tag蛋白結合前后歸一化熒光譜圖。
具體實施方式
實施例1:定位于溶酶體的H2S熒光探針的合成方法。
中間體4-疊氮基-1,8-萘酐的合成:
將4-溴-1,8-萘酐(2.0g,7.2mmol)置于100mL單口瓶中,加入20mL N,N-二甲基甲酰胺。將疊氮化鈉(1.4g,21.6mmol)溶于3mL水中并滴加至反應液,加熱至100℃,持續6h,冷卻,倒入冰水中抽濾,真空干燥得深黃色固體1.6g,產率93%。
中間體4-氨基-1,8-萘酐的合成:
將4-疊氮基-1,8-萘酐(1.5g,6.3mmol)溶于100mL乙腈中,并加入九水硫化鈉(6.0g,37.8mmol)。加熱至60℃,持續10h,冷卻,倒入冰水中,抽濾,真空干燥得到黃色固體1.1g,產率80%。
中間體4-(2-氯乙酰基)氨基-1,8-萘酐的合成:
將4-氨基-1,8-萘酐(1.0g,4.7mmol)置于60mL四氫呋喃中,并在冰浴下加入0.5mL氯乙酰氯。室溫攪拌過夜,減壓除去溶劑,硅膠柱分離,以二氯甲烷為洗脫劑,減壓除去溶劑得米白色固體1.0g,產率76%。
中間體4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐的合成:
將4-(2-氯乙酰基)氨基-1,8-萘酐(500mg,1.7mmol)置于50mL乙腈中,攪拌下加入356μL二乙胺。將反應液加熱至50℃,持續2h,減壓除去溶劑,硅膠柱分離,以二氯甲烷:甲醇=20:1為洗脫劑,減壓除去溶劑得淡黃色固體293mg,產率52%。1HNMR(400MHz,CDCl3)δ10.91(s,1H),8.84(d,J=8.3Hz,1H),8.67(dd,J=7.3,0.9Hz,1H),8.64(d,J=8.3Hz,1H),8.26(d,J=8.4Hz,1H),7.87(dd,J=8.5,7.4Hz,1H),3.36(s,2H),2.81(q,J=7.1Hz,4H),1.20(t,J=7.1Hz,6H)。
探針1的合成:
將4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐(50mg,0.15mmol)溶于20mL乙醇中,攪拌下加入50μL正丁胺。加熱至85℃,持續6h,減壓除去溶劑,得淡黃色固體49mg,產率85%。1HNMR(400MHz,CDCl3)δ10.71(s,1H),8.70(d,J=8.2Hz,1H),8.60(d,J=7.2Hz,1H),8.56(d,J=8.2Hz,1H),8.13(d,J=8.4Hz,1H),7.78(t,J=7.9Hz,1H),4.16(t,J=8.2Hz,2H),3.34(s,2H),2.81(q,J=7.0Hz,4H),1.78–1.65(m,2H),1.45(dd,J=14.9,7.4Hz,2H),1.21(t,J=7.1Hz,6H),0.98(t,J=7.3Hz,3H)。13CNMR(101MHz,CDCl3)δ170.49,164.09,163.55,138.58,132.70,130.94,128.88,126.63,125.44,123.50,122.84,117.87,116.59,58.64,49.00,40.18,30.20,20.38,13.82,12.64。
探針2的合成:
將4-(2-(N,N-二乙基氨基)乙酰基)氨基-1,8-萘酐(50mg,0.15mmol)溶于20mL乙醇中,攪拌下加入2-氨基-6-(4-氨甲基)芐氧基-嘌呤(83mg,0.30mmol)。將反應液加熱至85℃,持續6h,減壓除去溶劑,硅膠柱分離,以二氯甲烷:甲醇=20:1-10:1為洗脫劑,減壓除去溶劑得淡黃色固體65mg,產率75%。1HNMR(400MHz,MeOD)δ8.60(d,J=7.2Hz,1H),8.56(d,J=8.3Hz,1H),8.47(d,J=8.2Hz,1H),8.37(d,J=8.6Hz,1H),7.90–7.79(m,2H),7.49(s,4H),5.52(s,2H),5.35(s,2H),3.54(s,2H),2.90(d,J=6.9Hz,4H),1.24(t,J=7.1Hz,6H).
將該探針,包括探針1和探針2,溶于DMSO溶液中,配制成2mM母液,根據需要制配成不同濃度測試溶液,檢測其熒光光譜變化。
實施例2:探針1在水、乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜中的熒光性質。每次取20μL熒光探針母液,分別加入4mL水、乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜,配制成10μM的熒光探針測試液,并進行熒光光譜的測試。
圖5中熒光探針濃度為10μM,探針1在水、乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜中的熒光性質。探針1在水中呈現470nm左右的熒光,而在乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜中呈現~550nm左右的熒光,激發光為370nm。
實施例3:探針1在水、乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜中的紫外吸收。每次取20μL熒光探針母液,分別加入4mL水、乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜,配制成10μM的熒光探針測試液,并進行紫外吸收光譜的測試。
圖6中熒光探針濃度為10μM,探針1在水、乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜中的紫外吸收。探針1在水中的吸收出現~355nm左右,而乙腈、甲醇、N,N-二甲基甲酰胺、二甲基亞砜的吸收在~370nm左右。
實施例4:探針1在水與二甲基亞砜不同比例下熒光性質。每次取20μL熒光探針1母液,分別加入4mL水與二甲基亞砜不同比例的測試液中(水:二甲基亞砜=10:0,9:1,8:2,7:3,6:4,5:5,4:6,3:7,2:8,1:9,0:10),并進行熒光光譜的測試
圖7中熒光探針濃度為10μM,探針1在水中呈現~470nm左右的熒光,隨著二甲基亞砜的含量增加~550nm左右的熒光逐漸增強,激發光為405nm。
實施例5:探針2與SNAP-tag蛋白結合后熒光前后變化。取200μL探針母液2溶于5mL 20μM SNAP-tag蛋白母液,37℃下攪拌3h,凝膠柱分離,以PBS緩沖液(20mM,pH=7.4)為洗脫劑,并將探針濃度稀釋至10μM,進行熒光光譜測試。
圖8中10μM探針2與SNAP-tag蛋白結合后,探針熒光明顯增強(~8倍)且~550nm熒光比例明顯增加,激發光為370nm。
圖9為10μM探針2與SNAP-tag蛋白結合后,熒光強度前后歸一化結果,~550nm的熒光比例明顯增加,I466nm/I542nm在未結合蛋白之前為3.65,而結合SNAP-tag蛋白之后為2.11。
- 還沒有人留言評論。精彩留言會獲得點贊!