一種細胞膜定位鋅離子熒光探針及其制備方法和應用與流程
本本發明屬于生物分析檢測領域,具體涉及一種細胞膜定位的檢測鋅離子熒光探針、其合成方法及生物醫學應用。
背景技術:
熒光探針已成為細胞生物學研究中的重要工具,它使研究者能在復雜生物環境中直觀地看到特定的離子、分子以及生化反應過程。通過亞細胞器定位,熒光探針能檢測亞細胞器中的目標分析物,并能在細胞特定區域揭示不同的物理和化學性質。細胞膜是防止細胞外物質自由進入細胞的屏障,保證了細胞內環境的穩定。除了提供屏障作用外,細胞膜還是各種代謝以及信號傳導發生的場所。因此,在細胞膜上對目標分析物的實時監測及成像有助于理解細胞中的生化反應過程,同時也能及時地反映細胞的生長狀態,從而進一步對相關疾病進行前期診斷及治療。
鋅離子已被證明影響包括增殖、分化、凋亡等多個細胞生理過程,被認為是生物體不可或缺的微量元素。在生物體內,鋅離子除了與蛋白結合形成金屬蛋白復合物,還存在有游離態的自由鋅離子。在生物體的不同組織中,自由鋅離子含量大不相同,以神經系統,胰島組織,前列腺組織中含量最為豐富,并且這些組織的特定功能與鋅離子的存在密不可分。通過對這些組織中的自由鋅離子的檢測有助于對阿爾莫茲海默癥、糖尿病、前列腺癌的前期診斷。
技術實現要素:
本發明的目的是提供一種細胞膜定位鋅離子熒光探針及其制備方法與應用,該探針在復雜環境下能夠實現細胞膜定位且對鋅離子具有專一的選擇性和較高的靈敏度,其合成方法具有原料廉價易得、合成步驟簡單、適合放大合成的優點。
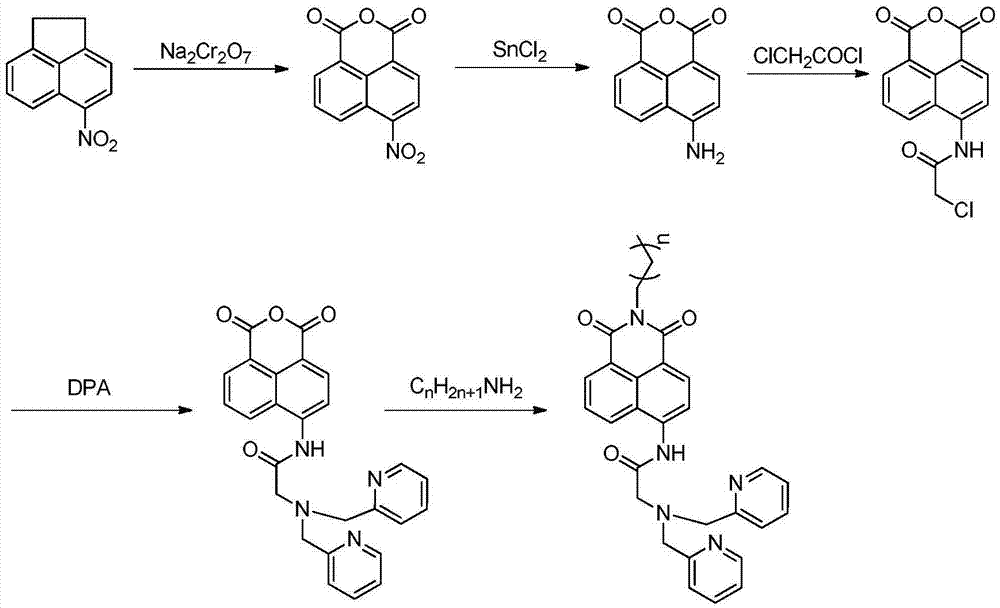
本發明提供了一種能實現細胞膜定位的檢測鋅離子熒光探針,該熒光探針以1,8-萘酰亞胺為熒光母體,酰胺-二甲基吡啶胺為識別基團,烷基長鏈為定位基團,烷基鏈長度為n,熒光探針結構通式如下:
其中4≤n≤18,并且n為整數。
本發明提供細胞膜定位鋅離子熒光探針的制備方法,該方法具體步驟如下:
1)4-硝基-1,8-萘酐的合成:將重鉻酸鈉用冰醋酸按0.1-0.5g/mL比例溶解,再加入相對于重鉻酸鈉0.1-0.5倍質量的5-硝基苊,120-150℃下回流反應3-8小時。將反應液與2-5倍體積的冰水混合,過濾得到濾餅進行重結晶,得到4-硝基-1,8-萘酐。
2)4-氨基-1,8-萘酐的合成:將4-硝基-1,8-萘酐用無水乙醇按0.1-0.5g/mL比例溶解,將相對于4-硝基-1,8-萘酐3-5倍質量的氯化亞錫用濃鹽酸按1-2g/mL溶解后,逐滴滴入上述4-硝基-1,8-萘酐和無水乙醇中,80-100℃下回流反應8-12小時過夜。反應液用1-5mol/L的碳酸鈉溶液調中性使產物析出,過濾,濾餅重結晶,得到4-氨基-1,8-萘酐。
3)4-(2-氯乙酰)氨基-1,8-萘酐的合成:將4-氨基-1,8-萘酐用干燥的THF按0.01-0.05g/mL比例,加入相對于4-氨基-1,8-萘酐5-10倍質量的氯乙酰氯,室溫下攪拌3-10小時后,反應體系由渾濁變澄清。旋干溶劑,柱層析分離,旋干得到4-(2-氯乙酰)氨基-1,8-萘酐。
4)4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐的合成:將4-(2-氯乙酰)氨基-1,8-萘酐、DPA、DIPEA和KI按質量比1:0.5-0.8:1.5-2:0.2-0.5混合,加入乙腈按0.01-0.05g/mL比例溶解4-(2-氯乙酰)氨基-1,8-萘酐,氮氣保護下80-100℃回流8-12小時過夜。反應結束后旋干溶劑,用旋干產物5-10倍質量的甲醇重結晶,得4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐。
5)探針分子的合成:將4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐、烷基胺按質量比1:1-2混合,加入乙醇按0.01-0.05g/mL比例溶解4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐,加熱至70-90℃回流8-12小時過夜。旋干溶劑后,柱層析分離得到探針分子。上述步驟5)中,所述烷基胺碳鏈長為4-18間的整數。
上述步驟5)中,所述柱層析的洗脫劑為二氯甲烷:甲醇=50:1,流速10-20ml/min,溫度20-25℃。
上述步驟3)中所述柱層析的洗脫劑為二氯甲烷,,流速10-20ml/min,溫度20-25℃。
具體合成路線如下:
本發明提供的熒光探針可應用于細胞膜定位檢測鋅離子及其在生物醫學中對鋅離子的檢測。
本發明具有以下特征:
探針分子制備原料易得,合成路線簡單,后處理方便。探針對鋅離子識別能力專一,響應速度快。與現有鋅離子探針相比,該探針能對細胞膜實現定位,監控細胞對鋅離子的釋放,在生物醫學領域有極其重要的應用價值。
附圖說明
圖1本發明熒光探針的結構式;
圖2本發明熒光探針合成路線圖;
圖3本發明實施例1制備的烷基碳鏈長n=12熒光探針C12核磁譜圖氫譜;
圖4本發明實施例2制備的烷基碳鏈長n=14熒光探針C14核磁譜圖氫譜;
圖5本發明實施例3制備的烷基碳鏈長n=18熒光探針C18核磁譜圖氫譜;
圖6本發明實施例1制備的烷基碳鏈長n=12熒光探針C12核磁譜圖碳譜;
圖7本發明實施例2制備的烷基碳鏈長n=14熒光探針C14核磁譜圖碳譜;
圖8本發明實施例4制備的烷基碳鏈長n=18熒光探針C18核磁譜圖碳譜;
圖9實施例1制備的n=12的熒光探針加入不同金屬離子后的熒光變化情況;
圖10實施例1制備的n=12的熒光探針與不同濃度的Zn2+作用后的熒光光譜圖;
圖11實施例1制備的n=12的熒光探針在結腸癌細胞中細胞膜定位效果;
圖12實施例1制備的n=12的熒光探針在前列腺細胞RWPE-1中共聚焦成像結果,其中,a,b,c分別為細胞的亮場圖,d為加入探針培養30分鐘后的細胞成像,e為加入Zn2+培養10分鐘后的細胞成像,e為加入EDTA后培養5分鐘后的細胞成像。
具體實施方式
下面的實施例將對本發明予以進一步的說明,但并不因此而限制本發明。
實施例1:細胞膜定位鋅離子熒光探針的制備,基本合成過程如下:
(1)4-硝基-1,8-萘酐的合成:
在單口瓶中,將11.2g(37.5mmol)重鉻酸鈉溶于50ml冰醋酸,再緩慢加入3g(15mmol)的5-硝基苊,回流反應3小時。將反應液與200mL冰水混合,過濾得到濾餅用水進行重結晶,得到4-硝基-1,8-萘酐2.35g,產率65%。
(2)4-氨基-1,8-萘酐的合成:
在燒瓶內加入1.2g(5mmol)的4-硝基-1,8-萘酐,10mL無水乙醇作為溶劑,隨后將4g(18mmol)的氯化亞錫用3.5mL濃鹽酸溶解,逐滴滴入燒瓶內,90℃下回流反應12小時過夜。反應液用2mol/L的碳酸鈉溶液調中性后過濾,濾餅用水重結晶,得到4-氨基-1,8-萘酐780mg,產率73%。
(3)4-(2-氯乙酰)氨基-1,8-萘酐的合成:
在燒瓶中用30mL干燥的THF溶解430mg(2mmol)的4-氨基-1,8-萘酐,加入1mL的氯乙酰氯,室溫下攪拌3小時后,反應體系由渾濁變澄清。旋干溶劑, 25℃下柱層析分離,旋干后得到黃色固體242mg,即4-(2-氯乙酰)氨基-1,8-萘酐,洗脫劑為二氯甲烷,產率42%。1H NMR(400MHz,CDCl3)δ9.25(s,1H),8.71(d,J=7.2Hz,1H),8.69–8.60(m,2H),8.31(d,J=8.8Hz,1H),7.94–7.90(m,1H),4.42(s,2H).
(4)4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐的合成:
在燒瓶中加入150mg(0.5mmol)的4-(2-氯乙酰)氨基-1,8-萘酐,94mg(0.45mmol)DPA,220mg(1.5mmol)DIPEA,40mg(0.24mmol)KI,50mL乙腈作溶劑,氮氣保護下回流過夜。旋干溶劑后,用1mL甲醇重結晶,得黃色蠟狀物175mg,即4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐,產率78%。1H NMR(400MHz,DMSO)δ11.62(s,1H),9.08(d,J=8.5Hz,1H),8.62(d,J=7.1Hz,1H),8.55(dd,J=17.9,8.4Hz,2H),8.40(d,J=4.5Hz,2H),8.09–8.03(m,1H),7.75(t,J=7.5Hz,2H),7.46(d,J=7.7Hz,2H),7.29–7.20(m,2H),4.06(s,4H),3.66(s,2H).
(5)探針分子的合成:
在燒瓶中加入90mg(0.2mmol)的4-(2-二甲基吡啶胺基乙酰)氨基-1,8-萘酐,90mg(0.48mmol)十二烷基胺,20mL乙醇做溶劑,90℃加熱回流過夜12小時。旋干溶劑后,25℃下柱層析分離后,旋干得到黃色蠟狀固體97mg即探針分子,洗脫劑為二氯甲烷:甲醇=50:1,產率80%。1H NMR(400MHz,CDCl3)δ11.73(s,1H),9.08(d,J=8.6Hz,1H),8.69(d,J=7.2Hz,1H),8.61(dd,J=23.5,8.2Hz,1H),8.45(d,J=4.2Hz,1H),7.89–7.78(m,1H),7.62(td,J=7.6,1.6Hz,1H),7.31(d,J=7.6Hz,1H),7.15(dd,J=7.4,5.0Hz,1H),4.22–4.12(m,1H),4.08(s,2H),3.62(s,1H),1.77–1.69(m,2H),1.62(s,5H),1.25(s,11H),0.87(t,J=6.7Hz,3H).
實施例2細胞膜定位鋅離子熒光探針的制備,基本合成過程如下:
用十四烷基胺替代實施例1步驟5)中的十二烷基胺,其余條件同實施例1進行反應,產率75%。1H NMR(400MHz,CDCl3)δ9.08(d,J=8.5Hz,1H),8.68(d,J=7.2Hz,1H),8.60(dd,J=27.5,8.3Hz,2H),8.45(d,J=4.5Hz,2H),7.91–7.78(m,1H),7.62(td,J=7.6,1.4Hz,2H),7.32(d,J=7.7Hz,2H),7.15(dd,J=6.9,5.3Hz,2H),4.22–4.13(m,2H),4.08(s,4H),3.62(s,2H),1.81–1.68(m,3H),1.25(s,20H),0.87(t,J=6.7Hz,4H)..
實施例3細胞膜定位鋅離子熒光探針的制備,基本合成過程如下:
用十八烷基胺替代實施例1步驟5)中的十二烷基胺,其余條件同實施例1進行反應,產率73%。1H NMR(400MHz,CDCl3)δ11.74(s,1H),9.09(d,J=8.5Hz,1H),8.69(d,J=7.0Hz,1H),8.62(dd,J=25.9,8.3Hz,2H),8.45(d,J=4.4Hz,2H),7.86–7.81(m,1H),7.62(t,J=6.9Hz,2H),7.31(d,J=7.7Hz,2H),7.18–7.12(m,2H),4.20–4.14(m,2H),4.08(s,4H),3.62(s,2H),1.73(d,J=6.7Hz,2H),1.25(s,30H),0.88(t,J=6.7Hz,3H).
圖3-5分別為n=12,14,18探針的核磁氫譜。
圖6-8分別為n=12,14,18探針的核磁碳譜。
實施例4:實施例1制備的n=12的熒光探針對Zn2+的選擇性檢測
圖9中的數據是在HEPES(濃度20mM,pH=7.4):CH3CN混合溶液(體積比5:5)中測試所得,激發波長為365nm。探針濃度為10μM,再每個實驗組中分別加入其它金屬離子(濃度分別均為30μM)Ag+,Au+,Ca2+,Cd2+,Co2+,Cr3+,Cu+, Cu2+,Fe2+,Fe3+,Hg2+,K+,Mg2+,Mn2+,Na+,Ni2+,Pb2+,Pd2+,Pt2+,Zn2+。結果顯示,只有在鋅離子和鉻離子存在條件下發生熒光增強,且鋅離子存在下發生的是明顯的紅移增強變化,鉻離子發生的是藍移增強變化,而其它金屬離子沒有太明顯變化,因此在上述干擾離子存在的條件下,探針對鋅離子仍具有較好的選擇性和靈敏度。圖9橫坐標為波長,縱坐標為熒光強度;
實施例3:實施例1制備的n=12的熒光探針對鋅離子測定的響應情況
圖10中的數據是在HEPES(濃度20mM,pH=7.4):CH3CN混合溶液(體積比5:5)中測試所得,激發波長為365nm。探針濃度為10μM,當鋅離子的濃度為0,0.1,1,1.5,2,3,4,5,6,8,10,20,30μM依次增加時,其熒光光譜逐漸發生明顯紅移增強變化。圖10中橫坐標為波長,縱坐標為熒光強度。
實施例4:實施例1制備的n=12的熒光探針在結腸癌細胞中細胞膜定位效果
圖11中細胞為結腸癌細胞,探針濃度為5μM,鋅離子濃度為25μM。在共聚焦小皿中以2萬細胞/培養皿的濃度接種結腸癌細胞,1640培養基培養5天后。吸去培養基,PBS緩沖溶液洗兩遍后,加入2mL新鮮1640培養基,再加入2mM濃度的熒光探針溶液,使其在培養基中濃度為5μM,CO2培養箱中37℃下培養30min后,吸去培養基,PBS洗2遍,加入2mL新鮮培養基,再加入10mM濃度的鋅離子溶液,使其在培養基中濃度為25μM。CO2培養箱中37℃下培養5min后,共聚焦顯微鏡405nm激光激發下成像拍照。可明顯觀測到探針聚集在細胞膜上,并與細胞膜上的鋅離子結合引起熒光強的增大和波長紅移。
實施例5:實施例1制備的n=12的熒光探針在前列腺細胞RWPE-1中共聚焦成像效果
圖12中細胞為前列腺正常細胞株RWPE-1,探針濃度為5μM,鋅離子濃度為25μM。在共聚焦小皿中以2萬細胞/培養皿的濃度接種RWPE-1細胞,1640培養基培養5天后。吸去培養基,PBS緩沖溶液洗兩遍后,加入2mL新鮮1640培養基,再加入2mM濃度的熒光探針溶液,使其在培養基中濃度為5μM,CO2培養箱中37℃下培養30min后,吸去培養基,PBS洗2遍,加入2mL新鮮培養基,共聚焦顯微鏡下觀察拍照。再加入10mM濃度的鋅離子溶液,使其在培養基中濃度為25μM,共聚焦顯微鏡下觀察拍照。再加入20mM濃度的EDTA溶液,使其在培養基中的濃度為50μM,共聚焦顯微鏡下觀察拍照。其中,a,b,c分別為細胞的亮場圖,d為加入探針培養30分鐘后405nm激光激發下的細胞成像,e為加入Zn2+培養10分鐘后405nm激光激發下的細胞成像,e為加入EDTA后培養5分鐘后405nm激光激發下的細胞成像;可明顯觀測到加入探針的細胞在不存在鋅離子的條件下,熒光值很低,當加入鋅離子后,熒光大幅提高,之后加入EDTA熒光消失,說明探針存在于細胞膜上。
- 還沒有人留言評論。精彩留言會獲得點贊!