一種基于液液相分離的殼-囊泡水凝膠的制作方法
本發明涉及新材料領域,尤其是一種基于液液相分離的殼-囊泡水凝膠。
背景技術:
1、作為細胞直接感知的三維(3d)微環境,細胞外基質(ecm)被認為是決定細胞命運的各種線索的重要來源。合成生物材料已被開發用于模擬?ecm?的?3d?微環境,以提供可調節的物理和機械性能來調節細胞行為,例如粘附、擴張、遷移和分化。在各種性能中,包括彈性、應力松弛和異質性在內的機械性能已被證明是指導細胞分化的最重要因素之一。在眾多合成生物材料中,具有可調機械強度的合成水凝膠尤其被用于研究細胞響應基質彈性的行為,以及探索未來在生物醫學工程中的應用。通常,細胞被封裝或接種到水凝膠中,在這種情況下,機械信號可以被所有維度的細胞感知,并且基質彈性可以得到很好的調整來調節細胞行為。
2、對于設計用于再生具有高機械強度的組織(例如軟骨和骨)的水凝膠,需要強大的基質彈性來將細胞分化向成骨細胞或成軟骨細胞的機械轉導。然而,基質的強彈性需要高交聯密度,這會限制細胞運動和增殖。此外,由于在溶脹過程中產生的強內應力,高交聯密度可能會顯著影響細胞活性。為此,將可降解交聯或三維的大孔結構引入水凝膠中用于組織再生,但是沖突依然只能部分解決。對于可降解水凝膠,由于交聯密度高,細胞的初始活力仍然很低,并且體內水凝膠的機械強度難以在一段時間內保持一致,以使細胞在機械轉導時分化。對于像水凝膠這樣的大孔海綿,在大孔完全填充后,細胞遷移仍然受到限制,因為水凝膠基質的交聯密度需要很高才能控制細胞分化。因此,探索細胞分化和基質彈性的解耦以解決沖突變得至關重要。通過獨立調整細胞分化和基質彈性,可以引導間充質干細胞向成骨細胞分化,而水凝膠基質的交聯密度仍然很低,在這種情況下,當大孔被完全填充后,細胞遷移和增殖的限制將被放開,從而極大程度地促進組織再生。
3、為此,我們開發了基于液?-?液相分離的含有殼覆蓋囊泡的水凝膠。通過將自組裝的蛋白質纖維引入水性前體中,葡聚糖相液滴在界面處被蛋白質納米纖維覆蓋,從而在所得水凝膠中形成殼-囊狀微結構。外殼覆蓋的囊泡具有出色的穩定性,不僅為細胞粘附和增殖提供空間,而且即使在過度壓縮的情況下也能保護細胞免受機械損傷。更重要的是,外殼的機械剛度高于水凝膠基質的機械剛度,因為與水凝膠基質相比,蛋白質納米纖絲的剛度顯著更高。外殼覆蓋的囊泡和水凝膠基質的獨特機械強度使得即使在水凝膠基質的低彈性下也可以引導囊泡中的干細胞向成骨細胞分化,從而將細胞分化和水凝膠基質的彈性解耦。作為原理證明,我們進一步證明了使用基于液-液相分離的殼-囊泡水凝膠在兔模型中進行骨再生的應用。考慮到使用相分離構建包含殼-囊泡的水凝膠的普遍性,并獨立調整殼覆蓋的囊泡和水凝膠基質的機械強度,我們預計這項發明可能會為探索與細胞分化解耦的材料開辟一個令人興奮的新領域,可在生物醫學工程領域得到廣泛應用。
技術實現思路
1、本發明所要解決的問題是,針對上述間充質干細胞三維培養和誘導分化中存在的難題,提出創新方案,利用囊泡水凝膠囊泡空間大的優勢以及自組裝蛋白纖維楊氏模量高的性質,設計出一種可以保護細胞讓其三維培養、增殖以及將細胞分化與水凝膠基質模量解耦合的囊泡水凝膠。
2、為解決上述問題,本發明采用的方案如下:一種基于液液相分離的殼-囊泡水凝膠,其特征在于,由自組裝溶菌酶纖維分子、多臂親水高分子、親水單體分子共聚形成的含殼層結構包裹的囊泡結構的空間三維網絡。
3、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,所述殼層結構由變性后的修飾雙鍵的溶菌酶分子自組裝并且與連續相內的多臂親水高分子、親水單體分子聚合連接。
4、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,所述多臂親水高分子為修飾雙鍵的四臂聚乙二醇,親水單體分子為丙烯酰胺,成膠方式為通過光引發劑在藍光條件下誘導溶解于自組裝蛋白纖維溶液(自組裝溶菌酶纖維分子溶液)中的修飾雙鍵的四臂聚乙二醇和丙烯酰胺聚合,形成水凝膠基質,同時交聯點參與網絡的交聯。
5、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,所述囊泡結構分布于水凝膠內部,由基于葡聚糖和聚乙二醇的液液相分離所形成。
6、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,所述自組裝溶菌酶纖維分子的制備方法如下:
7、(一)使用去離子水制備濃度為1.4?mm的溶菌酶溶液和濃度為28?mm的甲基丙烯酸酐溶液;
8、(二)將甲基丙烯酸酐溶液滴加到溶菌酶溶液中至40mm,并將混合物在50℃下以500r.p.m攪拌12小時;
9、(三)將混合物用3.5kda的透析袋透析以除去未反應的甲基丙烯酸酐,將產物凍干即得到修飾雙鍵的溶菌酶分子,并儲存在4°c;
10、(四)將修飾雙鍵的溶菌酶分子溶解在10mm的nacl?溶液中,使用鹽酸將ph值調節至2.0,所得溶液用?pvdf?(0.22?μm,?millipore)?過濾,然后在60℃下以550r.p.m攪拌60小時,獲得自組裝溶菌酶纖維分子。
11、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,所述葡聚糖和聚乙二醇的液液相分離形成條件為:50mg/ml葡聚糖(分子量40000)和10mg/ml修飾雙鍵的四臂聚乙二醇(分子量20000)、70mg/ml無官能團聚乙二醇、45mg/ml丙烯酰胺以體積比1:1混合振蕩后形成液液相分離,表現為葡聚糖以液滴形式均勻散布于聚乙二醇連續相內。
12、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,將基于液液相分離的殼-囊泡水凝膠應用于細胞培養、增殖、保護和分化。
13、進一步,所述基于液液相分離的殼-囊泡水凝膠,其特征在于,將基于液液相分離的殼-囊泡水凝膠應用于生物醫藥,組織工程,細胞注射治療和藥物遞送。
14、本發明的基于液液相分離的殼-囊泡水凝膠,實現間充質干細胞的高效三維培養、增殖和分化,并且將干細胞分化和基質彈性解耦,對于突破干細胞三維培養和其在軟材料中向骨方向分化的雙重經典難題實現了極大的推進作用,并且在生物醫藥、組織工程、醫療工程等方面具有具有較大的應用價值。
15、本發明的技術效果如下:1.相對于傳統的細胞三維培養水凝膠,本發明中的囊泡水凝膠內均勻分布了大量平均直徑可控的囊泡,可達百微米級,為間充質干細胞的增殖提供了充足空間,并且,囊泡水凝膠網絡內可共價錨定細胞結合序列rgd,有效的避免了間充質干細胞的失巢凋亡,表現為極高的細胞存活率。
16、2.本發明中的基于液液相分離的殼-囊泡水凝膠中囊泡結構的平均孔徑大小可以通過調節液液相分離中聚乙二醇和葡聚糖的濃度比例,以及光照交聯前的等待時間來調控;水凝膠的力學性質可以通過調節交聯點密度來調控。
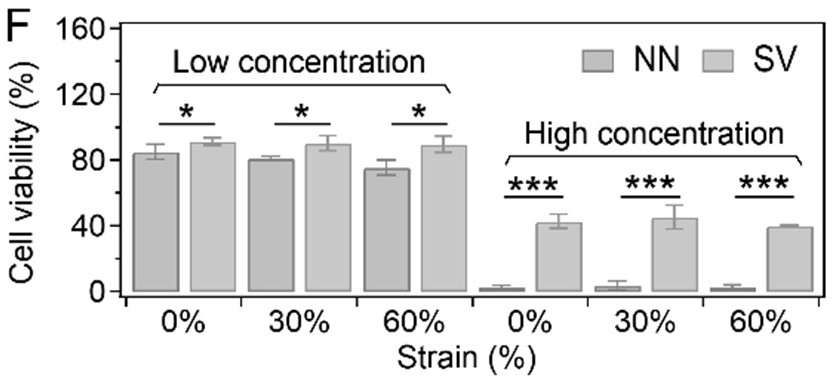
17、3.本發明中的基于液液相分離的殼-囊泡水凝膠,由硬質殼層包裹的囊泡結構可以高效的保護細胞,防止在水凝膠材料發生過度變形時的機械損傷。
18、4.本發明中的囊泡水凝膠,包裹囊泡的殼層結構含有高于水凝膠基質的楊氏模量,可以獨立誘導干細胞向成骨方向分化,與基質模量解耦。
19、5.本發明中的基于液液相分離的殼-囊泡水凝膠,其在細胞三維培養,保護,增殖和分化等發明展現出突破性的應用價值。并且,在生物醫藥,組織工程和醫療工程等方面具有巨大的潛在應用價值。
- 還沒有人留言評論。精彩留言會獲得點贊!