一種用于T細胞白血病微小殘留病檢測的試劑盒的制作方法
本實用新型涉及生物技術領域,尤其涉及一種用于T細胞白血病微小殘留病檢測的試劑盒。
背景技術:
急性淋巴細胞白血病(ALL)是最常見的成人急性白血病之一,它是一類以原幼淋巴細胞惡性增殖、蓄積、浸潤為特點的惡性血液病。多項研究報道采用系統治療方案,ALL患者完全緩解率(CR)70%-90%, 3-5年無病生存率為60%。盡管成人ALL的初治CR率己有明顯提高,但復發率高,長期生存率仍較低。同樣,兒童急性髓細胞白血病占兒童急性白血病的20%左右,卻占兒童AL病死人數的50%以上。目前使用新型藥物及造血干細胞移植的先進治療方案可使患者獲得接近70%的長期無病生存和超過50%的5年無事件生存率,但是復發率和病死率同樣較高。發生類似以上復發死亡的主要原因就是微小殘留(MRD) 所引起。急性淋巴細胞白血病在發病時體內大約有1012左右的白血病細胞,但經過多種化療藥物的聯合應用,在達完全緩解時,體內仍剩余108-1010左右的白血病細胞,但這些殘余白血病細胞通過現行形態學檢測己無法做出準確的測評,且這些殘存白血病細胞即是白血病復發的根源,因此這種白血病完全緩解后體內仍殘存白血病細胞的狀態稱為微小殘留病變。
目前MRD檢測技術主要是流式細胞術及多聚酶鏈式反應技術。雖然PCR靈敏度高,但可用于PCR監測的融合基因較少,使用范圍窄;基因突變、原癌基因過表達雖然覆蓋率高,但是靈敏度低。雖然mpFC 對于復發疾病的檢測靈敏度為10-4,但是復雜的多維數據依賴于實驗人員分析,人為因素影響大,不利于臨床標準化檢測。此外,在化療后白血病抗原的表達水平對MRD的mpFC檢測具有干擾作用。依賴于分子手段可以提高檢測MRD的靈敏度,可以達到10-5;然而,實時定量PCR需根據患者設計特殊的引物將多樣性豐富的重排序列擴增出來,其檢測費用昂貴、勞動力密集、很難形成標準化實驗流程,目前在進行檢測時多使用試劑盒進行檢測,但是現有的檢測盒,結構簡單,僅能夠起承載作用,不能根據試劑瓶的大小進行調節,且不能儲存試劑瓶,很不方便,為此,我們提出了一種用于T細胞白血病微小殘留病檢測的試劑盒來解決上述問題。
技術實現要素:
本實用新型的目的是為了解決現有技術中存在的缺點,而提出的一種用于T細胞白血病微小殘留病檢測的試劑盒。
為了實現上述目的,本實用新型采用了如下技術方案:
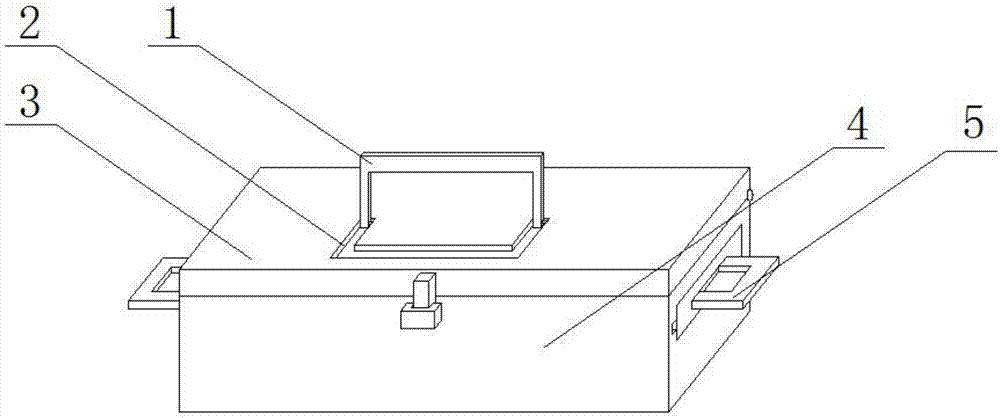
一種用于T細胞白血病微小殘留病檢測的試劑盒,包括盒體,所述盒體上鉸接有盒蓋,所述盒蓋的上端中部設有限位槽,所述限位槽內轉動連接有提手,所述盒體的兩側均設有開口,所述開口上貫穿設有放置板,所述放置板的兩側均設有滑塊,所述盒體內相對的側壁上設有和滑塊對應的滑槽,且滑塊位于滑槽內,所述放置板上設有放置槽,所述放置槽內等間距設有多個吸盤,所述吸盤上設有放氣口,所述放氣口上設有密封塞,所述吸盤的上端固定有支撐桿,所述支撐桿遠離吸盤的一端固定有承載板,所述承載板上固定有試劑瓶夾緊裝置,所述放置板的一側設有握把,所述盒體內的底部從左至右等間距設有兩個隔板,兩個隔板將盒體的內部等間距分隔三個大小相等的第一試劑瓶儲存區、第二試劑瓶儲存區和第三試劑瓶儲存區,所述三個試劑瓶儲存區的底部等間距設有多個試劑瓶放置槽。
優選地,所述試劑瓶夾緊裝置包括設置在承載板上的固定管,所述固定管為一端封閉的桶體,所述固定管封閉的一端焊接在承載板上,所述固定管上設有螺紋通孔,所述螺紋通孔內貫穿設有螺桿,所述螺桿的一端設有轉動塊,所述螺桿遠離轉動塊的一端設有擠壓塊,且擠壓塊上包覆有海綿墊。
優選地,所述提手和握把上均設有防滑紋。
優選地,所述盒蓋上設有鎖扣,所述盒體上設有和鎖扣對應的鎖孔。
優選地,所述盒體內的側壁上均設有保溫層。
優選地,所述第一試劑瓶儲存區的試劑瓶放置槽大于第二試劑瓶儲存區的試劑瓶放置槽,所述第二試劑瓶儲存區的試劑瓶放置槽大于第三試劑瓶儲存區的試劑瓶放置槽。
本實用新型中,使用時,利用鎖扣和鎖孔將盒蓋打開,將吸盤取出,根據需要從試劑瓶放置區取出對應的試劑瓶,可通過螺桿以及固定管來對不同的試劑瓶夾緊固定,從而進行檢測,提手的設置方便進行攜帶,本實用新型通過固定管、螺桿以及吸盤的結合,實現了對不同試劑瓶的夾取,同時還可以儲存不同類型的試劑瓶,方便操作,還便于攜帶,適宜推廣。
附圖說明
圖1為本實用新型提出的一種用于T細胞白血病微小殘留病檢測的試劑盒的結構示意圖;
圖2為本實用新型提出的一種用于T細胞白血病微小殘留病檢測的試劑盒的內部結構示意圖。
圖中:1提手、2限位槽、3盒蓋、4盒體、5握把、6滑槽、7 隔板、8固定管、9吸盤、10放置板、11螺桿、12支撐桿、13滑塊。
具體實施方式
下面將結合本實用新型實施例中的附圖,對本實用新型實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例僅僅是本實用新型一部分實施例,而不是全部的實施例。
參照圖1-2,一種可用于T細胞白血病微小殘留病檢測的試劑盒,使用步驟如下:
1、一步法RT-PCR步驟;
2、磁珠純化步驟
1)取出磁珠振蕩混勻5min取出45μl/個樣本的量放于室溫 10min;
2)RT-PCR的產物各取出20μl,剩余5μljustincase,再每個樣本加入30μlH2O,最后按照45μl/個加入磁珠,用槍吸吹約10次混勻,放于室溫2min;
3)開蓋放于磁力架上1min左右,液體變得澄清即可洗出液體,加入125μl85%的乙醇,1min后洗出棄掉,磁珠放于室溫8min(5-10min)晾干。
3、用Nanodrop測定DNA的濃度。如果濃度是20ng/μl,稀釋5 倍;如果接近40ng/μl,稀釋10倍。
4、末端修復:在1.5ml離心管中混合以下成分(50μl)
1)34μl純化的病人樣本基因組DNA(或補水至34μl)
2)5μl10×末端修復緩沖液
3)5μl2.5mMdNTP混合物
4)5μl10mMATP
5)1μl末端修復酶
室溫放置45分鐘。用QIAquickPCR純化柱純化,用34μl緩沖液洗脫。
5、3’末端加A:在1.5ml離心管中混合以下成分(50μl):
1)34μl步驟4的末端修復后的DNA
2)5μlKlenow緩沖液=NEBbuffer2
3)10μl1mMdATP
4)1μlKlenow片段(3’à5’外切酶活性)
(1mMdATP用100mMdATP母液稀釋,每管25μl分裝,只能凍融一次)
用MinElutePCR純化柱純化,12μl緩沖液洗脫。
6、接頭連接:在1.5ml離心管中混合以下成分(30ul)
1)11μl步驟5的DNA
2)15μlDNA連接緩沖液
3)1μl1:20稀釋的接頭寡核苷酸
4)3μlDNA連接酶
如果同時做多個重復,確保每個平行反應加入不同的接頭,標記清楚。
7、凝膠篩選除去多余的接頭:
將6μl稀釋10倍的上樣緩沖液加入到30μl第6步的反應液中,上樣至兩個E-gel膠孔中。另外取20μl稀釋10倍的50bpDNAladder 上樣。電泳20分鐘。
切取大小在150bp到450bp之間的DNA,用QIAquick凝膠純化試劑盒純化,
30μl洗脫緩沖液洗脫。
8、用Illumina引物PCR:
用Gibco水將IlluminaPCR引物1.1和2.1進行1:1稀釋
在PCR管中混合以下成分(60ul):
1)30μl步驟4的DNA
2)28μlPhusion PCR預混液
3)1μl稀釋的引物1.1
4)1μl稀釋的引物2.1
PCR循環:
9、2%瓊脂糖凝膠上進行分子量篩選:
將1μl稀釋的上樣緩沖液加入到上一步的PCR反應液中,上樣至三個E-gel膠孔中。另外分別取20μl稀釋10倍的50bp和 100bpDNAladder上樣。電泳30分鐘。切取大小在400bp左右的DNA。用QIAquick凝膠純化試劑盒純化DNA,用30μl洗脫緩沖液洗脫。
10、測定DNA濃度。用NanoDrop測定所得DNA的濃度。
本實用新型中,使用時,利用鎖扣和鎖孔將盒蓋3打開,將吸盤 9取出,根據需要從試劑瓶放置區取出對應的試劑瓶,可通過螺桿11 以及固定管8來對不同的試劑瓶夾緊固定,從而進行檢測,提手1的設置方便進行攜帶。
以上所述,僅為本實用新型較佳的具體實施方式,但本實用新型的保護范圍并不局限于此,任何熟悉本技術領域的技術人員在本實用新型揭露的技術范圍內,根據本實用新型的技術方案及其實用新型構思加以等同替換或改變,都應涵蓋在本實用新型的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!