蛋白質SiNADP?ME3及其編碼基因在調控植物抗逆性中的應用的制作方法
本發明屬于生物
技術領域:
,具體涉及蛋白質sinadp-me3及其編碼基因在調控植物抗逆性中的應用。
背景技術:
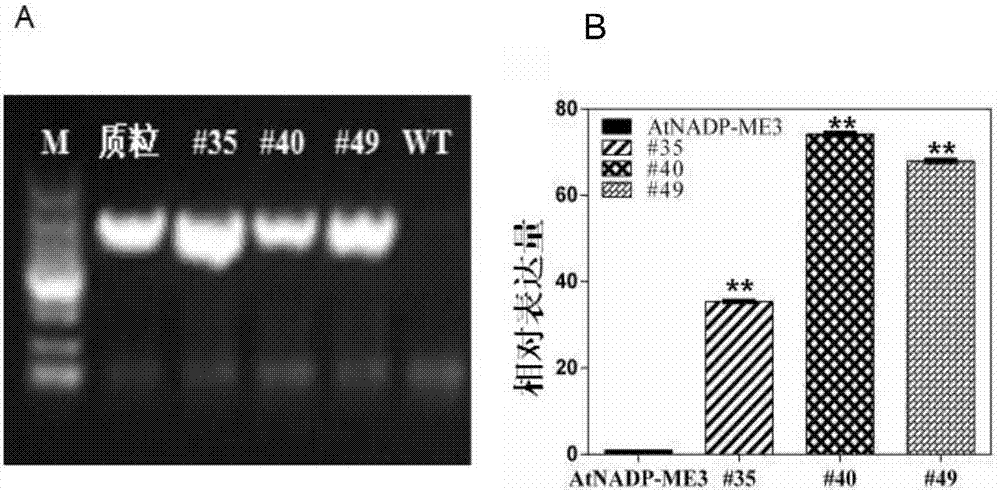
:干旱已成為世界范圍內農作物產量進一步提高和穩定生長的主要限制因素。谷子作為我國傳統的糧草兼用作物,具有耐貧瘠、水分利用效率高和光合作用效率高等優良特性,在旱作農業中占有重要地位。隨著水資源的日益匱乏,加強谷子耐旱種質資源研究、挖掘新的抗旱基因、進一步提高谷子耐旱性,對促進谷子生產水平的提高和其他作物抗旱性的改良具有重要的戰略意義。nadp-me參與植物的防御和脅迫應答。非光合型nadp-me涉及各種脅迫因素引起的防御反應,例如物理損傷、病原體侵入和uv-b輻射等。在這些應激下,nadp-me活性顯著增加,推測nadp-me在蘋果酸代謝過程中催化還原物質nadph的產生,用于木質素和其他物質合成。技術實現要素:本發明要解決的技術問題是如何提高植物抗逆性。為了解決上述技術問題,本發明首先提供了sinadp-me3蛋白質的新用途。本發明提供了sinadp-me3蛋白質在調控植物抗逆性中的應用;所述sinadp-me3蛋白質為如下a)或b)或c)或d)的蛋白質:a)氨基酸序列是序列2所示的蛋白質;b)在序列2所示的蛋白質的n端和/或c端連接標簽得到的融合蛋白質;c)將序列2所示的氨基酸序列經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加得到的具有相同功能的蛋白質;d)與序列2所示的氨基酸序列具有75%或75%以上的同源性且具有相同功能的蛋白質。為了使a)中的蛋白質便于純化,可在序列表中序列2所示的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。表1、標簽的序列上述c)中的蛋白質,所述一個或幾個氨基酸殘基的取代和/或缺失和/或添加為不超過10個氨基酸殘基的取代和/或缺失和/或添加。上述c)中的蛋白質可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述c)中的蛋白質的編碼基因可通過將序列1所示的dna序列中缺失一個或幾個氨基酸殘基的密碼子,和/或進行一個或幾個堿基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標簽的編碼序列得到。上述d)中,“同源性”包括與本發明的序列2所示的氨基酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同源性的氨基酸序列。為了解決上述技術問題,本發明還提供了與sinadp-me3蛋白質相關的生物材料的新用途。本發明提供了與sinadp-me3蛋白質相關的生物材料在調控植物抗逆性中的應用:所述生物材料為下述a1)至a12)中的任一種:a1)編碼sinadp-me3蛋白質的核酸分子;a2)含有a1)所述核酸分子的表達盒;a3)含有a1)所述核酸分子的重組載體;a4)含有a2)所述表達盒的重組載體;a5)含有a1)所述核酸分子的重組微生物;a6)含有a2)所述表達盒的重組微生物;a7)含有a3)所述重組載體的重組微生物;a8)含有a4)所述重組載體的重組微生物;a9)含有a1)所述核酸分子的轉基因植物細胞系;a10)含有a2)所述表達盒的轉基因植物細胞系;a11)含有a3)所述重組載體的轉基因植物細胞系;a12)含有a4)所述重組載體的轉基因植物細胞系。上述應用中,a1)所述核酸分子為如下1)或2)或3)所示的基因:1)其編碼序列是序列1所示的cdna分子或基因組dna分子;2)與1)限定的核苷酸序列具有75%或75%以上同一性,且編碼sinadp-me3蛋白質的cdna分子或基因組dna分子;3)在嚴格條件下與1)或2)限定的核苷酸序列雜交,且編碼sinadp-me3蛋白質的cdna分子或基因組dna分子。上述應用中,所述載體可為質粒、黏粒、噬菌體或病毒載體。上述應用中,所述微生物可為酵母、細菌、藻或真菌,如農桿菌。上述應用中,所述轉基因植物細胞系不包括繁殖材料。為了解決上述技術問題,本發明還提供了sinadp-me3蛋白質或上述生物材料的新用途。本發明提供了sinadp-me3蛋白質或上述生物材料在培育抗逆性提高的轉基因植物中的應用。本發明還提供了sinadp-me3蛋白質或上述生物材料在植物育種中的應用。上述應用中,所述抗逆性為抗旱性。上述應用中,所述調控為提高,具體體現在:在充分澆水的條件下,轉sinadp-me3擬南芥的根長、葉片面積、莖伸長率、生長速率、花莖高度高于野生型擬南芥;在水分脅迫條件下,轉sinadp-me3擬南芥水分散失率和細胞死亡率均低于野生型擬南芥;在干旱脅迫下,轉sinadp-me3擬南芥的存活率和總生物量高于野生型擬南芥。為了解決上述技術問題,本發明最后提供了一種培育抗逆性提高的轉基因植物的方法。本發明提供的培育抗逆性提高的轉基因植物的方法包括提高受體植物中sinadp-me3蛋白質的含量和/或活性,得到轉基因植物的步驟;所述轉基因植物的抗逆性高于所述受體植物。上述方法中,所述抗逆性為抗旱性。上述方法中,所述轉基因植物的抗逆性高于所述受體植物體現在如下(1)-(9)中任一種:(1)轉基因植物的葉片面積高于受體植物;(2)轉基因植物的根長長于受體植物;(3)轉基因植物的莖伸長率和/或生長速率高于受體植物;(4)轉基因植物的花莖高度高于受體植物;(5)轉基因植物的抽薹時間早于受體植物;(6)轉基因植物的水分散失率低于受體植物;(7)轉基因植物的細胞死亡率低于受體植物;(8)轉基因植物的存活率高于受體植物;(9)轉基因植物的總生物量高于受體植物。上述方法中,所述提高受體植物中sinadp-me3蛋白質的含量和/或活性的方法為在受體植物中過表達sinadp-me3蛋白質;所述過表達的方法為將sinadp-me3蛋白質的編碼基因導入受體植物;所述sinadp-me3蛋白質的編碼基因的核苷酸序列是序列1所示的dna分子。在本發明的實施例中,所述sinadp-me3蛋白質的編碼基因通過含有sinadp-me3基因表達盒的sinadp-me3基因重組表達載體導入所述受體植物中;所述含有sinadp-me3基因表達盒的sinadp-me3基因重組表達載體為超表達載體pcambia1304::35s::sinadp-me3;所述超表達載體pcambia1304::35s::sinadp-me3為將序列1所示的sinadp-me3基因的cds序列插入pcambia1304骨架載體的ncoi酶切位點中,且保持pcambia1304骨架載體其他序列不變得到的載體。上述方法中,所述轉基因植物理解為不僅包含將所述sinadp-me3基因轉化目的植物得到的第一代轉基因植物,也包括其子代。對于轉基因植物,可以在該物種中繁殖該基因,也可用常規育種技術將該基因轉移進入相同物種的其它品種,特別包括商業品種中。所述轉基因植物包括種子、愈傷組織、完整植株和細胞。上述應用中,所述受體植物為單子葉植物或雙子葉植物,所述雙子葉植物可為擬南芥,所述擬南芥可為野生型擬南芥(哥倫比亞型)。本發明在前期的研究中,利用谷子旱敏感材料an04與抗旱品種yugu1間的轉錄組學分析數據,結合谷子抗旱性狀全基因組關聯分析,獲得了一個與抗旱性相關的候選基因sinadp-me3。本發明首先構建了超表達載體pcambia1304::35s::sinadp-me3,并利用農桿菌介導的花序侵染法將超表達載體pcambia1304::35s::sinadp-me3轉入野生型擬南芥,得到轉sinadp-me3擬南芥。通過實驗證明:轉sinadp-me3擬南芥相較于野生型具有萌發早、根長長、葉面積大和花莖高等特點;水分生理研究實驗結果表明轉sinadp-me3擬南芥具有更高水分利用效率;抗性實驗則表明轉sinadp-me3擬南芥具有更高的植物抗旱性。轉sinadp-me3擬南芥在充分澆水及干旱脅迫下均表現出更高的生物量積累。證明sinadp-me3在植物干旱脅迫下維持產量發揮著重要的作用,在作物抗旱和水分高效利用方面具有重要的實踐意義,也為深入理解谷子耐旱性產生的機理提供了線索。附圖說明圖1為超表達載體pcambia1304::35s::sinadp-me3的構建。圖2為轉sinadp-me3擬南芥的篩選。圖a為轉sinadp-me3擬南芥的pcr檢測結果;圖b為轉sinadp-me3擬南芥的qrt-pcr分析結果。圖3為轉sinadp-me3擬南芥在正常水分供給下的表型分析。圖a為8日齡轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)的初生根長度比較;圖b為18日齡轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)的幼苗葉面積比較;圖c為25-40日齡轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)的平均莖伸長率比較;圖d為8日齡轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)的初生根長度的形態學比較;圖e為18日齡轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)的幼苗蓮座葉的形態學比較;圖f為在充分澆水的條件下生長的23日齡轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)幼苗的生長形態。誤差條表示平均值±se(n=30);*表示在p≤0.05和**p≤0.01水平上的顯著差異。圖4為轉sinadp-me3擬南芥的脫水耐旱性分析。圖a為3周齡的轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)葉片在脫水處理0h、1h和6h的表型圖;圖b為在脫水6h后野生型擬南芥(wt)和轉sinadp-me3擬南芥的離體葉的臺盼藍染色圖;圖c為在脫水處理6h后轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體擬南芥(vc)的離體植株失水率。圖5為轉sinadp-me3擬南芥的干旱脅迫實驗。圖a為在土壤中生長的轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體植株(vc)的耐旱表型;圖b為復水后轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體植株(vc)的存活率;圖c為干旱處理后轉sinadp-me3擬南芥、野生型擬南芥(wt)和轉空載體植株(vc)的總生物量。圖6為sinadp-me3基因的表達模式。圖a為孕穗期sinadp-me3基因qrt-pcr分析結果;圖b為抽穗期sinadp-me3基因qrt-pcr分析結果;圖c為孕穗期sinadp-me3基因rt-pcr分析結果;圖d為抽穗期sinadp-me3基因rt-pcr分析結果。具體實施方式下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。下述實施例中的定量試驗,均設置三次重復實驗,結果取平均值。下述實施例中的谷子品種豫谷1號(yugu1)在記載于文獻“胡咸廷.豫谷1號[j].新農業,1985,(05):25.”中,公眾可從申請人處獲得,該生物材料只為重復本發明的相關實驗所用,不可作為其它用途使用。下述實施例中的pcambia1304骨架載體是普如汀生物技術(北京)有限公司的產品,產品目錄號為biovectorpcambia1304。下述實施例中的根癌農桿菌gv3101是北京天恩澤生物技術有限公司的產品,產品目錄號為140384-10。實施例1、轉sinadp-me3擬南芥的獲得及抗逆性分析一、轉sinadp-me3擬南芥的獲得1、pcambia1304::35s::sinadp-me3超表達載體的構建將序列1所示的sinadp-me3基因的cds序列插入pcambia1304骨架載體的ncoi酶切位點中,得到pcambia1304::35s::sinadp-me3超表達載體。pcambia1304::35s::sinadp-me3超表達載體表達sinadp-me3蛋白,sinadp-me3蛋白的氨基酸序列如序列2所示。2、重組菌的制備將pcambia1304::35s::sinadp-me3超表達載體轉入根癌農桿菌gv3101中,得到重組菌pcambia1304::35s::sinadp-me3/gv3101。將pcambia1304轉入農桿菌根癌農桿菌gv3101中,得到重組菌pcambia1304/gv3101。3、轉sinadp-me3擬南芥的獲得及鑒定利用農桿菌介導的花序侵染法用重組菌pcambia1304::35s::sinadp-me3/gv3101侵染野生型擬南芥(哥倫比亞型)進行遺傳轉化,收集轉基因t0代種子并播種于含有60mg/l潮霉素的1/2ms篩選培養基中,大約2周左右觀察發現多數種子不能萌發或發芽后葉片白化生長受到抑制,只有極少數植株生長態勢良好,將健康株系轉移至營養缽內繼續培養,并利用pcr方法檢測陽性轉基因植株。按株系收獲t1代轉基因種子,然后進一步分株系進行繁殖培養,直至獲取t3代轉基因植株種子。按照上述方法利用農桿菌介導的花序侵染法用重組菌pcambia1304/gv3101侵染野生型擬南芥(哥倫比亞型)進行遺傳轉化,得到轉空載體擬南芥。pcr檢測陽性轉基因植株方法如下:提取轉基因植株的基因組dna,采用pc1304f:acgcacaatcccactat和pc1304ragagggtgaaggtgat引物進行pcr擴增,擴增得到大小為1938bp的植株為陽性轉sinadp-me3擬南芥。部分陽性轉sinadp-me3擬南芥株系的pcr檢測結果如圖2a所示。從圖中可以看出:陽性轉sinadp-me3擬南芥株系#35、#40、#49均可以擴增出目的條帶,而野生型擬南芥沒有擴增出條帶。4、轉sinadp-me3擬南芥的sinadp-me3表達量檢測為了檢測sinadp-me3在轉sinadp-me3擬南芥株系中的遺傳穩定性,提取t3代陽性轉sinadp-me3擬南芥rna,以反轉錄獲得的cdna模板進行實時熒光qrt-pcr檢測。同時以sinadp-me3基因在擬南芥中的同源基因atnadp-me3(at1g79750)為參照基因,actin為內參基因分析過表達植株的表達量。引物序列如下:sinadp-me3-f:ctcaaggacaagggcaagatcc;sinadp-me3-r:ggccaatgtagaactcgtcgtt;atnadp-me-f:tttgatcatgtccggtgccatt;atnadp-me-r:agattcgatgccagtccgagtt。結果如圖2b所示。結果表明:在以actin為內參基因和atnadp-me3為參照基因的對比下,sinadp-me3基因在陽性轉sinadp-me3擬南芥株系#35、#40、#49中均有較高的表達量,說明sinadp-me3已成功整合到擬南芥染色體上并能遺傳到子代中。選取陽性轉sinadp-me3擬南芥株系#35、#40、#49用于下述抗逆性分析實驗。二、轉sinadp-me3擬南芥的抗逆性分析1、根長、葉片面積及莖伸長率檢測在充分澆水條件下,將陽性轉sinadp-me3擬南芥株系#35、#40、#49、轉空載體擬南芥(vc)和野生型擬南芥(wt)的種子同時播種于1/2ms培養基中。種子萌發后8d,比較陽性轉sinadp-me3擬南芥株系#35、#40、#49、轉空載體擬南芥、野生型擬南芥幼苗的初生根長。然后分別將幼苗移入土中,比較萌發后18d的幼苗葉面積,擬南芥萌發生長25天后,首次測量花莖高度,然后每隔3天測量同一植株的花莖高度,每個株系至少測量10株,重復3次。平均莖伸長率=(萌發n天后花莖高度-萌發(n-3)天后花莖高度)/3。結果如圖3所示。結果表明:在充分澆水的條件下,轉空載體擬南芥(vc)的生長狀態和野生型擬南芥(wt)沒有顯著性差異(初生根長、葉面積和莖伸長率統計數據經t檢驗后,p值大于0.1,無顯著性差異)。陽性轉sinadp-me3擬南芥株系#35、#40、#49在發芽期、幼苗生長期、抽薹期和成熟期均都表現較明顯的生長優勢。其中,陽性轉sinadp-me3擬南芥株系#35、#40、#49的根長均比轉空載體擬南芥(vc)和野生型擬南芥(wt)長(圖3a和圖3d)。將幼苗移入土中后,陽性轉sinadp-me3擬南芥株系#35、#40、#49均表現出較大的總葉面積(圖3b和圖3e),陽性轉sinadp-me3植株的葉片面積是野生型擬南芥和轉空載體擬南芥的2-2.5倍。而且在擬南芥抽薹時間上,陽性轉sinadp-me3擬南芥在萌發22天后抽薹,野生型擬南芥萌發24天后抽薹,陽性轉sinadp-me3擬南芥要比野生型提前1-2天。在生長前期(萌發后24-37d)陽性轉sinadp-me3擬南芥株系#35、#40、#49的平均莖伸長率均高于野生型擬南芥和轉空載體擬南芥,均有較快的生長速率(圖3c和圖3f),在萌發后37d時,轉sinadp-me3擬南芥的花莖高度為29.3-31.6cm,而野生型擬南芥的花莖高度為23.4-25.6cm。2、水分脅迫的耐受性檢測(1)脫水處理為了進一步探究陽性轉sinadp-me3擬南芥株系對水分脅迫的耐受性,將發芽后生長3周的野生型擬南芥、轉空載擬南芥以及陽性轉sinadp-me3擬南芥株系#35、#40、#49放置于干燥的濾紙上在干旱培養箱(溫度為25℃,濕度為30%,光照強度為150μmol·m-2·s-1,光照周期為16h光照/8h黑暗的)內進行脫水處理試驗,分別在脫水處理1h、3h和6h后檢測植株的失水程度。結果如圖4所示。結果表明:隨著處理時間的增長,野生型擬南芥和轉空載擬南芥葉片的萎蔫速度更快,而陽性轉sinadp-me3擬南芥株系#35、#40、#49水分散失較慢,保水性較強,當脫水處理時間達到6h后,野生型擬南芥的葉片萎蔫更加嚴重(圖4a)。(2)臺盼藍染色對脫水處理6h后的植株葉片進行臺盼藍染色。具體步驟如下:將脫水處理6h后的各株系植物進行臺盼藍染色,鑒定細胞膜的破壞程度。臺盼藍染液配方:1ml的乳酚溶液加入2.5mg曲利苯藍,50ml乳酚溶液體系即25%乳酸、23%水溶苯酚、25%甘油,無菌水定容至50ml。將待檢測的株系分別放入臺盼藍染液中沸水浴10min,室溫染色12h后,2.5mg/ml的水合氯醛脫色3-4d,期間需要更換脫色液,脫色后觀察是否有藍斑,并照相留證。染色后的葉片可在50%的甘油中保存。結果表明:野生型擬南芥和轉空載體擬南芥的顏色均比陽性轉sinadp-me3擬南芥深,說明野生型擬南芥和轉空載體擬南芥的細胞死亡率均高于陽性轉sinadp-me3擬南芥(圖4b)。(3)水分散失率由于陽性轉sinadp-me3擬南芥相較于同時期的野生型擬南芥有較強的生長優勢,采取面積失水率的計算方式排除葉片面積的大小對于失水率的影響計算水分散失率。具體步驟如下:將在正常條件下生長3周的陽性轉sinadp-me3擬南芥、野生型擬南芥和轉空載擬南芥整株剪下后放在裝有干燥的濾紙的培養皿內稱重并拍照測量植株的表面積;將樣品連同培養皿一起放置在溫度為21-25℃,濕度為45-50%的培養箱內,在指定的時間內稱重并拍照。植株的葉片面積失水率=(植株鮮重-風干后重量)/(風干時間×葉片面積)。結果表明:陽性轉sinadp-me3擬南芥株系#35、#40、#49的水分散失率均低于野生型擬南芥和轉空載擬南芥(圖4c)。上述結果表明:陽性轉sinadp-me3擬南芥確實可以提高其耐旱能力。3、抗旱性檢測將在1/2ms培養基上正常條件下萌發生長10d的野生型擬南芥、轉空載擬南芥以及陽性轉sinadp-me3擬南芥株系#35、#40、#49的幼苗移栽到營養土中,恢復生長2d。然后將幼苗移入溫度為25℃,濕度為30%,光照強度為150μmol·m-2·s-1,光照周期為16h光照/8h黑暗的干旱培養箱中生長。干旱處理15d后,觀察植株的生長狀態。復水8d后統計植株的存活率和生物量。生物量的計算方法為:取成熟后相同株數的植株烘干后稱重,所得重量即為總生物量。結果表明:干旱處理15d后所有野生型擬南芥和轉空載體擬南芥葉片均出現嚴重的萎蔫和枯死,而陽性轉sinadp-me3擬南芥株系#35、#40、#49均只少數葉片出現干枯的現象(圖5a),同時發現陽性轉sinadp-me3植株相較于野生型擬南芥和轉空載體擬南芥的生長狀態有明顯的優勢。所有植株復水處理8d后,陽性轉sinadp-me3擬南芥株系#35、#40、#49的存活率均顯著高于野生型植株(圖5b),能夠很快恢復生長,并能正常開花結果,形成的總生物量更大(圖5c)。綜上所述,轉sinadp-me3擬南芥相較于野生型擬南芥具有萌發早、根長長、葉面積大和花莖高等特點;水分生理研究實驗結果表明陽性轉sinadp-me3擬南芥具有更高水分利用效率;抗性實驗則表明陽性轉sinadp-me3擬南芥具有更高的植物耐旱性。轉sinadp-me3擬南芥在充分澆水及干旱脅迫下均表現出更高的生物量積累。證明sinadp-me3在植物干旱脅迫下維持產量發揮著重要的作用。實施例2、sinadp-me3基因在谷子中的組織特異性表達為了驗證sinadp-me3基因在谷子中的組織特異性表達特征,采用實時熒光qrt-pcr和半定量rt-pcr的方法分析yugu1在正常生長條件下孕穗期以及抽穗期sinadp-me3基因的組織特異性表達。具體步驟如下:1、植物組織rna的提取用trizol(catno.15596-026,invitrogen,scotland,uk)法提取組織(根、莖、葉和穗)rna,然后用purelinkrnakit(catno.12183018,invitrogen,scotland,uk)進行純化,去除雜質及dna片段。具體步驟如下:(1)將研缽、研杵、剪刀和鑷子等提取rna專用工具至于托盤內,淋上95%酒精火中煅燒約5min中,除去rnase,稍冷卻后浸入液氮中預冷。rna提取專用操作臺先用75%的酒精擦拭干凈后噴灑rnasezap除去rnase。整個rna提取操作過程中需穿潔凈實驗服,戴手套和口罩,避免唾液和汗液中的rnase進入樣品使rna被降解。(2)快速稱取0.1-0.15g葉片或其他組織,放入盛有液氮的研缽中迅速冷凍,待其變脆后快速研磨1-2次,使材料破碎成粉狀,研磨充分。過程中需不斷補充液氮以保持低溫,降低rna的降解。(3)將研磨充分的材料轉移到已經加入1mltrizol試劑的2mlrnase-free離心管中,充分振蕩后至于冰上,待所有樣品加入trizol后,渦旋振蕩15s,室溫靜置5min。(4)每1ml的trizol加200μl的氯仿,渦旋振蕩15s,室溫放置2-3min,4℃12000rpm條件下離心15min。(5)轉移上清液到新的1.5mlrnase-free的離心管中,加等體積70%酒精,充分混勻并使產生的沉淀溶解。(6)吸取700μl混勻的樣品加入purelinkrnaminikit試劑盒的柱子中,室溫12000rpm離心15s,重復3-4次,直至所有樣品過完柱子。(7)向過濾柱中加入700μlwbⅰ室溫12000rpm離心15s,清洗柱子,棄去濾液。(8)向過濾柱中加入500μlwbⅱ室溫12000rpm離心15s,清洗柱子,棄去濾液,重復操作一次,室溫12000rpm離心2min,使柱子干燥。(9)將過濾柱轉移至新的1.5mlrnase-free的離心管中,加入30-100μlrnase-freewater,室溫放置1min,溶解rna。(10)室溫12000rpm離心2min,收集rna。提取的rna可立即反轉成cdna,-20℃保存,也可直接放于-80℃保存。(11)取少量rna用nanodrop1000測定樣品的od260、od280、od320、od260/od280及其濃度進行鑒定。只有rna樣品的od260/od280比值在1.9-2.1之間,od260/od230比值≥2.0,才能用于后續試驗。(12)用1%瓊脂糖凝膠電泳,快速電泳檢測rna質量。高質量的rna應具有28s和18s兩條明亮且清晰的帶,并且28s的亮度是18s的兩倍以上。2、rna反轉成cdna使用takaraprimerscriptⅱ1ststandcdnasynthesiskit(catno.6210a,takara,otsushiga,japan)反轉錄試劑盒,將rna反轉成cdna。具體步驟如下:(1)在200μl的rnase-free離心管中加入下列試劑:oligodt(500μg/ml)1μl、dntpmixture1μl、總rna5μg、rnasefreedh2o至總體積為10μl。(2)離心管放置于pcr上,65℃反應5min,然后于冰上迅速冷卻。(3)在上述離心管中加入以下反應液:5×primescripttmbuffer4μl、rnaseinhibitor(40u/μl)0.5μl(20u)、primescripttmrtase(200u/μl)1μl(200u)、rnasefreedh2o4.5μl。(4)將離心管放置于pcr儀上,按照42℃反應40min,70℃反應15min,4℃停止反應的程序反轉成cdna,將反轉成功的cdna稀釋10倍后放置于-20℃保存。3、通過qrt-pcr的方法檢測sinadp-me3基因表達量差異性(1)根據sinadp-me3基因的cds序列使用ncbi引物設計網頁設計引物,并用常規pcr的方法檢測引物的保守性,選擇擴增片端單一的引物。引物序列如下:seita.3g109300:cgcatccttccatctgta和ccatctccgacgacatat;actin:tatgggtcatcaacagcttgtc和gtagtccctcgtgatgagatcc。(2)使用faststartuniversalsybrgreenmasterkit(catno.04913914001,roche,mannheim,germany)進行qrt-pcr實驗,將配置好體系加入標準96孔qrt-pcr板。(3)用appliedbiosystems7300analyzer(appliedbiosystems,fostercity,ca,usa)熒光定量pcr儀器運行qrt-pcr程序。qrt-pcr每個樣品均進行三次獨立實驗重復。反應體系如表1。表1、pcr反應體系反應液成分體積最終濃度faststartuniversalsybr25.0μl1×primers:f+r(30μm)各0.5μl300nmcdna(100ng/μl)5μl200ngddh2o19μl表2、pcr反應程序程序名稱溫度時間預變性95℃2min變性95℃1min退火60℃1min延伸72℃1min總延伸72℃7min4、通過rt-pcr的方法檢測sinadp-me3基因特異性表達使用上述設計的熒光引物,以yugu1品種抽穗期的根、莖、葉和穗的cdna為模板檢測sinadp-me3基因的特異性表達,首先用actin引物將各組織的模板亮度調成一致,記錄此時各組織模板的用量,然后再用sinadp-me3基因引物擴增各組織模板。kodfx酶(codeno.kfx-101toyobojapan)反應體系及程序如表3和表4所示。表3、pcr擴增體系成分加入量dna模板nμl2×primegcbuffer12.5μlprimerf/r各0.75μl2mmdntp5μlkodfx酶0.5μlddh2oupto25μl表4、pcr反應程序(注:循環數為30個循環)結果如圖6所示。圖a和圖b分別為孕穗期和抽穗期的qrt-pcr檢測結果:由圖可看出在孕穗期,sinadp-me3基因在莖部具有較高的表達量;而在抽穗期,該基因在莖部中有較高的表達量;圖c和圖d分別為孕穗期和抽穗期的rt-pcr檢測結果:在孕穗期,sinadp-me3基因在莖部有較高的表達量,而在抽穗期,該基因在根部中有較高的表達量。總體來看,sinadp-me3基因在根和莖中都有較高的表達量。根系和莖是作為吸收和傳輸礦質元素水分等的主要組織,sinadp-me3基因大量表達可以調控其細胞的滲透勢、ph和離子吸收平衡等,在逆境脅迫時幫助植物體抵御逆境脅迫,提高植物抗逆性。序列表<110>中國農業科學院作物科學研究所<120>蛋白質sinadp-me3及其編碼基因在調控植物抗逆性中的應用<160>2<210>1<211>1731bp<212>dna<213>人工序列<220><223><400>1atgtcgtcggagatggagatggctggcggcggcgtcgaggacgcgtacggcgaggaccgc60gccaccgaggagcatctcgtcacgccgtgggccttctccgtcgccagcggctacaccctg120ctccgcgacccgcggcacaacaagggcctggccttctcggaggcggagcgcaacgcgcac180tacctgcgcggcctgctcccgcccgcgctggcgtcgcaggagctccaggagaagaagatc240atgcacaacctgcgccagtacacggtgcccctgcagcgctacatcgccatgatggacctg300caggagcgcaacgagcgtctcttctacaagctcctcatcgacaacgtcgaggagctgctc360cccgtcgtctacacgcccaccgtcggcgaggcgtgccagaagtacggcagcatctacagg420cgcccgcaggggctctacatcagcctcaaggacaagggcaagatccttgaggtgctcaag480aactggccggagaggagcatccaggtcatcgtcgtcaccgacggcgagcgcatcctgggg540ctcggggacctgggctgccaggggatggggatccccgttggcaagctgtctctctacacc600gccctcggaggcgttcgcccatccgcttgcctgccgatcacaatcgatgttggcaccaac660aacgagaccttgctcaacgacgagttctacattggcctccgccaaagacgtgccaccggc720caggaataccacgagcttctcgaagagttcatgaccgccgtcaagcaaaactacggcgag780aaagtcctaacccagttcgaggactttgccaaccacaatgcttttgacttgcttgccaag840tacagcaagagccatctcgtgttcaacgacgatatccagggaacagcctcggtggtcctc900gcaggtctcttggcggcgctcaaggtggtcggtggcactcttgctgaccacacctacctg960ttccttggtgccggcgaggctggaactggtattgctgacctcattgctcttgagatgtca1020aaacattcggagactccgatcgacgattgccgcaagaagatctggcttgtggactccaag1080ggcctgatcgtggagtcgcgcaaggagtcgctgcagcacttcaagcagccgtgggcgcac1140gatcacgagcccctcaagaccctgctggaggccgtggagtccatcaagccgacggtgctg1200atcggcacctccggcgtgggccgcaccttcaccaaggaggtggtggaggccatggcgtcc1260ttcaacgagaggcccgtcatcttcgcgctgtccaacccgacgtcgcactcggagtgcacg1320gcggaggaggcttacacctggtcccagggccgcgccgtgttcgccagcggcagccccttc1380gacgccgtcgagcacgaaggcaaggtgtacgtgccggggcagtccaacaacgcctacata1440ttccctgggttcggcctcggcgtggtcatctccggcgccatccgcgtccacgacgacatg1500ctgctggcggcgtcggaggcgctggcggagcaggtcaccgacgagcacttcgccaagggg1560ctcatcttcccgccgttcaccaacatccgcaccatctcggcgcgcatcgccgccaaggtg1620gccgaaaaggcctacgagctcggcctcgccagccgcctgccgcgccccgacgaccttgtc1680aagtacgcccagagctgcatgtacaccccaacctaccgcagctaccggtaa1731<210>2<211>576<212>prt<213>人工序列<220><223><400>2metserserglumetglumetalaglyglyglyvalgluaspalatyr151015glygluaspargalathrglugluhisleuvalthrprotrpalaphe202530servalalaserglytyrthrleuleuargaspproarghisasnlys354045glyleualapheserglualagluargasnalahistyrleuarggly505560leuleuproproalaleualaserglngluleuglnglulyslysile65707580methisasnleuargglntyrthrvalproleuglnargtyrileala859095metmetaspleuglngluargasngluargleuphetyrlysleuleu100105110ileaspasnvalglugluleuleuprovalvaltyrthrprothrval115120125glyglualacysglnlystyrglyseriletyrargargproglngly130135140leutyrileserleulysasplysglylysileleugluvalleulys145150155160asntrpprogluargserileglnvalilevalvalthraspglyglu165170175argileleuglyleuglyaspleuglycysglnglymetglyilepro180185190valglylysleuserleutyrthralaleuglyglyvalargproser195200205alacysleuproilethrileaspvalglythrasnasngluthrleu210215220leuasnaspgluphetyrileglyleuargglnargargalathrgly225230235240glnglutyrhisgluleuleuglugluphemetthralavallysgln245250255asntyrglyglulysvalleuthrglnphegluaspphealaasnhis260265270asnalapheaspleuleualalystyrserlysserhisleuvalphe275280285asnaspaspileglnglythralaservalvalleualaglyleuleu290295300alaalaleulysvalvalglyglythrleualaasphisthrtyrleu305310315320pheleuglyalaglyglualaglythrglyilealaaspleuileala325330335leuglumetserlyshissergluthrproileaspaspcysarglys340345350lysiletrpleuvalaspserlysglyleuilevalgluserarglys355360365gluserleuglnhisphelysglnprotrpalahisasphisglupro370375380leulysthrleuleuglualavalgluserilelysprothrvalleu385390395400ileglythrserglyvalglyargthrphethrlysgluvalvalglu405410415alametalaserpheasngluargprovalilephealaleuserasn420425430prothrserhisserglucysthralagluglualatyrthrtrpser435440445glnglyargalavalphealaserglyserpropheaspalavalglu450455460hisgluglylysvaltyrvalproglyglnserasnasnalatyrile465470475480pheproglypheglyleuglyvalvalileserglyalaileargval485490495hisaspaspmetleuleualaalaserglualaleualagluglnval500505510thraspgluhisphealalysglyleuilepheproprophethrasn515520525ileargthrileseralaargilealaalalysvalalaglulysala530535540tyrgluleuglyleualaserargleuproargproaspaspleuval545550555560lystyralaglnsercysmettyrthrprothrtyrargsertyrarg565570575當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種花狹口蛙的基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種澤陸蛙基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 蛋白質及其編碼基因在調控植物抗黃萎病性中的應用的制造方法與工藝
- 甘薯耐逆相關蛋白IbFBA2、編碼基因、重組載體與應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 蛋白質及其編碼基因在調控植物抗黃萎病性中的應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 核盤菌凝集素SSL?6蛋白及其編碼基因與應用的制造方法與工藝