胍基化殼聚糖衍生物以及納米粒的應用的制作方法
本發明涉及生物材料領域,且特別涉及一種胍基化殼聚糖衍生物以及納米粒的應用。
背景技術:
殼聚糖是自然界中廣泛存在的幾丁質經脫乙酰基得到的,具有無毒性、生物相容性和生物可降解性等許多優良的生物特性。目前研究發現殼聚糖在抑菌、藥物載體、基因載體等領域具有非常廣闊的前景。
胍基修飾的多種化合物被發現具有良好的抑菌活性,卡那霉素化合物上的氨基被胍基修飾之后,抑菌活性發生了明顯的增強。殼聚糖通過多種連接手臂偶聯胍基之后,抑菌活性均得到了不同程度的提升。
技術實現要素:
本發明的目的在于提供一種胍基化殼聚糖衍生物作為生物載體的應用,其生物活性高,抑菌效果佳,作為載體運送具有生物活性的生物因子時可實現控制生物因子在傷口的釋放速度。
本發明的另一目的在于提供一種胍基化殼聚糖包裹生物因子的納米粒在愈合傷口方面的應用,可有效保留的生物因子的生物活性以及穩定性,具有良好的促進傷口愈合活性以及傷口抑菌作用,使用安全,不會給皮膚帶來副作用。
本發明解決其技術問題是采用以下技術方案來實現的。
本發明提出胍基化殼聚糖衍生物作為生物載體的應用,其中,胍基化殼聚糖衍生物的化學結構式如下:
其中,r選自氫或鹵素中的任一種。
m與n為任一非零自然數。
本發明提出一種胍基化殼聚糖包裹生物因子的納米粒在愈合傷口方面的應用,其包括上述胍基化殼聚糖衍生物,以及生物因子,胍基化殼聚糖衍生物包裹生物因子。
本發明實施例的胍基化殼聚糖衍生物以及納米粒的應用的有益效果是:
胍基化殼聚糖衍生物,其活性高,抑菌效果佳,并且可作為載體運送具有生物活性的生物因子,同時實現控制釋放生物因子的速度。而生物因子的穩定性較差,但該納米粒的可有效保留的生物因子的生物活性以及穩定性,同時表現出良好的抑菌性以及促進傷口愈合,傷口平均在23天時完全愈合,27天時傷口處新形成的皮膚顏色接近于正常膚色,使用安全,不會給皮膚帶來副作用。
附圖說明
為了更清楚地說明本發明實施例的技術方案,下面將對實施例中所需要使用的附圖作簡單地介紹,應當理解,以下附圖僅示出了本發明的某些實施例,因此不應被看作是對范圍的限定,對于本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據這些附圖獲得其他相關的附圖。
圖1為本發明提供的胍基化殼聚糖包裹生物因子的納米粒的結構示意圖;
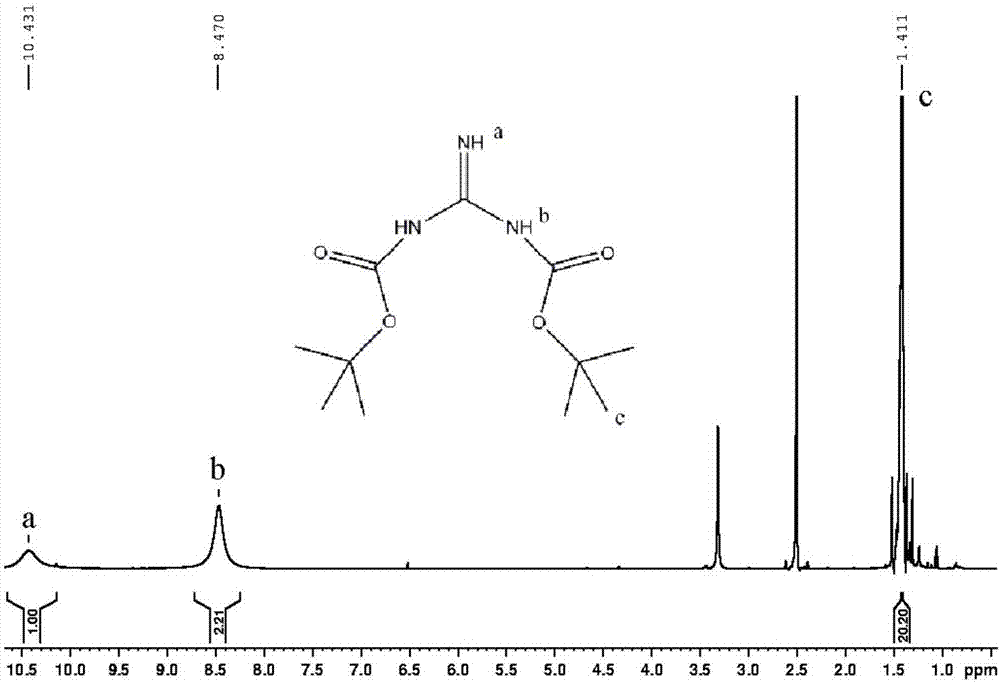
圖2為本發明實施例1和2提供的n,n’-二-boc胍的1hnmr譜圖及分子式;
圖3為本發明實施例1和2提供的n,n’-二-boc-n”-三氟甲基磺酰胍的1hnmr譜圖及分子式;
圖4為n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖的ftir譜圖及分子式;
圖5為n-胍基殼聚糖的ftir譜圖及分子式;
圖6為cg、cgnp1和cgnp2的掃描電子顯微鏡圖片。
具體實施方式
為使本發明實施例的目的、技術方案和優點更加清楚,下面將對本發明實施例中的技術方案進行清楚、完整地描述。實施例中未注明具體條件者,按照常規條件或制造商建議的條件進行。所用試劑或儀器未注明生產廠商者,均為可以通過市售購買獲得的常規產品。
下面對本發明實施例的胍基化殼聚糖衍生物以及納米粒的應用進行具體說明。
本發明提供胍基化殼聚糖衍生物作為生物載體的應用,該胍基化殼聚糖衍生物的化學結構式如下:
其中,r選自氫或鹵素中的任一種;例如,r為氫、氟、氯、溴或碘,在此不做限定。
其中,m與n為任一非零自然數,例如m/n=0.01、0.05、0.1、0.5、1、2、5、50或100等,其中m與n的比值不同,最終導致抑菌活性不同,本領域工作人員可根據實際的情況進行具體的m與n的比值選擇。
該胍基化殼聚糖衍生物作為載體,其活性高,抑菌效果佳,并且可作為載體運送具有生物活性的生物因子,同時還可以實現控制釋放生物因子的速度,使藥效最佳。
本發明中,胍基化殼聚糖衍生物由以下方法制備:
于有機試劑中將鹽酸胍與無機堿混合,加入氨基保護基團后反應,得第一胍基樣品;其中第一樣品中的n1和n2被氨基保護基保護。
優選地,無機堿混合后,于室溫下攪拌2~10min,使鹽酸胍與無機堿充分混合,提高反應效率。
優選地,加入氨基保護基團后升溫至30-60℃反應,更優選地,升溫至30~50℃反應,例如30℃、35℃、40℃、45℃或50℃,有效促進反應效率。
優選地,攪拌48~72h,更優選地,攪拌50~60h,加快反應速率,有效節省時間。
優選地,有機試劑為n,n-二甲基甲酰胺、二甲基亞砜或二氯甲烷,溶解度高,且不與其他試劑進行反應。
優選地,無機堿為naoh、koh、k2co3、na2co3或nahco3等,堿性適中,便于反應。
更優選地,氨基保護基為鄰苯二甲酰基、叔丁基氧羰基(boc)、笏甲氧羰基(fmoc),一方面便于前期保護氨基,另一方面便于后期脫除。
同時,利用薄層色譜(tlc)檢測反應直至反應完全,有效提高反應的成果轉化率,充分利用各原料。優選地,將反應完全得到的n1和n2被保護的第一胍基樣品的粗品經分離純化得到n1和n2被保護的第一胍基樣品,其純度高,便于后期加工。
將第一胍基樣品溶于極性有機溶劑后通過有機堿活化,預冷,加入磺酸酐磺化反應,得第二胍基樣品,其中第二胍基樣品中的n1和n2被保護。
其中,有機堿為三乙胺或吡啶,活化效率高。
由于磺酸酐酸性很強,常溫下反應極危險,因此必須于冷卻之后滴加,優選地,預冷至-40~-80℃,例如-40℃、-45℃、-50℃、60℃或-80℃。更優選地,預冷至-65~-80℃,例如-65℃、-70℃、-75℃或-80℃等。
由于溫度過低,磺化反應很慢,幾乎不能進行,因此需進行磺化反應前升溫,優選地,升溫至常溫條件下反應,更優選地,磺化反應2~10h,例如2h、3h、4h、5h、6h、7h、8h、9h或10h等,更優選地,磺化反應3~6h,優選地,tlc跟蹤點板檢測反應,直至完全反應,有效提高反應的成果轉化率,充分利用各原料。優選地,將磺化反應完成后得到的n1,n2和n3均被保護的胍基衍生物粗品經分離純化得到n1,n2和n3均被保護的胍基衍生物,其純度高,便于后期加工,有效提高最終產品的品質。
用極性有機溶劑溶解羥基保護的殼聚糖,并活化殼聚糖的胺基后,加入第二胍基樣品,優選于室溫的條件下反應,得胍基化殼聚糖樣品。
其中,通過堿活化殼聚糖的胺基,堿為吡啶、三乙胺、nahco3或na2co3,有效活化殼聚糖的胺基,提高殼聚糖與第二胍基樣品的反應效率。
最后,脫除胍基上的保護基和殼聚糖上的保護基,透析凍干,即得。其中,采用酸或堿脫除胍基和殼聚糖骨架上的保護基,本領域工作人員可根據實際情況選擇適宜的酸或堿,再此不做具體的限定。
優選地,胍基樣品磺化反應得到的產物進行鹵胺化反應,將鹵素引入,得第二胍基樣品。
更優選地,將胍基樣品磺化反應得到的產物與naclo溶液,例如ph=7的naclo溶液鹵胺化反應。
其中,ph=7的naclo溶液有以下方法制備:使用硫酸將naclo的水溶液調節至ph=7,加入第二胍基樣品后,使第二胍基樣品完全溶解并且產生較多的氣泡,接著在室溫的條件下磁力攪拌反應至少1h,反應完成之后用水稀釋體系,隨后透析2天,凍干得到第三胍基樣品。
本發明還提供一種胍基化殼聚糖包裹生物因子的納米粒在愈合傷口方面的應用,其中,胍基化殼聚糖包裹生物因子的納米粒的結構示意圖如圖1所示,其中,大球體代表的是胍基化殼聚糖制備的納米微粒,球中多種顏色不同的小球體代表的是各種不同種類和不同含量的生物因子。
該胍基化殼聚糖包裹生物因子的納米粒包括上述胍基化殼聚糖衍生物,以及生物因子,其中胍基化殼聚糖衍生物包裹生物因子。其中,上述胍基化殼聚糖可以將生物因子活性高,保留胍基殼聚糖衍生物良好的活性的同時,保護了負載生物因子的生物活性。
優選地,生物因子包括維生素c、維生素d、維生素e或胰島素中的至少一種,例如生物因子包括維生素c,或維生素d,或著生物因子包括維生素e和胰島素,或生物因子包括維生素c、維生素d、維生素e和胰島素等。
上述胍基化殼聚糖包裹生物因子納米粒由以下方法制備:將胍基化殼聚糖衍生物、生物因子于三聚磷酸鈉的催化作用下反應。雖然生物因子的穩定性較差,但通過該方法可有效保留的生物因子的生物活性以及穩定性,同時縮短制備時間。
優選地,該催化反應于0~30℃的條件下進行,優選攪拌30min~3h。有效提高反應效率。以下結合實施例對本發明的特征和性能作進一步的詳細描述。
實施例1
①n,n’-二-boc胍的制備
取干凈的三口燒瓶,稱量200mg的koh和265mg的na2co3放入燒瓶中,加50ml的dmso,室溫下攪拌均勻。稱量239mg鹽酸胍加入燒瓶,攪拌5min完全溶解。稱量1.528g(boc)2o加入燒瓶中,升溫到40℃,攪拌反應60h。反應完畢之后,用500ml的h2o分散,產生大量的白色固體,抽濾收集固體。硅膠柱層析得到n,n’-二-boc胍純品,其1hnmr譜圖及分子式如圖2所示。
②n,n’-二-boc-n”-三氟甲基磺酰胍的制備
稱量0.3g的n,n’-二-boc胍,用25ml的ch2cl2溶解,加168μl的三乙胺,放在單口燒瓶中,預冷到-78℃。量取203μl的三氟甲基磺酸酐,用25ml的ch2cl2溶解,在-78℃條件下用恒壓低液漏斗滴加到單口燒瓶中,用時約1h,體系變成淡紅色。滴完之后取出,室溫下攪拌反應4h,反應完畢之后,停止攪拌,用2mol/l的nahso4水溶液洗滌ch2cl2相兩次,每次20ml,再用超純水洗滌兩次,每次20ml。洗完之后的體系的ch2cl2溶液用無水na2so4干燥過夜,抽濾得到含n,n’-二-boc-n”-三氟甲基磺酸胍的體系,硅膠柱層析得到純品,其1hnmr譜圖及分子式如圖3所示。
③n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖的制備
稱量1g的3,6-o-二-叔丁基二甲基硅-殼聚糖加入單口燒瓶中,再加50ml的ch2cl2作為溶劑,量取2.15ml的三乙胺加入體系中,攪拌混勻。稱量1.02g的n,n’-二-boc-n”-三氟甲基磺酰胍加入燒杯中,室溫下攪拌均勻,并室溫攪拌48h。反應完畢之后,用超純水透析,然后凍干得到淺黃色固體,其ftir譜圖及分子式如圖4所示。
④n-胍基殼聚糖(cg)的制備
稱量0.5g的n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖放入單口燒瓶中,加100ml甲醇攪拌混勻,預冷到0℃。量取13.4ml的hcl,用恒壓滴液漏斗滴加到單口燒瓶中,用時30min。滴加完畢之后,撤掉冰水浴,恢復到室溫反應48h。反應完之后,用1mol/l的naoh水溶液調節ph值到6,然后用超純水透析并且凍干,得到白色固體產物,其ftir譜圖及分子式如圖5所示。
⑤cg包裹生物活性因子納米粒(cgnp)的制備。
稱量0.1g的cg用100ml的水溶解,加入生物活性因子。稱取少量的tpp,用水溶解至10mg/ml,然后用恒壓滴液漏斗滴加13.3ml的tpp到體系中,室溫下攪拌反應1h。用0.22μm的水相濾膜過濾,用超純水透析之后凍干得到cgnp。具體地,通過控制添加的生物活性因子的量不同,制備cgnp1和cgnp2。cg、cgnp1和cgnp2的掃描電子顯微鏡圖片如圖6所示。根據圖6,可明顯看出,cgnp1和cgnp2因負載有生物活性因子,顆粒變大,并且相容性佳。
實施例2
①n,n’-二-boc胍的制備
取干凈的三口燒瓶,稱量200mg的koh和265mg的na2co3放入燒瓶中,加50ml的dmso,室溫下攪拌均勻。稱量239mg的鹽酸胍加入燒瓶,攪拌5min完全溶解。稱量1.528g的(boc)2o加入燒瓶中,升溫到40℃,攪拌反應60h。反應完畢之后,用500ml的h2o分散,產生大量的白色固體,抽濾收集固體。硅膠柱層析得到n,n’-二-boc胍純品,其1hnmr譜圖及分子式如圖1所示。
②n,n’-二-boc-n”-三氟甲基磺酰胍的制備
稱量0.3g的n,n’-二-boc胍,用25ml的ch2cl2溶解,加168μl的三乙胺,放在單口燒瓶中,預冷到-78℃。量取203μl的三氟甲基磺酸酐,用25ml的ch2cl2溶解,在-78℃條件下用恒壓低液漏斗滴加到單口燒瓶中,用時約1h,體系變成淡紅色。滴完之后取出,室溫下攪拌反應4h,反應完畢之后,停止攪拌,用2mol/l的nahso4水溶液洗滌ch2cl2相兩次,每次20ml,再用超純水洗滌兩次,每次20ml。洗完之后的體系的ch2cl2溶液用無水na2so4干燥過夜,抽濾得到含n,n’-二-boc-n”-三氟甲基磺酸胍的體系,硅膠柱層析得到純品,其1hnmr譜圖及分子式如圖2所示。
③n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖的制備
稱量1g的3,6-o-二-叔丁基二甲基硅-殼聚糖加入單口燒瓶中,再加50mlch2cl2作為溶劑,量取2.15的ml三乙胺加入體系中,攪拌混勻。稱量1.02g的n,n’-二-boc-n”-三氟甲基磺酰胍加入燒杯中,室溫下攪拌均勻,并室溫攪拌48h。反應完畢之后,用超純水透析,然后凍干得到淺黃色固體,其ftir譜圖及分子式如圖3所示。
④n-鹵胺-n’-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖的制備
取干凈的單口燒瓶,加入0.5g的n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖;配置naclo水溶液,并以并以1n的硫酸溶液調節naclo水溶液ph為7;取30ml配制好的naclo水溶液倒入燒瓶中,n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖完全溶解并且產生較多的氣泡,在室溫的條件下磁力攪拌反應1h,反應完之后用水稀釋體系,使n-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖的質量濃度為5%。隨后透析2天,凍干得到第三胍基樣品,即n-鹵胺-n’-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖。
⑤n-鹵胺胍基化殼聚糖衍生物的制備
稱量0.5g的n-鹵胺-n’-(n,n’-二-boc胍基)-3,6-o-二-叔丁基二甲基硅-殼聚糖放入單口燒瓶中,加100ml甲醇攪拌混勻,預冷到0℃。量取13.4ml的hcl,用恒壓滴液漏斗滴加到單口燒瓶中,用時30min。滴加完畢之后,撤掉冰水浴,恢復到室溫反應48h。反應完之后,用1mol/l的naoh水溶液調節ph值到6,然后用超純水透析并且凍干,得到n-鹵胺胍基化殼聚糖衍生物。
⑥n-鹵胺胍基化殼聚糖衍生物包裹生物活性因子納米粒的制備。
稱量0.1g的n-鹵胺胍基化殼聚糖衍生物用100ml的水溶解,加入適宜的生物活性因子。稱取少量的tpp,用水溶解至10mg/ml,然后用恒壓滴液漏斗滴加13.3mltpp到體系中,室溫下攪拌反應1h。用0.22μm的水相濾膜過濾,用超純水透析之后凍干得到納米粒。
實施例3
一種促進傷口愈合的敷料,其包括實施例1和/或實施例2制得的胍基化殼聚糖包裹生物因子的納米粒。
試驗例
wistar大鼠傷口愈合實驗
在手術當天,先用舒泰和速眠新麻醉大鼠,待大鼠完全昏迷,用剃毛器將背部即將進行手術的部位的毛全部剃掉,放在手術臺上,用碘伏擦拭背部裸露的皮膚。在距離大鼠脊柱1cm處左右分別設置2個傷口,傷口大小分別為1cm×1cm,傷口深度達到真皮層。大鼠左側傷口不加任何藥物,作為對照組,右側傷口加樣品,作為實驗組。將大鼠編號1-6。其中,1號和2號為殼聚糖組,3號和4號為cgnp1組,5號和6號為cgnp2組。為了防止大鼠對傷口的撕咬,用醫用紗布包裹傷口,并且定期更換。在術后定期取下紗布,對大鼠的傷口進行拍照,并測量傷口的大小。實驗期間每只大鼠放在一個籠子里,保持動物房的溫度在25±2℃。
3、4、5、6號大鼠的傷口平均在23天時完全愈合,27天時傷口處新形成的皮膚顏色接近于正常膚色,愈合速度顯著高于殼聚糖組。
采用包括實施例2提供的納米粒進行傷口處理,相比于殼聚糖組同樣得到有效促進傷口愈合的試驗結果,因此,可毫無異議的推出實施例3提供的輔料相比于殼聚糖組同樣得到有效促進傷口愈合。
綜上,本發明實施例的胍基化殼聚糖衍生物、納米粒及其制備方法,本發明制備的胍基化殼聚糖結構簡單,反應周期短,并且抑菌活性較好,在經過納米粒制備之后負載活性因子,具有良好的生物活性。
以上所描述的實施例是本發明一部分實施例,而不是全部的實施例。本發明的實施例的詳細描述并非旨在限制要求保護的本發明的范圍,而是僅僅表示本發明的選定實施例。基于本發明中的實施例,本領域普通技術人員在沒有作出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!