一種抗CD24人源化抗體融合蛋白的制作方法
本發明屬于生物工程領域,具體涉及一種新的可同時與白細胞分化抗原cd24(clusterofdifferentiation24)和nkg2d受體特異性結合的cd24人源化抗體融合蛋白hg7-mica,其利用hg7的靶向性將mica特異性地展示于腫瘤細胞表面,增強nk細胞對人乳腺癌細胞的抗體依賴性的細胞介導的細胞毒作用(adcc),避免了由于細胞表面mica分子表達下調與脫落引起的腫瘤免疫逃逸。hg7-mica的設計開辟了一種新的腫瘤免疫治療策略,是一種特異性重塑nk細胞對cd24+腫瘤細胞免疫監視功能的雙功能抗體融合蛋白。
背景技術:
當今全球惡性腫瘤發病率及死亡率一直呈上升趨勢。腫瘤免疫逃逸是指腫瘤細胞表面標記物脫落導致其逃脫免疫監視,這也是放化療法常產生耐藥和低安全性評價的瓶頸所在。因此,尋找特異性的分子靶標與新穎的臨床用藥手段是腫瘤個性化治療的關鍵。腫瘤免疫治療旨在重塑機體自身免疫系統對腫瘤細胞的識別與殺傷能力,利用“生物導彈”將機體中天然存在的免疫細胞這種彈藥特異性地募集至腫瘤病灶部位,該策略具有高特異性與低副作用的優勢。
腫瘤相關性抗原mica
mica(mica,majorhistocompatibilitycomplexclassichain-relatedgenea)是一種高度糖基化的蛋白質分子,屬于非經典hla-i(humanleucocyteantigen-i)類基因家族。mica廣泛且特異性地表達于上皮來源的原發性腫瘤細胞中,是一種公認的腫瘤相關性抗原。nk細胞或cd8+t細胞借表面受體nkg2d與配體mica/b的相互作用而與腫瘤細胞靠近、結合,進而通過釋放細胞因子等誘導腫瘤細胞的溶解。雖然證實mica分子表達于多種腫瘤細胞表面,但mica的脫落導致腫瘤細胞雖然仍屬于mica陽性,但卻能避開免疫監視并導致免疫逃逸。因此尋找一種新的展示方式以重塑mica在腫瘤免疫監視中的作用成為腫瘤免疫治療策略的關鍵,抗體是激活和重建機體腫瘤免疫作用的一種常規靶向藥物,其中單鏈抗體由于其分子量小更容易通過血腦屏障到達病灶部位而更多地用于此類靶向設計。由此我們提出一種假設:將mica分子與抗體融合,借助于靶向腫瘤細胞表面抗原的抗體對腫瘤細胞的識別和結合,mica被錨定于腫瘤細胞表面;進一步通過mica與nkg2d的結合刺激nk細胞殺傷腫瘤細胞,重建由nkg2d途徑激活機體自身的免疫監視作用。
nkg2d分子是c型凝集素樣受體家族的一種同源二聚體ii型跨膜蛋白。在腫瘤的生長進程中,mica等配體下調或蛋白水解脫落會抑制nk細胞介導的免疫調控,而誘導nkg2d的配體在腫瘤細胞表面的表達會使腫瘤細胞更容易被nk細胞識別和殺傷。nkg2d通路活化效應細胞的分子機制:nkg2d與其配體結合,輔以接頭蛋白分子dap10或dap12的幫助,激活下游信號通路,最終活化nk細胞。
腫瘤標志物cd24分子
經文獻調研發現白細胞分化抗原cd24(clusterofdifferentiation24)作為一種潛在的致癌因子,在結直腸癌、乳腺癌、肝癌、小細胞肺癌等多種腫瘤組織中過表達,而在正常組織中不表達或低表達。基于cd24分子腫瘤細胞標記物的特點,我們提出cd24抗體作為有效的載體連接mica分子,激活nkg2d途徑,重塑nk細胞的免疫監視作用。科學家致力于該類型靶點設計抗體融合蛋白,這些腫瘤表面抗原都具有與cd24相同的特點:1.腫瘤細胞表面高表達;2.正常組織細胞表面不表達或低水平表達。
免疫細胞天然配體和抗體的融合蛋白
目前已經有很多針對抗體融合蛋白的開發,其設計方式為:1.利用靶向cd138、cea的單鏈抗體連接nkg2d配體效應分子制備“生物導彈”,有效募集nk細胞至腫瘤病灶部位,殺傷腫瘤細胞;2.利用cd20單鏈抗體連接mica設計抗體融合蛋白,以有效治療淋巴瘤;3.采用化學偶聯的方式將靶向cd20單抗的fab片段與mica相連,有效增強nk細胞對cd20陽性腫瘤細胞的識別與殺傷作用。至今鮮有nkg2d配體mica分子相關融合蛋白的報道。
通過自主研發的cd24人源化抗體與mica分子相連接,構建成融合蛋白,可以顯著加強nk細胞得免疫監視作用。nk細胞在腫瘤免疫監視中起到關鍵性作用,nk細胞的激活取決于其表面的nkg2d等活化性受體。陽性表達cd107a分子是具有殺傷活性nk細胞的標記物。nk細胞主要的活化性受體包括nkg2d、fcγriiia和天然細胞毒受體(ncrs),免疫配體募集并激活nk細胞的效應功能,活化后的nk細胞通過釋放穿孔素和顆粒酶,同時分泌細胞因子ifn-γ和tnf-α來調節效應細胞功能。因此,nk細胞在特異性殺傷腫瘤細胞的新型治療手段中成為了一個很有前景的武器。
基于上述理論基礎與科研實踐,本發明將已具有自主知識產權的抗cd24人源化抗體hg7與mica通過柔性肽連接,設計一種新型重組蛋白hg7-mica。hg7-mica的設計開辟了一種新的腫瘤免疫治療策略。該研究一方面重塑nkg2d途徑誘導的nk細胞免疫監視,通過激活機體自身免疫功能有效殺傷腫瘤;另一方面該治療方案發揮靶向性優勢,有效降低化放療藥物產生的毒副作用,在臨床前研究與臨床安全性評價中將會占據制高點。因此,具有自主知識產權的融合蛋白hg7-mica的開發,為腫瘤免疫治療體系提供新穎的臨床用藥方案。
技術實現要素:
發明目的
本發明提供一種具有抗腫瘤免疫療效的cd24抗體融合蛋白hg7-mica。本發明抗體融合蛋白的特征為g4s柔性肽linker連接cd24人源化抗體hg7與mica分子,保留了二者原有的親本活性;哺乳動物細胞表達系統進行蛋白表達,保證融合蛋白的生物活性;利用hg7的靶向性將mica特異性地展示于cd24+肝癌細胞huh-7表面,避免了由于細胞表面mica分子表達下調與脫落引起的腫瘤免疫逃逸;激活nk細胞并誘導其分泌ifn-γ、tnf-α等細胞因子,重塑nk細胞對腫瘤細胞的免疫監視功能;體內外抑制肝癌細胞huh-7的生長。
技術方案
一種cd24抗體融合蛋白,該融合蛋白以自主研發的序列全新的抗cd24人源化抗體hg7與人源mica分子為基礎,運用基因重組等手段,構建成雙功能抗體融合蛋白hg7-mica。
其中一條鏈由人源化抗體hg7重鏈和mica蛋白組成,其氨基酸序列表為seqno.1;另一條鏈為hg7輕鏈,其氨基酸序列表為seqno.2。
一種哺乳動物細胞cho-s分泌表達法,用于分泌表達cd24抗體融合蛋白hg7-mica。
一種表達載體,含有cd24抗體融合蛋白hg7-mica目的基因的核酸分子。
一種重組宿主細胞,含有上述的表達載體。
cd24抗體融合蛋白hg7-mica的應用方式:hg7人源化抗體發揮靶向性作用將mica分子特異性地展示于cd24高表達的腫瘤細胞表面,通過mica半分子選擇性地與nk細胞表面的nkg2d受體結合,提高機體微環境中nk細胞的靶向識別能力與殺傷作用。
cd24抗體融合蛋白hg7-mica在治療腫瘤藥物中的應用。
發明進一步說明:
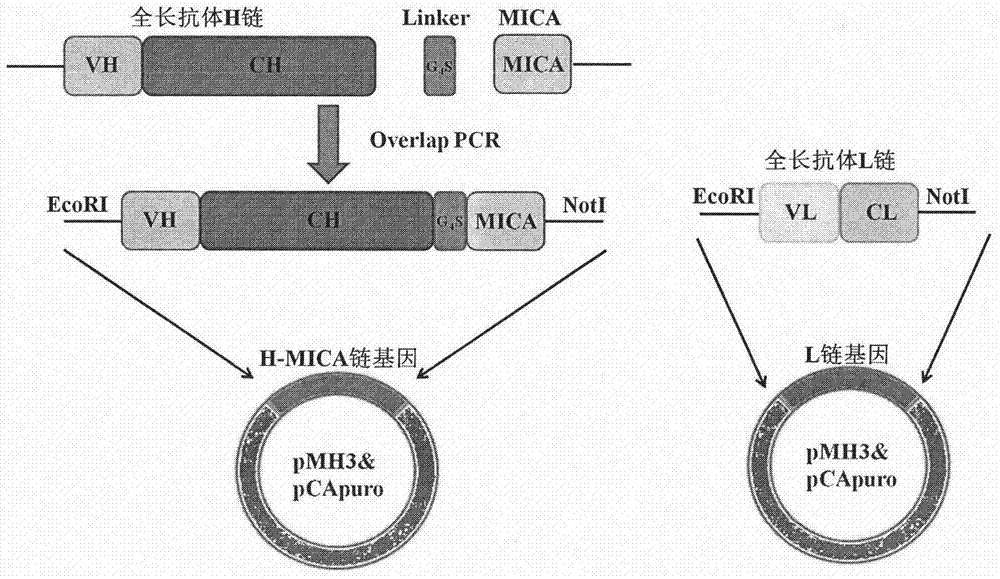
本發明中靶向cd24的抗體融合蛋白由兩條鏈組成,其中一條鏈由全長抗體和mica蛋白通過柔性肽(ggggs)連接,另一條是全長抗體的輕鏈。
本發明的一個目的是構建cd24抗體融合蛋白hg7-mica的表達載體,篩選該抗體融合蛋白高表達的工程細胞株,提供一種可以穩定高表達和批量純化上述cd24抗體融合蛋白hg7-mica的方法;本發明的另一個目的是建立cd24抗體融合蛋白hg7-mica的體內外藥效評價體系,評估腫瘤免疫治療方案的可行性。
本發明利用overlappcr(polymerasechainreaction)技術將本實驗室改造獲得的cd24人源化抗體與人源mica胞外1-3區基因輔以柔性肽g4s相連接,進行克隆重組,構建抗體融合蛋白hg7-mica重組載體,通過電穿孔法穩定轉染cho-s細胞,經兩輪g418加壓篩選獲得正確表達hg7-mica的穩定工程細胞株;使用proteina親和層析柱分離純化目的蛋白,sds-page檢測純化產物為電泳純,westernblot鑒定表達產物表達及裝配正確;spr實驗分析抗體與抗原的親和能力。
附圖說明
圖1是融合蛋白基因重組分析圖,重組基因包括重鏈基因大小為2312bp、輕鏈基因大小約為764bp。
圖2是融合蛋白的結構示意圖,該蛋白由兩條鏈組成,其中cd24抗體的ch區和mica蛋白通過柔性肽(ggggs)連接,而重鏈與輕鏈及重鏈是在表達細胞中自行通過二硫鍵結合組裝在一起。
圖3是抗體融合蛋白hg7-mica重鏈基因的構建鑒定圖。已獲得hg7的基因序列,我們以此為基礎構建抗體融合蛋白hg7-mica。在hg7重鏈h的3’端引入hmica序列,獲得新的重鏈h-mica。“h-mica”是overlappcr反應擴增hg7-mica的重鏈h-mica目的基因,“h”是pcr反應擴增hg7的重鏈,“mica”是hmica基因片段。
具體實施方式
實施例1cd24抗體融合蛋白hg7-mica的構建
分別以hg7重輕鏈基因,mica基因及pcapuro、pmh3質粒為模板,設計并合成引物進行pcr擴增。融合蛋白hg7-mica的構建以hg7重鏈基因h為基礎,再進行重疊pcr延伸擴增獲得完整的h-mica基因。pcr產物用1.0%瓊脂糖凝膠電泳檢測,瓊脂糖凝膠回收試劑盒回收目的基因。pcr擴增終產物及質粒pcapuro、pmh3用限制性內切酶進行雙酶切,酶切產物切膠回收后,用t4連接酶16℃過夜連接。連接后轉化大腸桿菌dh5α感受態,涂布平板,次日挑取單克隆雙酶切及測序鑒定。
- 還沒有人留言評論。精彩留言會獲得點贊!