一種生物活性多肽TIASGEPT及其制備方法和應用與流程
本發明涉及蛋白領域,尤其是涉及一種生物活性多肽tiasgept及其制備方法和應用。
背景技術:
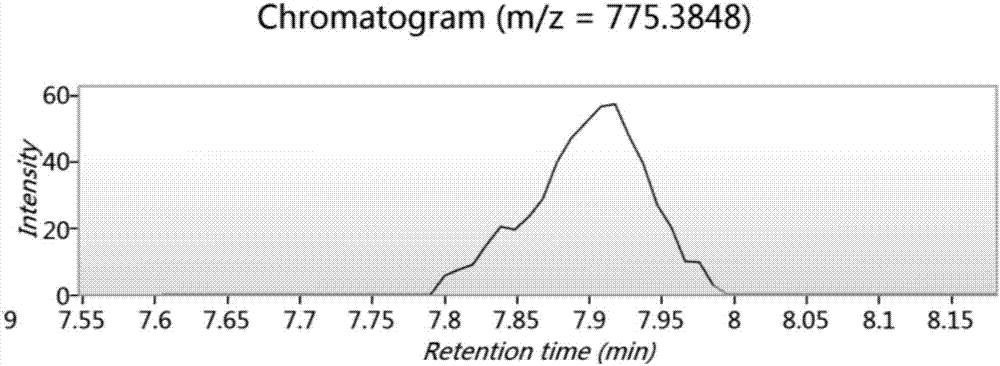
:在牛乳經乳酸菌發酵的過程中,牛乳中的一部分蛋白質被乳酸菌代謝利用,并發生了一系列生理生化反應,使蛋白質變為多肽或者游離的氨基酸,被人體消化吸收或通過小腸上皮細胞的吸收轉運直接進入人體的血液循環。在這些多肽中,有一部分具有特殊的生理功能,被稱為“生物活性肽”。氧化反應和氧化代謝對于食物和人體來說都是至關重要的,自由基和活性氧引起了一系列的氧化反應。當過量的自由基形成,它們會超過保護性酶如超氧化物歧化酶、過氧化氫酶的保護作用,從而導致脂質氧化、細胞凋亡等一系列的副作用產生。這一類的氧化反應,不僅影響含脂食物的保質期,也對人體的健康造成了一定的危害,如風濕性關節炎、糖尿病、動脈硬化等。此外,collins等人2005年研究發現癌癥的發生也與dna的氧化損傷有關。早期一些人工合成的抗氧化劑如丁基羥基茴香醚(bha)、2,6-二叔丁基-4-甲基苯酚(bht)被運用到食品中,作為脂質的抗氧化劑,但這些人工合成的添加劑對于人體都有潛在的風險。因此,在天然食物來源中尋找安全的抗氧化劑尤為重要。近些年來,人們發現一些食物來源的多肽類物質具有良好的抗氧化作用,如玉米短肽、大豆肽、牛乳多肽等。這些多肽可以通過微生物發酵、消化酶解等多種途徑得到,并且大多具有抗氧化活性的多肽是由2~20個氨基酸殘基組成,分子量小于6000da,含有一定量的疏水氨基酸、芳香族氨基酸。免疫活性肽是繼阿片肽發現后首次從乳中獲得并證明其生理活性的一類生物活性多肽。1981年jolles等人首次發現,利用胰蛋白酶水解人乳蛋白,可以得到一個氨基酸序列為val-glu-pro-ile-pro-tyr的六肽,體外實驗證明該肽能夠增強小鼠腹腔巨噬細胞對綿羊紅細胞的吞噬作用。migliore-samour等人發現來自酪蛋白的六肽thr-thr-met-pro-leu-trp能夠刺激綿羊血紅細胞對小鼠腹膜巨噬細胞的吞噬作用以及增強對于肺炎克雷伯菌的抵抗。李素萍等人用合成的乳源免疫調節肽(pgpipn)飼喂大鼠發現大鼠腹腔巨噬細胞的吞噬作用和紅細胞相關的免疫調節功能有顯著的增強。研究表明,免疫活性肽不僅能夠增強機體免疫力,刺激機體淋巴細胞的增殖,增強巨噬細胞的吞噬功能,促進細胞因子的釋放、提高機體抵御外界病原體感染的能力,降低機體發病率,而且不會引起機體的免疫排斥反應。目前關于生物活性多肽的研究有很多,比如中國專利cn105254738a公布了一種來源于β-酪蛋白的乳源性生物活性多肽delqdkih,中國專利cn105254739a公布了一種來源于αs1-酪蛋白的乳源性生物活性多肽gtqytd,中國專利cn105254740a公布了一種來源于αs2-酪蛋白的乳源性生物活性多肽nqfyqkf。技術實現要素:本發明的目的在于提供一種生物活性多肽tiasgept及其制備方法和應用。本發明的目的可以通過以下技術方案來實現:本發明第一方面,提供一種生物活性多肽tiasgept,其氨基酸序列為thr-ile-ala-ser-gly-glu-pro-thr,如seqidno:1所示。較優的,所述生物活性多肽為乳源性。具體來源于κ-酪蛋白,并且為κ-酪蛋白變體a第145~152位的氨基酸殘基。κ-酪蛋白變體a氨基酸序列如seqidno:3所示。κ-酪蛋白的氨基酸序列以及對應的核苷酸序列為既有技術,編碼κ-酪蛋白變體a第145~152位氨基酸殘基的核苷酸片段能編碼成熟的生物活性多肽tiasgept。較優的,所述生物活性多肽具有抗氧化功能和免疫調節功能。本發明第二方面,提供了編碼所述生物活性多肽tiasgept的核苷酸片段,其序列為:5’-accattgctagtggcgagcctaca-3’,如seqidno:2所示。本發明第三方面,提供了所述生物活性多肽tiasgept的制備方法,可以通過基因工程的方法人工合成,可以從乳制品中通過分離純化的方法直接獲得,可以直接通過化學合成制備。本發明第四方面,提供了所述生物活性多肽tiasgept在制備具有抗氧化功能的食品、保健品、藥物或化妝品中的應用。本發明第五方面,提供了所述生物活性多肽tiasgept在制備具有免疫調節功能的食品、保健品或藥物中的應用。本發明第六方面,提供了所述生物活性多肽tiasgept在制備同時具有抗氧化功能和免疫調節功能的食品、保健品或藥物中的應用。具體而言,本發明的生物活性多肽tiasgept可以用于制備減少自由基對皮膚傷害的化妝品、制備具有抗氧化和/或調節機體免疫力的藥物;并且由于本發明的生物活性多肽tiasgept通過胃腸道降解后的產物仍舊具有生物活性,因此還可以用于制備酸奶等食品、調節免疫力的保健品,以及口服的用于制備具有抗氧化和/或調節機體免疫力的藥物。本發明第七方面,提供了一種抗氧化產品,包括所述生物活性多肽tiasgept或所述生物活性多肽tiasgept的衍生物;所述的抗氧化產品包括抗氧化食品、抗氧化保健品、抗氧化藥物或抗氧化化妝品;所述生物活性多肽tiasgept的衍生物,是指在生物活性多肽tiasgept的氨基酸側鏈基團上、氨基端或羧基端進行羥基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修飾,得到的多肽衍生物。本發明第八方面,提供了一種免疫調節產品,包括所述生物活性多肽tiasgept或所述生物活性多肽tiasgept的衍生物;所述的免疫調節產品包括免疫調節食品、免疫調節保健品或免疫調節藥物;所述生物活性多肽tiasgept的衍生物,是指在生物活性多肽tiasgept的氨基酸側鏈基團上、氨基端或羧基端進行羥基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修飾,得到的多肽衍生物。本發明第九方面,提供了一種同時具有抗氧化功能和免疫調節功能的產品,包括所述生物活性多肽tiasgept或所述生物活性多肽tiasgept的衍生物;具有抗氧化功能和免疫調節功能的產品包括食品、保健品或藥物;所述生物活性多肽tiasgept的衍生物,是指在生物活性多肽tiasgept的氨基酸側鏈基團上、氨基端或羧基端進行羥基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修飾,得到的多肽衍生物。本發明生物活性多肽tiasgept的有益效果為:本發明的乳源性生物活性多肽tiasgept具有較好的抗氧化活性和調節機體免疫力活性;一方面能夠清除機體內的自由基,減少自由基對人體的傷害;另一方面,本發明的生物活性多肽tiasgept還能夠調節機體免疫力,增強淋巴細胞的增殖能力,提高機體抵御外界病原體感染的能力,降低機體發病率,而且不會引起機體的免疫排斥反應,對開發具有抗氧化功能及調節免疫功能的乳制品和保健品具有十分重要的意義。附圖說明圖1:質量色譜提取圖(m/z=775.38);圖2:質荷比為775.38的片段的一級質譜圖;圖3:質荷比為775.38的多肽az、by斷裂情況;圖4:[dpph·]甲醇標準曲線;圖5:feso4標準曲線。具體實施方式在進一步描述本發明具體實施方案之前,應理解,本發明的保護范圍不局限于下述特定的具體實施方案;還應當理解,本發明實施例中使用的術語是為了描述特定的具體實施方案,而不是為了限制本發明的保護范圍。當實施例給出數值范圍時,應理解,除非本發明另有說明,每個數值范圍的兩個端點以及兩個端點之間任何一個數值均可選用。除非另外定義,本發明中使用的所有技術和科學術語與本
技術領域:
技術人員通常理解的意義相同。除實施例中使用的具體方法、設備、材料外,根據本
技術領域:
的技術人員對現有技術的掌握及本發明的記載,還可以使用與本發明實施例中所述的方法、設備、材料相似或等同的現有技術的任何方法、設備和材料來實現本發明。除非另外說明,本發明中所公開的實驗方法、檢測方法、制備方法均采用本
技術領域:
常規的分子生物學、生物化學、染色質結構和分析、分析化學、細胞培養、重組dna技術及相關領域的常規技術。這些技術在現有文獻中已有完善說明,具體可參見sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。下面結合附圖和具體實施例對本發明進行詳細說明。實施例1活性肽tiasgept的人工合成一、生物活性肽的合成1.稱取rink樹脂3g(取代度0.3mmol/g)于150ml的反應器中,用50ml的二氯甲烷(dcm)浸泡。2.2小時后,用3倍樹脂體積的氮-二甲基甲酰胺(dmf)洗滌樹脂,然后抽干,如此重復四次,將樹脂抽干后待用。3.向反應器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脫色搖床上搖晃20min,以此來脫去樹脂上的fmoc保護基團。脫完保護后用3倍樹脂體積的dmf洗滌四次,然后抽干。4.取少量樹脂用茚三酮(九井水合茚三酮)法檢測(檢a、檢b各兩滴,100℃反應1min),樹脂有顏色,說明脫保護成功。5.稱取氨基酸thr適量和1-羥基-苯駢三唑(hobt)適量于50ml的離心管中,加入20ml的dmf將其溶解,然后加入3ml的n,n二異丙基碳二亞胺(dic)振蕩搖勻1min,待溶液澄清后加入到反應器中,然后將反應器置于30℃的搖床中反應。6.2小時后,用一定量的醋酸酐封頭(醋酸酐:diea:dcm=1:1:2,v:v:v)半小時,然后用3倍樹脂體積的dmf洗滌四次,抽干待用。7.向反應器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脫色搖床上搖晃20min,以此來脫去樹脂上的fmoc保護基團。脫完保護后用dmf洗滌四次,然后抽干。8.取少量樹脂用茚三酮(九井水合茚三酮)法檢測(檢a、檢b各兩滴,100℃反應1min),樹脂有顏色,說明脫保護成功。9.稱取后面第二個氨基酸適量和hobt適量于50ml的離心管中,加入25ml的dmf將其溶解,然后加入2.5ml的dic振蕩搖勻1min,待溶液澄清后加入到反應器中,然后將反應器置于30℃的搖床中反應。10.1小時后,取少量樹脂檢測,用茚三酮法檢測(檢a、檢b各兩滴,100℃反應1min),若樹脂為無色,說明反應完全;若樹脂有顏色,說明縮合不完全,繼續反應。11.待反應完全后,用dmf洗滌樹脂四次,然后抽干,向反應器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脫色搖床上搖晃20min,以此來脫去樹脂上的fmoc保護基團。脫完保護后用dmf洗滌四次,然后抽干檢測保護是否脫去。12.按照步驟9-11依次接上氨基酸ile、ala、ser、gly、glu、pro和thr。13.待接上最后一個氨基酸后,脫去保護,用dmf洗滌四次,然后用甲醇將樹脂抽干。然后用95切割液(三氟乙酸:1,2乙二硫醇:3,異丙基硅烷:水=95:2:2:1,v:v:v)將多肽從樹脂上切割下來(每克樹脂加10ml切割液),并用冰乙醚(切割液:乙醚=1:9,v:v)離心沉降四次。至此,人工合成了生物活性肽tiasgept。以上步驟5、步驟9中所述的適量是指根據目標合成量和得率計算出一個理論用量,在理論用量基礎上乘以一個系數(本實施例中為1.1),最后得到的實際用量。由于每次目標肽的合成量不同,而且得率也不同,所以每次稱取的氨基酸的量也就不同。例如目標肽的合成量是10克,合成肽的得率(回收率)為90%,那么氨基酸的理論稱取量的計算公式為:氨基酸的理論稱取量=10克*氨基酸分子量/目標肽分子量/90%.這樣計算出來的結果是氨基酸的理論稱取量,在實際合成過程中為了保證得到10克的多肽,氨基酸要多稱取一點,實際操作時氨基酸稱取量一般都是理論稱取量的1.1倍。同理,1-羥基-苯駢三唑(hobt)作為多肽合成過程中的一個中介物,也是理論稱取量的1.1倍。由于生物活性肽合成過程中所用氨基酸以及1-羥基-苯駢三唑(hobt)的理論用量是本領域技術人員根據目標合成肽的需求量能夠計算得到的,因此,實際操作時,在理論用量的基礎上乘以一個系數就能夠合成出目標肽,在參照本實施例的合成步驟以及合成工藝條件基礎上,根據本領域技術人員的常規知識就能夠合成得到本實施例中的生物活性肽。二、生物活性肽的確認1)uplc分析uplc條件如下:儀器:watersacquityuplc超高效液相-電噴霧-四級桿-飛行時間質譜儀色譜柱規格:behc18色譜柱流速:0.4ml/min溫度:50℃紫外檢測波長:210nm進樣量:2μl梯度條件:a液:含有0.1%甲酸(v/v)的水,b液:含有0.1%甲酸(v/v)的乙腈2)質譜分析質譜條件如下:離子方式:es+質量范圍(m/z):100-1000毛細管電壓(capillary)(kv):3.0采樣錐(v):35.0離子源溫度(℃):115去溶劑溫度(℃):350去溶劑氣流(l/hr):700.0碰撞能量(ev):4.0掃描時間(sec):0.25內掃描時間(sec):0.02根據以上分析方法,利用超高效液相-電噴霧-四級桿-飛行時間質譜,對生物活性肽tiasgept進行色譜分析和質譜分析,其質量色譜提取圖如圖1所示,提取此峰的一級和二級質譜圖如圖2和3所示,可得此峰的多肽質荷比為775.38da,保留時間是7.89min。3)結果由圖3可知,根據az、by斷裂的情況,經過progenesisqi軟件分析計算,得到質荷比775.38da的片段序列為thr-ile-ala-ser-gly-glu-pro-thr(tiasgept),記為seqidno:1。該片段與κ-酪蛋白變體a第142~152位的殘基序列相對應,κ-酪蛋白氨基酸序列的genbank編號為aaa30433.1,序列見seqidno:3。實施例2生物活性肽的抗氧化活性實驗采用清除自由基法(dpph·法)和總抗氧化能力法(ferricreducingabilitypowerfrap法),對實施例1得到的生物活性多肽tiasgept的抗氧化活性進行測試。1、[dpph·]法測定生物活性肽tiasgept的體外抗氧化活性1)實驗試劑及儀器試劑:1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl[dpph·]),日本wako公司生產;甲醇,上海國藥公司提供;實施例1獲得的乳源性生物活性多肽tiasgept。主要儀器:sunrise酶標儀,奧地利tecan公司產品;96孔細胞培養板,美國millipore公司制造;分析天平,meitelei-tolido公司產品。2)實驗方法(1)1mmol/l[dpph·]甲醇溶液用分析天平稱取0.349mg[dpph·]溶于1ml甲醇溶液中,配制得到的1mmol/l[dpph·]甲醇溶液,錫紙避光保存,即配即用。(2)[dpph·]甲醇標準曲線的測定在96孔板中按表1分別加入100μl[dpph·]甲醇標準曲線樣品,室溫靜置90min,用酶標儀在517nm處檢測吸光值。表1[dpph·]甲醇標準曲線溶液配制根據實驗結果,使用excel擬合曲線并計算回歸方程,結果見圖4(回歸方程:y=-0.192x+0.2271,r2=0.9991)。[dpph·]甲醇標準曲線的線性關系良好,相關系數為0.999,表明[dpph·]甲醇標準曲線精密度和準確度均符合檢測要求。從結果看,吸光度值與[dpph·]含量呈反比關系,[dpph·]含量越少,吸光值越高,即樣品清除自由基的能力越強。(3)[dpph·]法測定生物活性肽tiasgept的抗氧化活性1)樣品組:在96孔板中加入80μl濃度為1mmol/l[dpph·]甲醇溶液、按表2分別加入20μl不同濃度的待測樣品(tiasgept)、陽性對照1(2.5mg/ml的trolox)、陽性對照2(0.025mg/ml的trolox),和陰性對照(植酸);2)空白組:在同一96孔板上,以加入80μl濃度為1mmol/l[dpph·]甲醇溶液和20μl去離子水的樣品做空白對照。待檢測樣品加樣完畢后,室溫靜置90min,用酶標儀在517nm處檢測吸光值。按照下式計算自由基清除率,實驗結果見表2。公式:表2[dpph·]法測定生物活性多肽的抗氧化活性結果從表2可以看出,作為陽性對照的2.5mg/ml的trolox在相同條件下具有最強的清除自由基的能力,幾乎能清除溶液中所有的自由基,其次為0.025mg/ml的trolox、植酸、活性多肽。多肽tiasgept清除[dpph·]自由基率隨濃度變化均呈現倒鐘型,并且在濃度為2.5mg/ml處達到最高值,為25.85%。2、farp法測定生物活性肽tiasgept體外抗氧化能力1)實驗試劑和儀器總抗氧化能力檢測試劑盒(ferricreducingabilityofplasmafrap法),購自上海碧云天生物科技公司;feso4溶液(10mmol/l),水溶性維生素e(trolox溶液)(10mmol/l),實施例1獲得的乳源性生物活性多肽tiasgept。主要儀器:sunrise酶標儀,奧地利tecan公司產品;96孔細胞培養板,美國millipore公司制造;分析天平,meitelei-tolido公司產品;hws26型電熱恒溫水浴鍋,上海一恒科技有限公司制造。2)實驗方法(1)frap工作液的配制根據總抗氧化能力檢測試劑盒,將tptz7.5ml稀釋液、tptz750μl溶液、檢測緩沖液750μl混合均勻,并在37℃水浴中孵育,2小時h內用完。(2)feso4標準曲線曲線的制作測定在96孔板中先加入180μlfrap工作液,按表3加入5μlfeso4標準曲線溶液,輕輕混勻,37℃孵育3-5min后,用酶標儀在593nm處測定吸光值。表3feso4標準曲線測定的溶液配制feso4濃度與吸光值呈良好的正比關系,feso4濃度越高,吸光值越高。本發明feso4標準曲線結果見圖5,標準曲線的線性關系良好,相關系數為0.998,feso4標準曲線的精密度和準確度均符合檢測要求,可用于后續計算。(3)frap法測定生物活性多肽tiasgept的抗氧化能力在96孔板中先加入180μlfrap工作液,空白對照孔中加入5μlddh2o,樣品檢測孔內加入5μl待測樣品、陽性對照內加入5μl植酸,輕輕混勻,37℃孵育3-5min后,用酶標儀在593nm處測定吸光值。總抗氧化能力表示方式以feso4標準溶液的濃度來表示。按照下式計算自由基清除率,實驗結果見表4。表4farp法測定生物活性多肽tiasgept的總抗氧化能力結果通過總抗氧化能力法(ferricreducingabilitypowerfrap法)對多肽tiasgept的體外總抗氧化活性進行了測定,發現生物活性多肽tiasgept具有較好的還原氧化物質的能力;在濃度為4mg/ml情況下,多肽tiasgept的總抗氧化水平達到0.0231mmol/g;說明生物活性多肽tiasgept的總抗氧化能力,高于同等濃度下的具有弱抗氧化活性的植酸,具有顯著性(p>0.05)差異。因此,可認定發明的生物活性多肽tiasgept具有顯著的抗氧化能力。實施例3生物活性肽的促進機體免疫力活性實驗一、mtt法測定生物活性多肽tiasgept的體外淋巴細胞增殖能力實驗1)實驗材料與儀器:試劑與材料:實驗動物balb/c小鼠(雄性6-8周齡,上海交通大學農業與生物學院動物實驗中心);實施例1獲得的乳源性生物活性多肽tiasgept;小鼠淋巴細胞提取液(購自索來寶公司);rpmi1640培養基(購自gibco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(mtt,購自amresco公司);伴刀豆蛋白(cona,購自sigma公司);牛血清白蛋白(bsa,購自genebase公司);胃蛋白酶(購自sigma公司);胰酶(corolasepp,購自ab公司)。儀器:lrh-250f生化培養箱,上海恒科技有限公司;gl-22m高速冷凍離心機,上海盧湘儀離心機儀器有限公司;heracell150co2培養箱,heraeus公司;dragonwellscanmk3酶標儀,labsystems公司;alpha1-2-ld真空冷凍干燥機,christ公司;超高效液相色譜-四極桿飛行時間質譜儀,waters公司。2)實驗方法:無菌條件下取小鼠脾臟,用淋巴細胞提取液提取小鼠淋巴細胞,進行元代培養。用完全rpmi1640培養液將細胞密度調整為2.5×106個/ml。在96孔細胞培養板中依次加入:100μl小鼠淋巴細胞懸液,100μlrpmi1640完全培養液,20μl伴刀豆蛋白,100μl樣品。另外,設置空白對照組(ph7.2~7.4,3mol/l的pbs)和陰性對照組(500μg/mlbsa),研究表明其對于體外淋巴細胞增殖沒有影響。每組3個平行實驗樣。在5%co237℃培養箱中培養68h后,無菌條件下每孔加入20μlmtt,繼續培養4h,小心棄去上清液,每孔加入100μl二甲基亞砜,37℃生化培養箱孵化10min,搖勻,用酶標儀在570nm處測定吸光值。體外淋巴細胞增殖能力用刺激指數來表示,計算方法如下:式中:a1為空白對照在570nm處下的吸光值;a2為陰性對照組在570nm處下的吸光值,a3為實驗組在570nm處下的吸光值。3)實驗結果及分析實驗結果見表5。由表5可知,在生物活性肽tiasgept的質量濃度為100μg/ml的條件下,乳源性生物活性肽tiasgept的刺激指數大于bsa,說明tiasgept一定程度上能刺激體外小鼠淋巴細胞的增殖。并且tiasgept的刺激指數達到了1.159,和陰性對照組具有顯著差異(p<0.05)。因此,可以認定該活性多肽tiasgept具有顯著促進小鼠淋巴細胞增殖的能力,可以作為一種保健品或者添加劑食用,能夠提高動物和人體的免疫力。表5生物活性多肽tiasgept對體外淋巴細胞增殖的影響實驗分組刺激指數si陰性對照組1tiasgept1.159±0.035*注:*號標記為與陰性對照比較,有顯著性差異(p<0.05)。二、mtt法測定生物活性多肽tiasgept的體外巨噬細胞增殖能力實驗1)實驗試劑及儀器試劑:實驗動物balb/c小鼠(雄性6-8周齡)上海交通大學農業與生物學院動物實驗中心;實施例1獲得的乳源性生物活性多肽tiasgept;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(mtt)amresco公司;lps(脂多糖)sigma公司;牛血清白蛋白(bovineserumalbumin,bsa)genebase公司;三聯溶解液,含10%sds、5%異丁醇以及0.012mol/lhcl的水溶液。儀器設備:lrh-250f生化培養箱上海恒科技有限公司;gl-22m高速冷凍離心機上海盧湘儀離心機儀器有限公司;heracell150co2培養箱heraeus公司;dragonwellscanmk3酶標儀labsystems公司。2)試驗方法:balb/c小鼠腹腔注射2ml的2%(w/w)滅菌淀粉溶液,連續注射三天,最后一次注射24小時后斷頸處死。剝去腹部皮膚,用注射器吸取4℃磷酸鹽緩沖液(pbs)反復沖洗腹腔,離心管收集沖洗液后,離心(1000rpm,4℃)10分鐘后棄上清,用4℃rpmi1640完全培養液(含10%fbs)洗滌兩次,0.2%臺盼藍溶液染色做細胞活力檢測,確認采集到的有活力巨噬細胞占95%以上。細胞計數板讀數后,調整細胞濃度至合適濃度。將已吹打至完全懸浮的細胞懸液以合適體積加入96孔細胞培養板,37℃、5%co2環境下培養4小時后,吸棄孔中液體,用37℃rpmi1640完全培養液小心清洗細胞培養板孔底,洗去未貼壁的細胞和細胞碎片,得到純化后的貼壁腹腔巨噬細胞。每孔加入0.2mlrpmi1640完全培養基,實驗用小肽樣品及lps事先溶解于培養基后加入,開始細胞培養。得到純化后的貼壁腹腔巨噬細胞后,實驗組每孔加溶解有生物活性多肽lplp(1mg/ml)的rpmi1640完全培養液(10%fbs)200μl/孔,連續培養48h;陰性對照組每孔加溶解有bsa(500μg/ml)的rpmi1640完全培養液(10%fbs)200μl/孔;空白組添加rpmi1640完全培養液(10%fbs)200μl/孔,連續培養48h。并且,實驗組、陰性對照組和空白組又分別設正常組和炎癥組;炎癥組在培養到24h時加入lps至終濃度為100ng/ml;正常組不加lps;并且正常組和炎癥組在44h時加入5%mtt20μl/孔;細胞培養達到48h后加入100μl/孔的三聯溶解液以終止培養,隔夜溶解后,在波長570nm下用酶標儀測各孔的吸光度值(od570),生長指數(growthindices)的計算公式如下:其中,空白培養液為含10%fbs的rpmi1640完全培養液。3)實驗結果及分析實驗結果見表6,由表6可知,在添加1mg/ml生物活性多肽tiasgept的條件下,正常組和炎癥組的巨噬細胞均有增殖。而且與陰性對照組比較,均有顯著性差異(p<0.01)。說明生物活性多肽tiasgept對體外巨噬細胞具有顯著的增殖作用。表6生物活性多肽tiasgept對體外巨噬細胞增殖的影響實驗分組正常組gi炎癥組gi陰性對照組11tiasgept(1mg/ml)1.103±0.0520**1.159±0.0385**注:*表示與陰性對照比較,有顯著性差異(p<0.05);**表示與陰性對照組比較,有顯著性差異(p<0.01)三、生物活性多肽tiasgept的促巨噬細胞一氧化氮誘生量的測定(griess法)1)實驗試劑及儀器試劑:實驗動物balb/c小鼠(雄性6-8周齡)上海交通大學農業與生物學院動物實驗中心;實施例1獲得的乳源性生物活性多肽tiasgept;lps,購自sigma公司;中性紅染色液,碧云天生物技術研究所生產。儀器設備:lrh-250f生化培養箱上海恒科技有限公司;gl-22m高速冷凍離心機上海盧湘儀離心機儀器有限公司;heracell150co2培養箱heraeus公司;dragonwellscanmk3酶標儀labsystems公司。2)試驗方法:加入細胞個數為2×106/ml的細胞懸液100μl/孔,貼壁純化后加入含肽的rpmi1640完全培養液(10%fbs)200μl/孔,炎癥組在24h時加入lps至終濃度10μg/ml,連續培養48h后,收集培養液上清50μl/孔,在培養液上清中依次添加griess試劑1和griess試劑2各50μl/孔,室溫反應10分鐘后,在540nm波長下測定吸光度值(od540)。3)實驗結果及分析:表7生物活性多肽tiasgept促巨噬細胞一氧化氮誘生量的測定實驗分組正常組炎癥組細胞空白0.0592±0.005250.3241±0.0381tiasgept1mg/ml0.1289±0.0257**0.4899±0.0241**tiasgept0.5mg/ml0.1232±0.0130**0.3356±0.0305**tiasgept0.1mg/ml0.2474±0.0193**注:*,與陰性對照比較,有顯著性差異(p<0.05);**,與陰性對照組比較,有顯著性差異(p<0.01)實驗結果見表7,由表7可知,在實驗組中添加生物活性多肽tiasgept,濃度分別為1mg/ml和0.5mg/ml,對于正常情況下生長和lps造炎癥情況下生長的促進巨噬細胞的一氧化氮誘生量均有促進作用。與細胞空白組相比,具有顯著性差異(p<0.05)。當生物活性多肽tiasgept的添加濃度為0.1mg/ml,在lps造炎癥情況下相比,也能促進巨噬細胞一氧化氮誘生量的增加,并具有顯著性差異(p<0.05)。但是與正常情況下生長的細胞空白組相比,沒有顯著性差異。說明生物活性多肽tiasgept在一定濃度條件下具有促進巨噬細胞一氧化氮誘生量增加的能力。上述的對實施例的描述是為便于該
技術領域:
的普通技術人員能理解和使用發明。熟悉本領域技術的人員顯然可以容易地對這些實施例做出各種修改,并把在此說明的一般原理應用到其他實施例中而不必經過創造性的勞動。因此,本發明不限于上述實施例,本領域技術人員根據本發明的揭示,不脫離本發明范疇所做出的改進和修改都應該在本發明的保護范圍之內。<110>浙江輝肽生命健康科技有限公司<120>一種生物活性多肽tiasgept及其制備方法和應用<160>3<170>patentinversion3.3<210>1<211>8<212>prt<213>人工序列<220><223>生物活性多肽<400>1thrilealaserglygluprothr5<210>2<211>24<212>dna<213>人工序列<220><223>生物活性多肽編碼序列<400>2accattgctagtggcgagcctaca24<210>3<211>190<212>prt<213>人工序列<220><223>κ-酪蛋白變體a氨基酸序列<400>3<400>3metmetlysserphepheleuvalvalthrileleualaleuthr51015leupropheleuglyalaglngluglnasnglngluglnproile202530argcysglulysaspgluargphepheserasplysilealalys354045tyrileproileglntyrvalleuserargtyrprosertyrgly505560leuasntyrtyrglnglnlysprovalalaleuileasnasngln657075pheleuprotyrprotyrtyralalysproalaalavalargser808590proalaglnileleuglntrpglnvalleuserasnthrvalpro95100105alalyssercysglnalaglnprothrthrmetalaarghispro110115120hisprohisleuserphemetalaileproprolyslysasngln125130135asplysthrgluileprothrileasnthrilealaserglyglu140145150prothrserthrprothrthrglualavalgluserthrvalala155160165thrleugluaspserprogluvalilegluserproprogluile170175180asnthrvalglnvalthrserthralaval185190當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1