一種原初態納米材料致哺乳動物癌變的方法與流程
本發明涉及納米材料生物安全性檢測領域,尤其涉及一種原初態納米材料致哺乳動物癌變的方法。
背景技術:
現代醫學研究表明,癌癥的發生發展是由多基因、多因素、多階段共同長期相互作用的結果。機體自身遺傳因素(geneticfactors,基因突變及遺傳變異)和環境污染物(environmentalpollutants)為導致癌癥發生發展的兩大類重要因素。環境污染物一方面可能會導致基因突變而致癌,另一方面因為已經發生基因突變的機體對環境污染物的刺激更加敏感,而易發生癌癥。同時,有報道表明,環境污染物的持續作用還能增強多種腫瘤的發展。納米材料作為人類廣泛接觸的一種新型環境污染物,已被證實可致dna損傷和基因突變,但其致/促癌性目前尚無定論。為何納米材料可致突卻未見致癌?我們認為不一定是納米材料沒有致癌性(納米二氧化鈦已被列為疑似致癌物),而可能是由于目前研究思路和研究手段受限。我們推測其中一個重要的原因可能在于:受試模型的選擇還不是十分適合。我們需要更多的考慮“機體自身遺傳因素”的影響,選擇自身已具有某個/些基因突變的受試細胞和實驗動物模型。事實上,我們現實生活中也有很多人很多動物自身就具有遺傳不穩定性。據報道,人類在進化歷程中,突變可自然發生。保守的估計,自人類與黑猩猩區分的那一刻起,人類每代每個二倍體基因組平均發生4.2個氨基酸的突變。雖然這些突變至少有38%為自然選擇所去除,但每代二倍體細胞中每個基因組仍可保留1.6個新突變。這些已經存在的突變可能會導致個體更容易受環境污染物(比如納米材料)的誘導而發生癌癥。納米材料致哺乳動物細胞惡性轉化的有效暴露方法請參考我們之前申請的專利(申請號:201611078908.x)。本發明旨在上述體外細胞實驗(invitro)的基礎上,將經過“原初態”納米材料(指生產出來后尚未釋放入環境中的原始狀態的納米材料)長期的、慢性的、低劑量的處理后發生了惡性轉化的哺乳動物細胞(該細胞系自身存在酪氨酸磷酸酶shp-2基因的點突變,具有遺傳不穩定性)注射入小鼠皮下,一定時間之后我們既能直接肉眼觀察“原初態”納米材料是否誘發腫瘤,又能通過病理切片、顯微觀察等技術手段鑒定該腫瘤是否會發生遷移轉化。該發明既能為納米材料的致癌性研究提供體內實驗(invivo)數據,又能為納米材料安全性評估和腫瘤的高發提供新的線索,具有重要的現實意義。
現有納米材料致癌性的研究結果基本都是陰性的,其中一個重要原因在于納米材料本身存在各種有別于常規材料的特性,目前的大量研究都是針對納米材料的短時間較高劑量急性暴露的遺傳效應,而缺乏適用于納米材料的慢性低劑量長期暴露的穩定方法。總體來說,當前針對納米材料的安全性評估并不完善。已有的大量研究采用各類細菌(bacteria)為受試對象,但由于很大一部分納米材料(如納米銀、納米氧化鋅和納米氧化鈦等)均具有抗菌特性,再加上細菌本身缺乏將納米材料吞噬入體的能力,所以以細菌為受試對象的研究結果大多都是陰性的結果,即使有少部分研究暗示納米材料具有一定的遺傳毒性和致突能力,這部分研究也不能準確反映納米材料的真實毒性,原因就在于細菌并不適用于納米材料的毒性研究。哺乳動物細胞(mammaliancell)是來自哺乳動物體的細胞,目前已建成許多來自鼠、猴和人等重要的細胞系,這些離體細胞的培養由于可用來大量生產疫苗、重組蛋白和其他醫療產品而倍受重視,也被廣泛用于各種毒理學研究。生物醫學中經常用到哺乳動物細胞培養等離體實驗,例如,觀察某種新型藥物對腫瘤的影響,就不能直接作用于人體,而是要先在培養的腫瘤細胞上,只有動物模型通過了,才能到臨床試驗階段!針對納米材料的毒理學和致癌性研究也應先以哺乳動物細胞為受試對象進行invitro水平的實驗研究,在invitro研究結果的基礎上再開展動物個體水平的invivo研究。目前采用哺乳動物細胞為受試對象的納米毒理學研究也已大量開展,但在動物個體水平的研究還較匱乏,少量已有的研究結果也基本都是陰性的。綜上所述,以哺乳動物為受試對象,建立和發展一種針對納米材料進行個體水平(如小鼠)的致癌性研究的有效方法顯得尤為重要。
技術實現要素:
本發明公開了一種原初態納米材料致哺乳動物癌變的方法,用于解決現有技術中納米材料致癌性研究的不足,以及對受試對象選擇的不合理,本發明選用了哺乳動物細胞作為受試對象,經過長時間的、低劑量的慢性暴露并將惡性轉化的細胞植入小鼠體內,檢測原初態納米材料對哺乳動物癌變的影響,為納米材料安全性評估和腫瘤的高發提供新的線索,具有重要的現實意義;本發明公開的技術方案如下:
本發明公開了一種原初態納米材料致哺乳動物癌變的方法,包括以下實驗步驟:
步驟一、原初態納米材料母液的配置:將納米氧化鋅粉末直接分散于超純水中,配置成濃度為1mg/ml的儲備液,經高溫、高壓滅菌后,室溫密閉、避光保存,備用;
步驟二、原初態納米材料致哺乳動物細胞的惡性轉化,操作如下:
a.將正常小鼠胚胎成纖維細胞(shp-2+/+mef)和含激活突變的小鼠胚胎成纖維細胞(shp-2d61g/+mef)用含10%胎牛血清的dmem培養基在培養箱中培養;
b.分別取一皿處于對數期的、滿度為80%的shp-2+/+mef細胞和shp-2d61g/+mef細胞,經胰蛋白酶消化后分別種植于60mm培養皿中,培養24小時,待細胞生長至對數生長期后,棄去原培養液;再向每個培養皿中分別加入稀釋后的儲備液與含10%胎牛血清的dmem培養基混合液,培養24小時后,去除混合液,每皿細胞用1.5ml磷酸鹽緩沖液漂洗3遍,漂洗后,每個培養皿細胞中再加入4ml含10%胎牛血清的dmem培養基連續培養3天;待長滿后,用胰蛋白酶酶解消化后開始第二輪納米材料的慢性處理;循環操作,連續暴露60代(即6個月)完成慢性暴露的過程;
步驟三、用原初態納米材料誘發裸鼠成瘤:購買4周齡的雌balb/c裸鼠,spf級環境中飼養一周后,提取步驟二中正處于對數生長期的、經過原初態納米氧化鋅慢性刺激達6個月的并發生惡性轉化的正常小鼠胚胎成纖維細胞和含激活突變的小鼠胚胎成纖維細胞組成細胞懸液,將細胞懸液在無菌培養室內接種至裸鼠皮下,誘發成腫瘤;
步驟四、對小鼠進行病理研究:待步驟三中的裸鼠有肉眼可見的瘤體后,每隔1天對所述瘤體的體積進行測量;待瘤體長大后,取出稱重,提取裸鼠肝、脾、肺等器官細胞,用電子顯微儀器進行細胞檢測,檢測腫瘤是否發生轉移。
進一步的,為了更加有利于細胞的培養,步驟二的操作a中培養箱為二氧化碳培養箱,培養箱內的培養環境為恒溫37℃,培養箱內含5%體積濃度的二氧化碳、恒定的酸堿度(ph值:7.2-7.4)和較高的相對飽和濕度(95%)。
進一步的,為了提供低劑量的(一般為亞細胞毒性的較低劑量)的毒性環境,步驟二的操作b中稀釋后的儲備液濃度為1.5μg/ml。
進一步的,考慮到現實生活中應用較多的納米材料的粒徑大小,步驟一中納米氧化鋅的粒徑為20nm。
進一步的,步驟二的操作b中正常小鼠胚胎成纖維細胞(shp-2+/+mef)和含激活突變的小鼠胚胎成纖維細胞(shp-2d61g/+mef),經胰蛋白酶消化后分別用細胞計數儀計數,種植的細胞數量均為1*105個。
進一步的,為了檢測連續慢性暴露細胞的惡性生物學行為,以及進一步反映納米材料的致癌性,步驟二的操作b中連續暴露60代(即6個月)完成慢性暴露的過程中,期間每隔5代凍存部分細胞。
進一步的,步驟三中細胞懸液中正常小鼠胚胎成纖維細胞和含激活突變的小鼠胚胎成纖維細胞濃度均為1*107/100μl。
進一步的,步驟三中細胞懸液在無菌培養室內接種至裸鼠的腋下。
進一步的,為了更好的研究腫瘤細胞在小鼠體內的生長情況,以進行更好的研究,步驟四中在對瘤體的體積進行測量時,用游標卡尺分別測量腫瘤垂直方向上的最長直徑a和最短直徑b,腫瘤體積v=0.5*a*b2,并將測量數據進行記錄。
與現有技術相比,本發明提供了“原初態”納米材料在小鼠個體水平進行致癌性研究的有效方法。利用酪氨酸磷酸酶突變的小鼠胚胎成纖維細胞所具備的自身遺傳不穩定性,加之納米材料長期的、低劑量的、慢性暴露之后所獲得的60代穩定細胞系,可避免因急性短時間暴露不適用于研究致癌性這一缺點,獲得發生惡性轉化的哺乳動物細胞。然后利用這種已經發生的惡性轉化的細胞注射入小鼠(腋下)皮下,利用存在免疫缺陷的裸鼠模型進行“原初態”納米材料的致癌性研究,可為納米材料的致癌性研究提供新的方法和思路。本發明提供的方法簡單,易于操作,成本低,結果可靠,可為納米材料安全性評估提供新的線索和依據,為納米材料致癌性研究提供新的思路和方法。
附圖說明
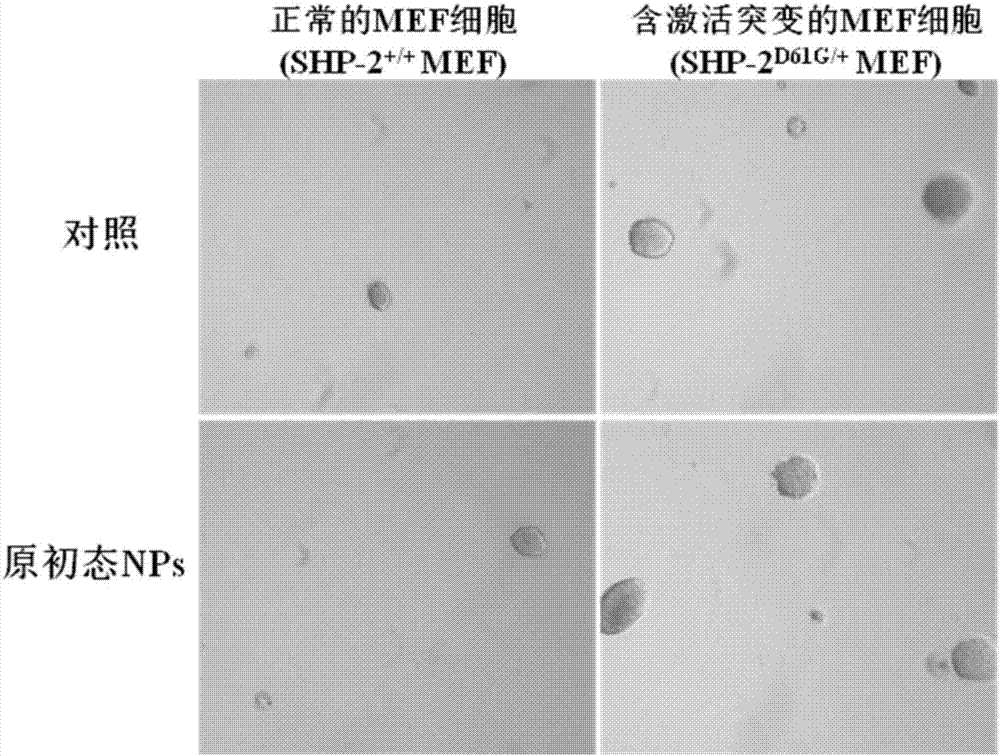
圖1為本發明原初態納米氧化鋅導致含shp-2基因突變的小鼠胚胎成纖維細胞軟瓊脂集落形成能力提高的示意圖。
具體實施方式
下面對本發明的實施例作詳細說明,本實施例在以本發明技術方案為前提下進行實施,給出了詳細的實施方式和具體的操作過程,但本發明的保護范圍不限于下述的實施例。
實施例1
實施例1公開了一種原初態納米材料致哺乳動物癌變的方法,包括以下實驗步驟:
步驟一、原初態納米材料母液的配置:將粒徑為20nm的納米氧化鋅分散于超純水中,配置成濃度為1mg/ml的儲備液,經高溫、高壓滅菌后,室溫避光保存、備用;
步驟二、原初態納米材料致哺乳動物細胞的惡性轉化,操作如下:
a.將正常的小鼠胚胎成纖維細胞(shp-2+/+mef)和含激活突變的小鼠胚胎成纖維細胞(shp-2d61g/+mef)用含10%胎牛血清的dmem培養基在二氧化碳培養箱中培養;培養箱的培養環境為恒溫37℃,培養箱內含5%體積濃度的二氧化碳、恒定的酸堿度(ph值:7.2-7.4)和相對飽和濕度為95%;
b.分別取一皿處于對數期的、滿度為80%的shp-2+/+mef細胞和shp-2d61g/+mef細胞,經胰蛋白酶消化后分別用細胞計數儀計數,分別種植1*105的細胞于60mm培養皿中,培養24小時,待細胞生長至對數生長期后,棄去原培養液;再向每個培養皿中分別加入稀釋后濃度為1.5μg/ml的上述儲備液與含10%胎牛血清的dmem培養基混合液,培養24小時后,去除混合液,每皿細胞用1.5ml磷酸鹽緩沖液漂洗3遍,漂洗后,每個培養皿細胞中再加入4ml含10%胎牛血清的dmem培養基連續培養3天;待長滿后,用胰蛋白酶酶解消化后開始第二輪納米材料的慢性處理;循環操作,連續暴露60代完成慢性暴露的過程;如圖1所示,用“原初態”納米氧化鋅刺激的shp-2+/+mef和shp-2d61g/+mef分別在軟瓊脂上培養,結果說明,該“原初態”氧化鋅納米材料致哺乳動物細胞惡性轉化的暴露方法確實有效,為了檢測連續慢性暴露細胞的惡性生物學行為,以及反映納米材料的致癌性,步驟二的操作b中連續暴露60代(即6個月)完成慢性暴露的過程中,期間每隔5代凍存部分細胞;
步驟三、用原初態納米材料誘發裸鼠成瘤:購買4周齡的雌balb/c裸鼠,spf級環境中飼養一周后,提取步驟二中正處于對數生長期的、經過原初態納米氧化鋅慢性刺激達6個月的并發生惡性轉化的正常小鼠胚胎成纖維細胞和含激活突變的小鼠胚胎成纖維細胞組成細胞懸液,細胞懸液中正常小鼠胚胎成纖維細胞和含激活突變的小鼠胚胎成纖維細胞濃度均為1*107/100μl;將細胞懸液在無菌培養室內接種至裸鼠皮下,誘發成腫瘤;
步驟四、對小鼠進行病理研究:待步驟三中的裸鼠有肉眼可見的瘤體后,每隔1天對所述瘤體的體積進行測量;在對瘤體的體積進行測量時,用游標卡尺分別測量腫瘤垂直方向上的最長直徑a和最短直徑b,腫瘤體積v=0.5*a*b2,并將測量數據進行記錄;待瘤體長大后,取出稱重,提取裸鼠肝、脾、肺等器官細胞,用電子顯微儀器進行細胞檢測,檢測腫瘤是否發生轉移。
實施例2
實施例2公開了一種原初態納米材料致哺乳動物癌變的方法,包括以下實驗步驟:
①“原初態”納米材料母液的配置方法,其步驟是:將購自美國nanoamor公司的納米氧化鋅(粒徑20nm),用超純水懸浮,配置成1mg/ml的儲備液,經高溫高壓滅菌后,在室溫避光保存備用。
②“原初態”納米材料致哺乳動物細胞惡性轉化的有效暴露方法,其步驟是:正常小鼠胚胎成纖維細胞(shp-2+/+mef)和含激活突變的小鼠胚胎成纖維細胞(shp-2d61g/+mef)(來源于美國casewesternreserveuniversity的quck實驗室)用含10%胎牛血清的dmem培養基在37℃,含5%co2的二氧化碳培養箱中培養(詳見《細胞細胞培養-基本技術指南(第四版)》)。分別取一皿處于對數期的滿度約80%的shp-2+/+mef細胞和shp-2d61g/+mef細胞,經胰蛋白酶消化后用細胞計數儀計數,種植1×105的細胞于50mm培養皿中,培養24小時,待細胞生長至對數生長期后,棄去原培養液,加入含有1.5μg/ml(一般為亞細胞毒性的較低劑量)上述“原初態”(fresh)納米材料懸濁液的新鮮培養液(納米材料+含10%胎牛血清的dmem),培養24小時后,去除條件培養基,每皿細胞用1.5ml磷酸鹽緩沖液(pbs)漂洗細胞5遍。漂洗后,每皿細胞加入4ml新鮮的不含納米材料的培養液(含10%胎牛血清的dmem)連續培養3天,待長滿后,用胰蛋白酶酶解消化后開始第二輪納米材料的低劑量慢性處理(納米材料濃度同上)。如此循環,連續暴露60代完成慢性暴露的過程,期間可每隔5代凍存部分細胞,以用于檢測這些細胞的惡性生物學行為(可在一定程度上有效反映納米材料的致癌性)。結果說明,該“原初態”氧化鋅納米材料致哺乳動物細胞惡性轉化的暴露方法確實有效。
③“原初態”納米材料誘發裸鼠成瘤的研究方法,其具體步驟是:
購買4周齡的雌balb/c裸鼠(裸鼠被越來越多的應用在腫瘤的研究領域,裸鼠的應用實現了在活體動物的條件下觀察腫瘤生長情況的可能),spf級環境中飼養一周后,取正處于對數生長期的已經經過“原初態”氧化鋅納米材料慢性刺激達6個月之久的、并已被證實發生了惡性轉化的野生型小鼠胚胎成纖維細胞(mef)、突變型小鼠胚胎成纖維細胞(d+)(接種量為2x107/100μl)懸液在無菌培養室內接種至裸鼠腋下。注射后每隔3天觀察腫瘤生長狀況,并稱重。待觀察到有肉眼可見的瘤體后,每隔1天測量瘤體體積v(mm3)=0.5×a×b2(用游標卡尺測量腫瘤兩個垂直方向的直徑,最長徑a(mm)和最短經b(mm)),分別記錄實驗數據。代瘤體長大合適大小后,取出瘤體,稱量瘤體的重量,同時提取肝、肺、脾等器官細胞進行電子顯微檢測。
- 還沒有人留言評論。精彩留言會獲得點贊!