一種偶氮苯接枝富勒烯納米雜化化合物以及制備方法與流程
本發明涉及能源材料技術領域,尤其是涉及一種偶氮苯接枝富勒烯納米雜化化合物以及制備方法。
背景技術:
隨著全球經濟的發展,能源危機日趨嚴重。研究、開發和利用清潔、可再生的太陽能已經成為當今社會解決能源危機的重要途徑。
偶氮苯(azobenzenes)是一類二氮烯衍生物,中間含有一個偶氮基團(-n=n-),兩邊的氫原子分別被兩個苯環所取代,具有反式(trans)和順式(cis)兩種構型。偶氮苯體系的光致異構特性是由分子內的-n=n-基團在光、熱等外界條件作用下進行順反異構化所引起的。采用不同波長的光束對偶氮基團進行光照,可使其可逆的在順式和反式兩種異構體間進行轉變。偶氮苯類分子的可逆光致異構化反應具有存儲太陽能的潛力,但傳統的偶氮苯分子存在單分子能量密度低和回復半衰期短等問題,限制了其在光儲熱領域的應用。
1985年,curl等人首次發現富勒烯c60,1991年huffman等人找到了一種可以宏量制備c60的方法,由此展開了富勒烯的研究熱潮,包括富勒烯c28、c32、c60、c70、c80等。富勒烯具有獨特的籠狀結構,其中六元環結構中親電的c=c鍵可以與自由基進行加成反應。富勒烯結構穩定,并且具有較好的催化性、光學性、超導性及熱穩定性。
現有技術中,偶氮苯與富勒烯納米復合材料存在接枝率低、能量密度低、穩定性差的技術缺陷,限制了其在光儲能領域的實際應用。因此,研發出一種接枝率高、能量密度高、回復半衰期長的偶氮苯接枝富勒烯納米雜化材料成為本領域技術人員亟待解決的問題。
技術實現要素:
有鑒于此,本發明要解決的技術問題在于提供一種偶氮苯接枝富勒烯納米雜化材料,本發明制備得到的偶氮苯接枝富勒烯納米雜化材料接枝率高,能量密度高、回復半衰期長。
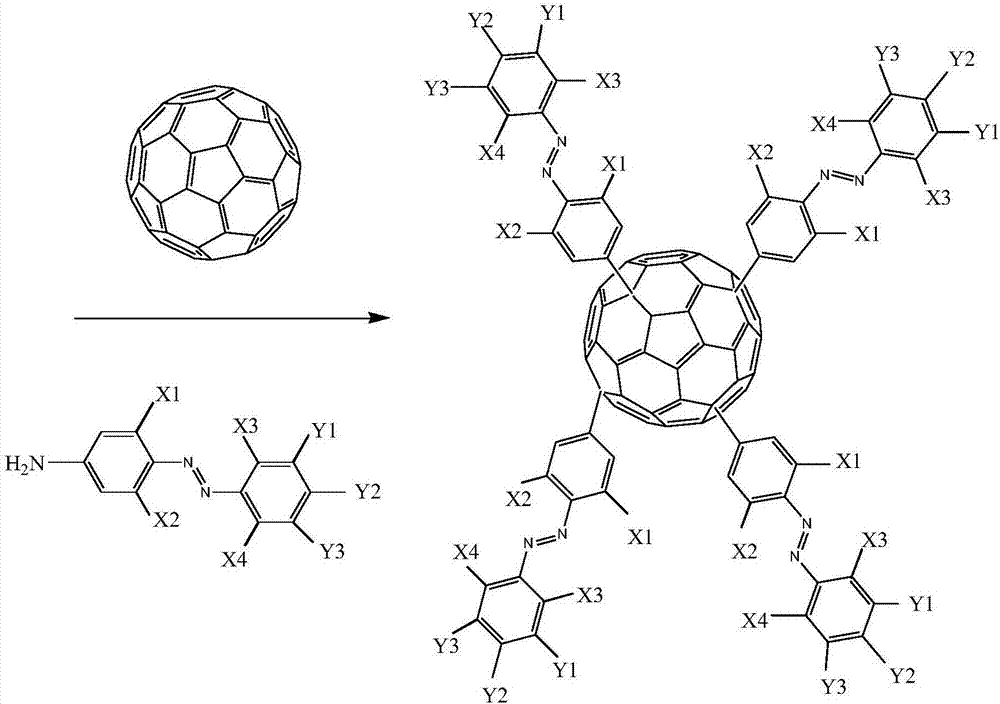
本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物:
其中,fc為富勒烯cm,m為富勒烯的碳原子數,m=50~120;n=1~8;
x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;
y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。
優選的,所述m為60~90;n=1~6。
優選的,所述x獨立的選自h、甲基、乙基、甲氧基、乙氧基、鹵原子中的一種或幾種;
y獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c5的烷基中的一種或幾種。
本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物的制備方法,包括:
a)將富勒烯進行預處理,得到修飾后的富勒烯;
將式(ii)結構的偶氮苯重氮化,得到重氮鹽;
b)將重氮鹽和修飾后的富勒烯反應,得到如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物;
其中,x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;
y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。
優選的,步驟a)所述富勒烯進行預處理為酸化或采用表面活性劑修飾。
優選的,所述酸化的酸為v(濃h2so4):v(濃hno3)=(5~1):1;所述表面活性劑選自十二烷基三甲基溴化銨、十二烷基苯磺酸鈉、十二烷基硫酸鈉和十二烷基磺酸鈉中的一種或幾種。
優選的,步驟b)所述重氮鹽和修飾后的富勒烯的摩爾比為(10~60):1。
優選的,步驟b)所述反應具體為:0~5℃反應2~4h,升溫至25~35℃反應12~48h。
優選的,步驟b)所述重氮化具體為:將式(ii)結構的偶氮苯在0~5℃冰浴中反應1~2h得到重氮鹽。
本發明提供了一種光熱燃料,由包括上述技術方案所述的化合物或上述技術方案所述的制備方法制備得到的化合物制備得到。
與現有技術相比,本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物:其中,fc為富勒烯cm,m為富勒烯的碳原子數,m=50~120;n=1~8;x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。本發明由一端含有氨基的多取代偶氮苯分子接枝于富勒烯表面形成偶氮苯接枝富勒烯納米雜化化合物,此化合物具有熱穩定性好,接枝率高的特點;同時通過增強分子間相互作用,提高了能量密度和回復半衰期。
附圖說明
圖1為本發明提供的偶氮苯接枝富勒烯納米雜化材料的合成原理圖;
圖2為本發明實施例中富勒烯c60的ft-ir光譜圖;
圖3為4-氨基-2,6-二甲基-4’-羧基偶氮苯的ft-ir光譜圖;
圖4為4-氨基-2,6-二甲基-4’-羧基偶氮苯接枝在富勒烯c60上的雜化材料的ft-ir光譜圖。
具體實施方式
本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物:
其中,fc為富勒烯cm,m為富勒烯的碳原子數,m=50~120;n=1~8;
x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;
y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。
在本發明中,fc為富勒烯,本發明對于所述富勒烯不進行限定,本領域技術人員熟知的富勒烯。富勒烯的結構為cm,其中m為富勒烯的碳原子數,m=50~120;優選的,m=60~90。
其中n為接枝上的偶氮苯的分子的個數,n=1~8;優選的,n=1~6。
其中,x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;x1、x2、x3、x4優選獨立的選自h、甲基、乙基、甲氧基、乙氧基、鹵原子中的一種或幾種;所述鹵原子優選為氟、氯、溴或碘。即為x1、x2、x3、x4為苯環上的取代基,可以相同或不同。
y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種;優選的,y獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c5的烷基中的一種或幾種;最優選的,y獨立的選自h、羥基、羧基、磺酸基、硝基和酰胺基中的一種或幾種。即為y1、y2、y3為苯環上的取代基,可以相同或不同。
本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物:其中,fc為富勒烯cm,m為富勒烯的碳原子數,m=50~120;n=1~8;x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。本發明由一端含有氨基的多取代偶氮苯分子接枝于富勒烯表面形成偶氮苯接枝富勒烯納米雜化化合物,此化合物具有熱穩定性好,接枝率高的特點;同時通過增強分子間相互作用,提高了能量密度和回復半衰期。
本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物的制備方法,包括:
a)將富勒烯進行預處理,得到修飾后的富勒烯;
將式(ii)結構的偶氮苯重氮化,得到重氮鹽;
b)將重氮鹽和修飾后的富勒烯反應,得到如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物;
其中,x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;
y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。
本發明首先將將富勒烯進行預處理,得到修飾后的富勒烯。
本發明所述富勒烯進行預處理為酸化或采用表面活性劑修飾。
本發明對富勒烯進行酸化的具體方式不進行限定,本領域技術人員熟知即可;優選具體為:稱取適量的富勒烯加入到混酸v(濃h2so4):v(濃hno3)=(5~1):1溶液中,室溫超聲分散2~4h,洗滌離心。
其中,所述酸化的酸優選為v(濃h2so4):v(濃hno3)=(5~1):1;更優選為v(濃h2so4):v(濃hno3)=(4~1):1;最優選為v(濃h2so4):v(濃hno3)=(4~2):1。
酸化后優選為洗滌至中性;本發明對于所述洗滌的具體方式不進行限定,本領域技術人員熟知的即可。
本發明對富勒烯采用表面活性劑修飾的具體方式不進行限定,本領域技術人員熟知的即可;優選具體為:稱取適量的富勒烯加入到質量分數為0.1%~2%的表面活性劑水溶液中,室溫超聲分散2~4h形成溶液。
本發明所述表面活性劑優選選自十二烷基三甲基溴化銨、十二烷基苯磺酸鈉、十二烷基硫酸鈉和十二烷基磺酸鈉中的一種或幾種;更優選為十二烷基苯磺酸鈉、十二烷基硫酸鈉和十二烷基磺酸鈉中的一種或幾種;最優選為十二烷基硫酸鈉或十二烷基磺酸鈉。
本發明所述表面活性劑的質量濃度優選為0.1%~2%;更優選為0.5%~1.5%。
將式(ii)結構的偶氮苯重氮化,得到重氮鹽。
其中,x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;x1、x2、x3、x4優選獨立的選自h、甲基、乙基、甲氧基、乙氧基、鹵原子中的一種或幾種;所述鹵原子優選為氟、氯、溴或碘。即為x1、x2、x3、x4為苯環上的取代基,可以相同或不同。
y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種;優選的,y獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c5的烷基中的一種或幾種;最優選的,y獨立的選自h、羥基、羧基、磺酸基、硝基和酰胺基中的一種或幾種。即為y1、y2、y3為苯環上的取代基,可以相同或不同。
本發明所述重氮化優選具體為采用亞硝酸鈉和鹽酸或硫酸對式(ii)結構的偶氮苯重氮化。
其中所述鹽酸或硫酸的濃度優選為0.3~0.7mol/l;更優選為0.5~0.6mol/l。
所述重氮化的條件優選具體為:將式(ii)結構的偶氮苯在0~5℃冰浴中反應1~2h得到重氮鹽。更優選為將式(ii)結構的偶氮苯在0~4℃冰浴中反應1~1.5h得到重氮鹽。
得到修飾后的富勒烯和重氮鹽后,將重氮鹽和修飾后的富勒烯反應,得到如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物。
其中,所述重氮鹽和修飾后的富勒烯的摩爾比優選為(10~60):1;更優選為(15~55):1;最優選為(20~50):1。
所述反應優選具體為:0~5℃反應2~4h,升溫至25~35℃反應12~48h;更優選具體為:0~4℃冰浴中反應2~3h,升溫至25~35℃反應12~36h。
反應后,優選將產物過濾,用溶劑清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰;而后真空干燥得到產物。
其中所述溶劑優選為去離子水、丙酮和dmf中的一種或幾種;所述真空干燥的溫度優選為30~50℃;更優選為35~40℃。所述真空干燥的時間優選為20~30h;優選為20~24h。
本發明提供的偶氮苯接枝富勒烯納米雜化化合物的合成原理圖如圖1所示,本發明實施例中富勒烯c60的ft-ir光譜圖如圖2所示。
本發明提供了一種光熱燃料,由包括上述技術方案所述的化合物或上述技術方案所述的制備方法制備得到的化合物制備得到。
本發明所述化合物在光熱燃料中用作光能轉化和儲存材料。
本發明還提供了上述技術方案所述的化合物或上述技術方案所述的合成方法制備得到的化合物在制備光熱燃料中的應用。
本發明提供了本發明提供了一種如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物的制備方法,包括:a)將富勒烯進行預處理,得到修飾后的富勒烯;將式(ii)結構的偶氮苯重氮化,得到重氮鹽;b)將重氮鹽和修飾后的富勒烯反應,得到如式(i)所示的偶氮苯接枝富勒烯納米雜化化合物;其中,x1、x2、x3、x4獨立的選自h、c1~c3的烷基、c1~c3的烷氧基和鹵原子中的一種或幾種;y1、y2、y3獨立的選自h、羥基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一種或幾種。本發明先通過預處理,將富勒烯變為水溶性易分散物質,而后將一端含有氨基的多取代偶氮苯分子接枝于富勒烯表面形成偶氮苯接枝富勒烯納米雜化化合物。本發明無需在有機溶劑中即可反應且接枝率高。同時得到的化合物熱穩定好、能量密度高、回復半衰期長。
為了進一步說明本發明,以下結合實施例對本發明提供的偶氮苯接枝富勒烯納米雜化化合物進行詳細描述。
實施例1
稱取1.3450g的4-氨基-2,6-二甲基-4’-羧基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去離子水中。攪拌均勻后再慢慢加入盛有50mlhci(0.5mol/l)溶液的燒杯中,置于冰浴中反應1h得到重氮鹽溶液。然后緩慢滴入120ml經過酸化的c60(1mg/ml)溶液中,繼續在冰浴中反應2h,然后升至室溫反應12h。將產物進行過濾,并用去離子水、丙酮和dmf反復清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到產物azo-1-c60。此產物能量密度相比azo分子提高約70%~170%,回復半衰期提高3~5個數量級,同時在30~50次重復光儲能/釋熱過程中保持優異的循環穩定性。。
實施例2
稱取1.2050g的4-氨基-2,6-二甲基-4’-羥基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去離子水中。攪拌均勻后再慢慢加入盛有50mlhci(0.5mol/l)溶液的燒杯中,置于冰浴中反應1h得到重氮鹽溶液。然后緩慢滴入120ml經過十二烷基硫酸鈉修飾的c60(1mg/ml)溶液中,繼續在冰浴中反應2h,然后升至室溫反應24h。將產物進行過濾,并用去離子水、丙酮和dmf反復清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到產物azo-2-c60。此產物能量密度相比azo分子提高約60%~140%,回復半衰期提高3~4個數量級,同時在30~50次重復光儲能/釋熱過程中保持優異的循環穩定性。
實施例3
稱取1.5250g的4-氨基-2,6-二甲基-4’-磺酸基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去離子水中。攪拌均勻后再慢慢加入盛有50mlhci(0.5mol/l)溶液的燒杯中,置于冰浴中反應1h得到重氮鹽溶液。然后緩慢滴入120ml經過酸化的c70(1mg/ml)溶液中,繼續在冰浴中反應3h,然后升至室溫反應36h。將產物進行過濾,并用去離子水、丙酮和dmf反復清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到產物azo-3-c70。此產物能量密度相比azo分子提高約60%~130%,回復半衰期提高3~4個數量級,同時在30~50次重復光儲能/釋熱過程中保持優異的循環穩定性。
實施例4
稱取1.5050g的4-氨基-2,6-二甲氧基-4’-羧基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去離子水中。攪拌均勻后再慢慢加入盛有50mlhci(0.5mol/l)溶液的燒杯中,置于冰浴中反應1h得到重氮鹽溶液。然后緩慢滴入120ml經過十二烷基硫酸鈉修飾的c70(1mg/ml)溶液中,繼續在冰浴中反應2h,然后升至室溫反應12h。將產物進行過濾,并用去離子水、丙酮和dmf反復清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到產物azo-4-c70。此產物能量密度相比azo分子提高約70%~150%,回復半衰期提高3~5個數量級,同時在30~50次重復光儲能/釋熱過程中保持優異的循環穩定性。
實施例5
稱取1.5650g的4-氨基-2,6-二甲基-3’,5’-二羧基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去離子水中。攪拌均勻后再慢慢加入盛有50mlhci(0.5mol/l)溶液的燒杯中,置于冰浴中反應1h得到重氮鹽溶液。然后緩慢滴入120ml經過酸化的c90(1mg/ml)溶液中,繼續在冰浴中反應2h,然后升至室溫反應24h。將產物進行過濾,并用去離子水、丙酮和dmf反復清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到產物azo-5-c90。此產物能量密度相比azo分子提高約90%~220%,回復半衰期提高3~5個數量級,同時在30~50次重復光儲能/釋熱過程中保持優異的循環穩定性。
實施例6
稱取1.6450g的4-氨基-2,6-二甲氧基-2’,6’-二甲基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去離子水中。攪拌均勻后再慢慢加入盛有50mlhci(0.5mol/l)溶液的燒杯中,置于冰浴中反應1h得到重氮鹽溶液。然后緩慢滴入120ml經過十二烷基磺酸鈉修飾的c90(1mg/ml)溶液中,繼續在冰浴中反應3h,然后升至室溫反應36h。將產物進行過濾,并用去離子水、丙酮和dmf反復清洗,直到濾液經uv-vis光譜檢測沒有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到產物azo-6-c90。此產物能量密度相比azo分子提高約50%~130%,回復半衰期提高2~4個數量級,同時在30~50次重復光儲能/釋熱過程中保持優異的循環穩定性。
以上所述僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!